亚临界R134a萃取樟树叶精油的工艺优化及抑菌研究
胡 珊, 梁卫驱, 谢佩吾, 罗华建, 连辉明, 黄 皓*
(1.东莞市农业科学研究中心,广东 东莞 523083; 2.广东省林业科学研究院广东省森林培育与保护利用重点实验室,广东 广州 510520)
1 材料与方法
1.1 原料、试剂和仪器
新鲜樟树(Cinnamomumcamphora(L.) Presl)枝叶,由广东华清园生物科技有限公司提供;马铃薯琼脂(PDA)培养基,广东环凯微生物科技有限公司;辣椒疫霉病菌(Phytophthoracapsici)、香蕉枯萎病菌(Fusariumoxysporumf. sp.cubense)、冬瓜枯萎病菌(F.oxysporum(Schl.) f.sp.benincasae)、水稻稻瘟病菌(Magnaportheoryzae)、西瓜炭疽病菌(Colletorichumorbiculare)、甘蔗赤腐病菌(C.falcatum)、玉米小斑病菌(Bipolarismaydis)、苹果轮纹病菌(Physalosporapiricola)、花生褐斑病菌(Cercosporaarachidicola)均由华南农业大学植物病理系提供。1,1,1,2-四氟乙烷(R134a)(纯度≥99.9%)、无水乙醇(分析纯)、聚山梨酯80(化学纯),均为市售。
GC-MS-QP2020 W/O气相色谱-质谱联用(GC-MS)仪,日本岛津公司;CBE-10L亚临界流体萃取实验室成套设备,河南省亚临界生物技术有限公司;Hei-VAP Advantage/ML/G3旋转蒸发仪,德国海道尔夫公司。
1.2 樟树叶亚临界R134a萃取
1.2.1新鲜樟树叶干燥处理方法 新鲜樟树叶均匀摆盘后,厚度以不超过烘盘边框为宜。采用空气能热泵设备在60 ℃、相对湿度≤50%的条件下干燥4~6 h(烘干时间根据枝叶量多少会有少许不同)。新鲜树叶含水率约为51%~52%,烘干后含水率约为4.5%~4.8%。将干叶真空包装后放置于阴凉干燥处备用。
1.2.2单因素试验 试验因素分别为:原料粒度、液料比、萃取温度、萃取时间和萃取次数。研究某一因素影响时,其他因素取固定值。初始萃取工艺为:称取2 mm孔径筛网粉碎得到的原料1 kg装入滤袋,置于亚临界萃取设备中,在液料比7∶1(L∶kg,下同)、萃取温度40 ℃的条件下重复萃取4次,每次40 min。所得萃取物用20倍体积的无水乙醇溶解,于-18 ℃下冷冻24 h,过滤,除去不溶的蜡质、纤维等成分,滤液经旋转蒸发(40 ℃,0.01 MPa),得樟树叶精油,计算得率[15-16]。
1.2.3正交试验 为确定最佳萃取工艺条件,选取萃取温度(40、 45和50 ℃)、萃取时间(30、 40和50 min)、萃取次数(2、 3和4次)3个因素,采用L9(34)正交试验设计,以樟树叶精油得率为考察指标,优化樟树叶精油亚临界R134a萃取工艺,精油的萃取流程及得率计算同单因素试验。
1.3 樟树叶水蒸气提取
采用《中华人民共和国药典》(2015版)附录XD水蒸气蒸馏法提取樟树叶精油。为减少挥发,采摘回实验室的鲜叶需在1周内完成精油提取工作,鲜叶每份称量400 g,提取液料比为3∶1(mL∶g),提取时间为2 h[17]。所得精油在0~5 ℃条件下保存,用于精油成分分析和抑菌作用研究。
1.4 樟树叶精油化学成分测定
气相色谱条件采用SH-Rxi-5Sil MS石英毛细管色谱柱(30 m×0.25 mm×0.25 μm),升温程序为初始柱温70 ℃,以2 ℃/min速率升温至160 ℃,保持2 min,再以10 ℃/min速率升温至220 ℃保持5 min,全程共运行51 min。进样口温度230 ℃,进样量0.5 μL,分流比为100∶1,载气为He(纯度99.99%)。质谱条件采用电离源为EI,电离电压70 eV,离子源温度200 ℃,接口温度250 ℃,范围为50~500m/z[18]。
1.5 樟树叶精油抑菌作用分析
参考文献[19]的方法,在无菌条件下,将樟树叶精油用2%吐温80乳化剂溶液稀释为300 mg/L。采用PDA平板对峙法进行樟树叶精油抑制作用测试,用6 mm打孔器打取植物病原真菌菌饼移入到PDA平板中央,在距菌饼约2 cm处等距离呈等边三角形的三点打孔,每个孔内加100 μL樟树叶精油溶液,每个处理3次重复,以2%吐温80乳化剂溶液为阴性对照,不添加任何物质的处理为空白对照。所有处理平板均放置28 ℃中培养至空白对照菌落长满,测量菌落直径。
[书籍] 序号 作者.书名[M].译者.版次.出版地:出版单位(国外出版单位可用标准缩写不加缩写点),出版年:起止页码.
1.6 数据处理方法
采用Origin 8.0作图,采用SPSS 26.0及Microsoft Excel 2007软件对数据进行分析,试验数据为平均值±标准差。采用单因素方差分析(One-way ANOVA),以最小显著性差异法(LSD)多重比较检验不同处理之间的差异显著性(α=0.05)。
2 结果与讨论
2.1 精油萃取的单因素试验结果
2.1.1原料粒度 干燥后的樟树叶分别采用粗碎机和粉碎机处理,粉碎原料粒度明显小于粗碎。不同粒度的原料经亚临界R134a萃取后的精油得率见表1。粉碎原料的精油得率显著高于粗碎原料,经不同孔径筛网粉碎得到的原料之间精油得率也有显著差异,其中采用2 mm孔径筛网粉碎得到的原料精油得率最高,为(2.60±0.07)%。因此,选择2 mm孔径筛网粉碎得到的原料作为后续优化试验的原料粒度。
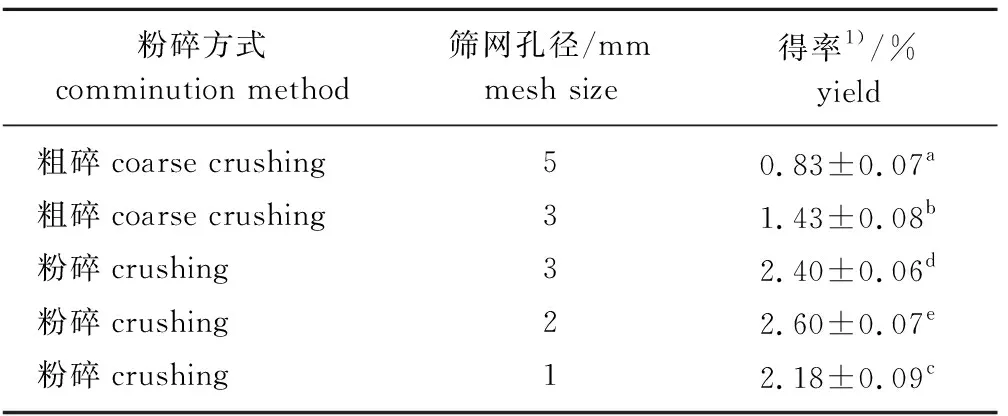
表1 原料粒度对亚临界R134a萃取樟树叶精油得率的影响Table 1 Effects of raw material granularity on the yield of essential oil from C.camphora leaves by subcritical R134a extraction
2.1.2液料比 根据萃取罐容量及装料量,最大液料比为7∶1,将原料浸没的最小液料比为5∶1。液料比单因素试验结果见图1(a),液料比对精油的萃取得率有显著影响,适当增大液料比可提升精油得率,当液料比大于6∶1时,得率提升不显著,且会增加溶剂的回收时长和能耗,因此选择6∶1做为后续优化试验的液料比。
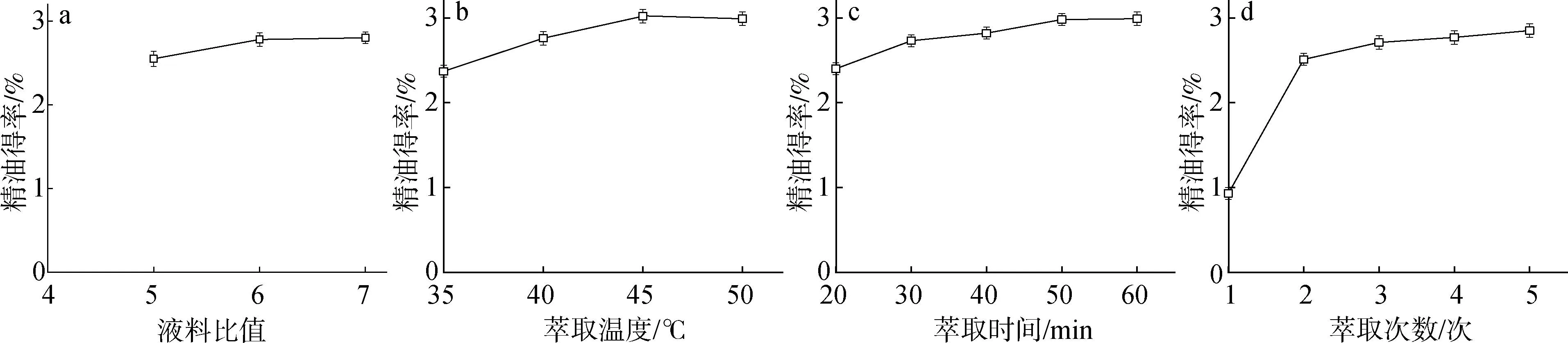
a.液料比liquid-solid ratio;b.萃取温度extraction temperature;c.萃取时间extraction time;d.萃取次数extraction times图1 提取条件对亚临界R134a萃取樟树叶精油得率的影响Fig.1 Effects of extraction conditions on the yield of essential oil from C.camphora leaves by subcritical R134a extraction
2.1.3萃取温度 根据萃取设备工作压力范围,以5 ℃为梯度选取最高不超过50 ℃的4个温度进行萃取试验,结果见图1(b)。萃取温度对萃取效果有显著影响,适当提高萃取温度可提升精油得率,温度超过45 ℃时精油得率提升效果不显著,综合考虑,萃取温度选择40~50 ℃较为适合。
2.1.4萃取时间 萃取时间单因素试验结果见图1(c)。在固定萃取次数(4次)条件下,单次萃取时间30与40 min时的精油得率无显著差异,相对20 min有显著差异,50和60 min无显著差异。相对于单次萃取时间为30 min,在萃取时间延长1倍的条件下精油得率仅有小幅提升(约9.4%)。综合考虑,单次萃取时间选择30~50 min较为适合。
2.1.5萃取次数 萃取次数单因素试验结果见图1(d)。萃取次数对萃取效果有显著影响,萃取2次(得率约2.51%)相对于萃取1次(得率约0.93%),精油得率有极显著的提升(提升约170%,P<0.01),之后逐渐增加萃取次数,得率提升幅度均较小,萃取5次相对于2次仅提升13.5%,但大大增加了工序的繁琐程度及能耗,综合考虑,次数选择2~4次较为适合。
2.2 精油萃取的正交试验结果
正交试验方案及结果见表2,影响得率的主次因素依次为萃取次数>萃取时间>萃取温度,最佳工艺为原料粒径≤2 mm,液料比为6∶1,萃取温度45 ℃,萃取时间40 min/次,萃取4次。表3方差分析结果表明萃取次数对精油得率影响极显著(P<0.01),萃取时间影响显著(P<0.05),萃取温度影响不显著(P>0.05),对精油得率影响的主次顺序与极差分析结果一致。在最佳工艺条件下进行樟树叶精油萃取重复试验,得率为(2.87±0.08)%。
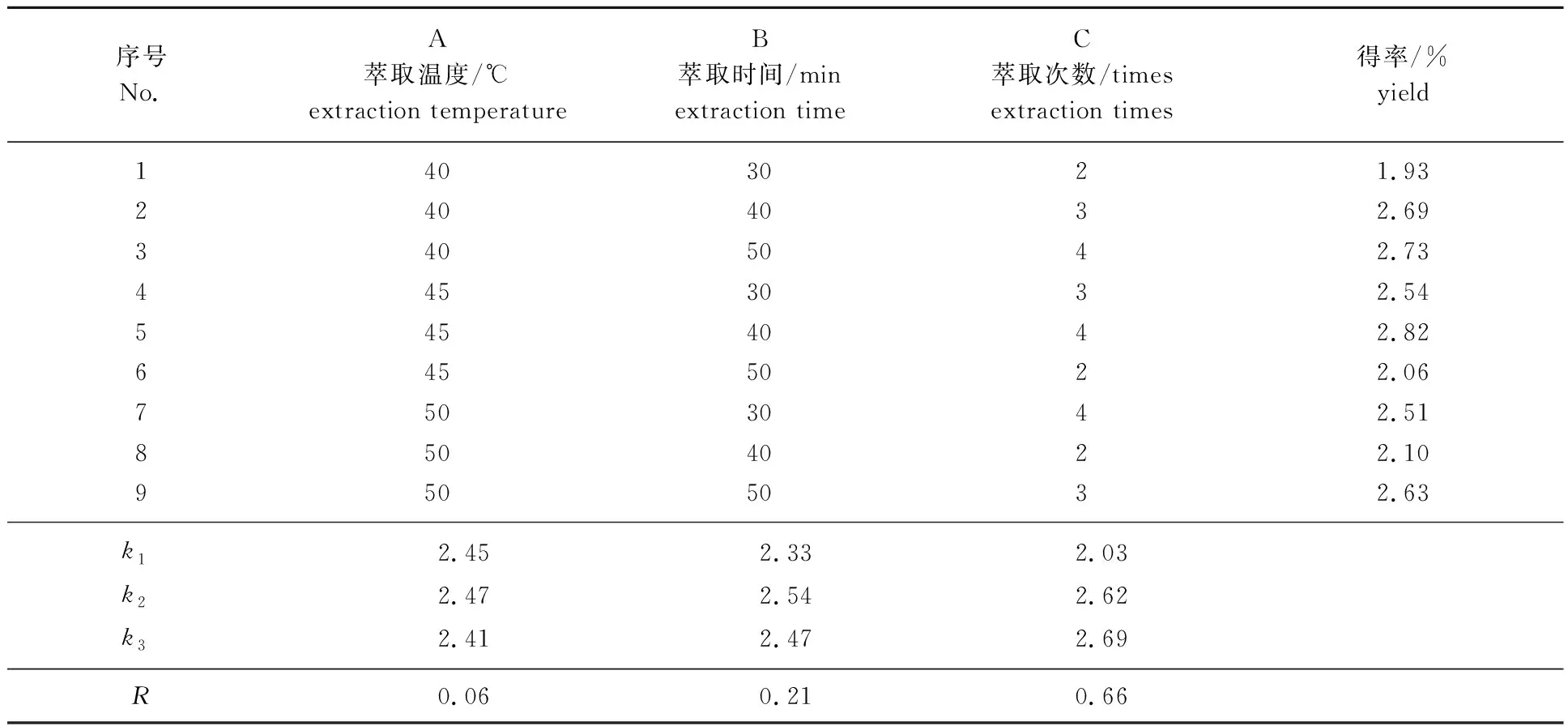
表2 正交试验方案设计及结果Table 2 Orthogonal experimental scheme design and results

表3 方差分析结果Table 3 Variance analysis results
2.3 不同方法提取精油的化学成分对比
利用GC-MS对2种方法提取所得的樟树叶精油进行化学成分分析,总离子流色谱见图2。使用峰面积归一化法确定各化学成分的相对峰面积,分析结果见表4。
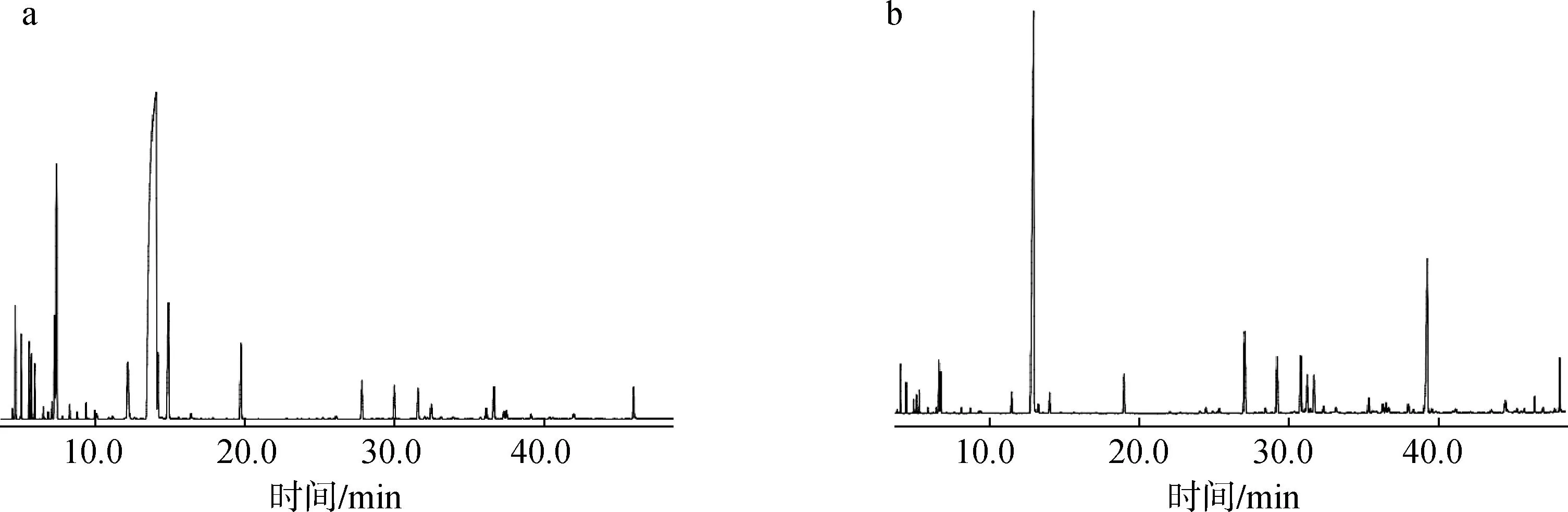
a.水蒸气提取steam extraction;b.亚临界R134a萃取subcritical R134a extraction图2 樟树叶精油的GC-MS总离子流色谱Fig.2 GC-MS total ion chromatogram of C. camphora leaf essential oil
水蒸气提取和亚临界R134a萃取得到的2种樟树叶精油中分别鉴定出39和35种化合物,相对总峰面积分别为99.97%和99.91%。2种叶精油的化学组分均以醇类和烃类化合物为主,其中醇类分别有10种和8种,相对峰面积分别为70.48%和65.58%;烃类分别有24种和20种,相对峰面积分别为22.48%和23.41%;除此以外,2种精油中还检测出酮类化合物分别为3种和5种,酯类化合物均为2种。
2种叶精油共同鉴定出的化合物有27种,其中烃类化合物15种,醇类化合物7种,酯类化合物2种和酮类化合物3种。龙脑是2种叶精油的主要化学成分,其在水蒸气提取精油的相对峰面积(64.29%)大于亚临界R134a萃取精油(58.09%)。
樟树精油中的非龙脑成分如石竹烯、樟脑、柠檬烯等也是医药、化工等行业的重要原料。2种叶精油中非龙脑化学成分的相对峰面积分别为35.58%和41.82%。水蒸气提取叶精油中相对峰面积超过1%的非龙脑化学成分有14种,分别为α-蒎烯、莰烯、桧烯、β-蒎烯、D-柠檬烯、石竹烯、α-石竹烯、大根香叶烯D、桉叶油醇、松油烯-4-醇、α-松油醇、樟脑、乙酸龙脑酯和乙酸橙花叔醇酯;亚临界R134a萃取叶精油中相对峰面积超过1%的非龙脑化学成分有12种,分别为石竹烯、α-石竹烯、大根香叶烯D、氧化石竹烯、 4(14),11-桉叶二烯、异丁子香烯、桉叶油醇、α-松油醇、桉油烯醇、樟脑、蒿酮和乙酸龙脑酯。
2.4 不同方法提取精油的抑菌作用
采用平板对峙法测定2种方法提取樟树叶精油对植物病原真菌的抑制作用,结果见表5。亚临界R134a萃取樟树叶精油对9种植物病原菌均有不同程度的抑制作用,水蒸气提取樟树叶精油除对苹果轮纹病菌没有抑制作用外,对其余8种植物病原菌均有不同程度的抑制作用。从表5可见,2种樟树叶精油对不同真菌的抑菌率相差较大,亚临界R134a萃取樟树叶精油对病原真菌的抑菌效果优于水蒸气提取精油。其中,亚临界R134a萃取樟树叶精油对9种病原真菌抑制率在43.22%~71.74%之间,水蒸气提取樟树叶精油对8种病原真菌抑制率在18.96%~62.87%之间,2种樟叶精油均对辣椒疫霉病菌的抑制率最高。
植物精油的抑菌活性强弱与其化学组分密切相关。Kalemba等[20]总结了植物精油功能基团抗菌活性的强弱排序为酚类>肉桂醛>醇类>醛类=酮类>酯类>碳氢化合物类。2种樟树叶精油的化学成分均为醇类、烃类、酮类、酯类4类化合物,主要成分为醇类化合物,其相对峰面积是水蒸气提取樟树叶精油高于亚临界R134a萃取樟树叶精油,其余3类化合物的相对峰面积均为亚临界R134a萃取樟树叶精油高。此外,已有研究表明,龙脑对白色念珠菌、铜绿假单胞菌、金黄色葡萄球菌和大肠杆菌等细菌,异常汉逊氏酵母菌和球毛壳霉均有一定的抑制作用,其他成分如柠檬烯、β-水芹烯、α-蒎烯等也具有不同程度的抗菌活性[21-23]。因此,樟树叶精油的抑菌作用可能是各种成分的协同效果,这与胡文杰等[24]研究结果一致。
3 结 论
3.1以R134a为萃取溶剂,采用亚临界流体萃取樟树叶精油,通过正交试验优化得到最佳工艺条件为原料粒度≤2 mm,液料比为6∶1(L∶kg),萃取温度45 ℃,萃取时间40 min/次,萃取4次,精油得率为(2.87±0.08)%。影响得率的主次因素依次为萃取次数>萃取时间>萃取温度。
3.2比较研究亚临界R134a萃取和水蒸气提取2种方法得到的樟树叶精油化学成分差异和抑菌活性,GC-MS分析2种叶精油分别鉴定出39和35种化合物,相对总峰面积分别为99.97%和99.91%。
3.32种叶精油的化学组分均以醇类和烃类化合物为主,龙脑是2种叶精油的主要化学成分,水蒸气提取精油的龙脑相对峰面积(64.29%)大于亚临界R134a萃取精油(58.09%)。
3.42种叶精油对辣椒疫霉病菌、花生褐斑病菌等9种植物病原菌均有不同程度的抑制作用,亚临界R134a萃取樟叶精油对病原真菌的抑菌效果均优于水蒸气提取精油。2种叶精油均对辣椒疫霉病菌的抑制率最高,分别为71.74%和62.87%。

