苯并噻吩衍生的三氟乙基酮亚胺的合成
周 顺, 钱慧玲, 彭巧巧, 王浩宇, 葛真真,3, 周鸣强,3*, 赵建强,, 袁伟成,*
(1. 中国科学院 成都有机化学研究所 手性药物国家工程研究中心,四川 成都 610041;2. 成都大学 高等研究院,四川 成都 610106; 3. 中国科学院大学,北京 100049)
近20年来,含氟有机分子在生命科学和材料科学中发挥了相当重要的作用[1-4]。氟具有独特的性质,如氟是电负性最大的元素,是除氢以外半径最小的原子,C—F键是碳参与的最强单键。由于氟的这些特殊性质,在分子中引入氟原子或者三氟甲基官能团通常能明显地改变分子的物理、化学和生物性质[5]。因此,三氟甲基官能团广泛存在于生物活性分子和先导化合物等诸多医药领域中。如图1所示,化合物1是胃蛋白酶抑制剂的类似物,可以防止蛋白质被快速水解[6]。化合物2为靶向抑制泛素-蛋白酶体降解通路抑制剂,已成功应用于多发性骨髓瘤的治疗[7]。化合物3是抗逆转录病毒药物依法韦仑,用于预防和治疗人类免疫缺陷病毒(HIV)的感染[8]。

图1 含三氟甲基手性中心的生物活性分子Figure 1 Bioactive molecules containing trifluoromethyl chiral center
2005年,PRAKASH课题组[9]首次报道了三氟丙酮酸乙酯与吲哚的不对称Friedel-Crafts反应,得到了一系列含三氟甲基官能团的吲哚衍生物。2015年,王锐课题组[10]首次报道了靛红衍生的三氟甲基酮亚胺的合成方法,并成功与α,β-不饱和醛反应得到[3+2]环加成产物。除此之外,袁伟成课题组[11]、鲁桂课题组[12]和杜大明[13]课题组陆续报道了使用三氟乙基靛红亚胺作为三元合成子与其它亲核受体发生[3+2]环加成反应。可以看出,三氟乙胺-靛红亚胺衍生物作为良好的1,3-偶极子,在构建含有三氟甲基立体中心的不对称反应中得到了研究者的广泛关注[14]。因此,设计并合成新型的三氟乙基酮亚胺衍生物,使其作为新的1,3-偶极子参与不对称反应具有重要的科研意义,这不仅可以丰富含三氟甲基立体中心的化合物库,而且为后续的生理活性研究提供了新的药效结构参考。
基于本课题组近年对含三氟甲基化合物的相关研究[15-17],本文以苯并噻吩二酮(1)和三氟乙胺(2)为原料,加入四氯化钛作为脱水剂,得到新型苯并噻吩酮衍生的三氟乙基酮亚胺衍生物(图2),其结构经1H NMR、13C NMR和HR-MS(ESI-TOF)表征。
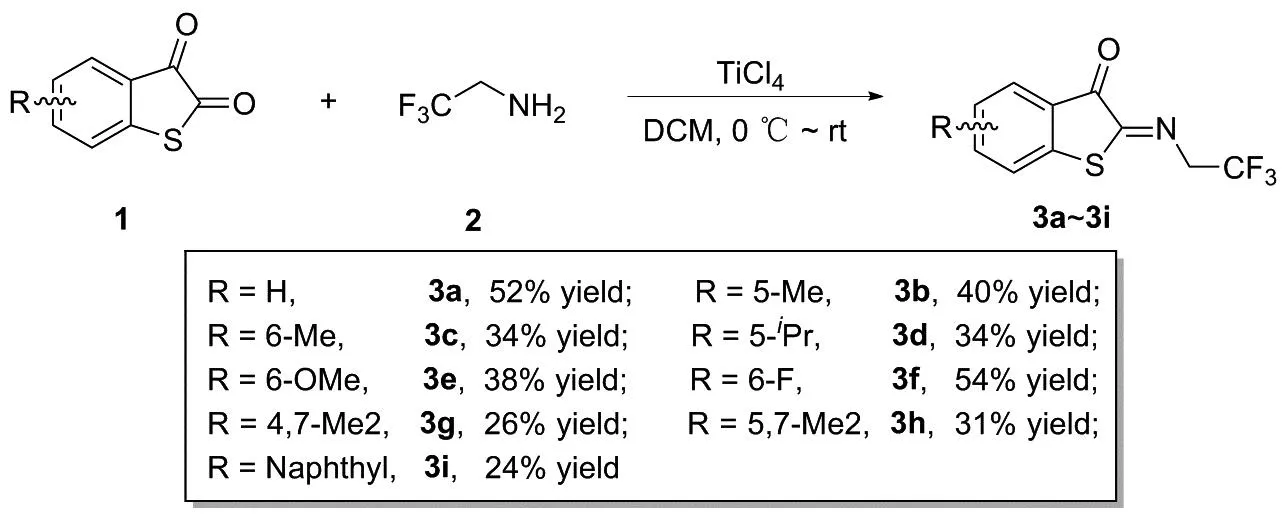
图2 苯并噻吩酮衍生的三氟乙基酮亚胺的合成路线Figure 2 Synthesis route of benzothiophenone-derived trifluoroethylketimines
1 实验部分
1.1 仪器与试剂
Büchi B-545型显微熔点仪;Bruker 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Daltonics型质谱仪。
所用醚类溶剂和甲苯均用金属钠和二苯甲酮搅拌浸泡处理后蒸出,氯代溶剂与乙腈经氢化钙干燥后重蒸;其它试剂均购于上海毕得、乐研、上海阿拉丁和麦克林等试剂公司;薄层层析硅胶(300~400目)购于青岛海洋化工厂;薄层层析硅胶板购于烟台江友硅胶开发有限公司。
1.2 苯并噻吩衍生酮亚胺的合成(3a~3i)
在反应瓶中加入苯并噻吩酮1(5.0 mmol)、三氟乙胺2(7.5 mmol)和无水二氯甲烷20 mL,氩气置换反应体系后,0 ℃下缓慢滴加无水四氯化钛(6 mmol)。滴毕后室温继续搅拌2 h,反应完后冰浴下缓慢滴加饱和碳酸钾(20 mL)淬灭反应,分离有机相,二氯甲烷(3×20 mL)萃取水相,合并有机相后加入饱和碳酸氢钠溶液(20 mL),分离有机相后加入无水硫酸镁干燥,蒸发浓缩后经硅胶柱层析(洗脱剂:石油醚 ∶乙酸乙酯=10 ∶1,V∶V)得到化合物3。
3a:黄色固体,收率为52%, m.p.119.1~119.8 ℃;1H NMR(400 MHz, CDCl3)δ: 7.91(dd,J=7.6 Hz, 2.0 Hz, 1H), 7.71~7.61(m, 1H), 7.44(d,J=7.9 Hz, 1H), 7.41~7.34(m, 1H), 4.16~4.02(m, 2H);13C NMR(101 MHz, CDCl3)δ: 187.1, 162.3, 141.8, 137.5, 128.0, 127.9, 127.4, 125.0, 123.9(q,J=278.1 Hz), 58.7(q,J=33.4 Hz);19F NMR(376 MHz, CDCl3)δ: -70.17; HR-MS(ESI-TOF)m/z: calcd for C10H6F3NOS{[M+H]+}246.0195, found 246.0198。
3b:黄色固体,收率为40%, m.p.121.5~121.7 ℃;1H NMR(400 MHz, CDCl3)δ: 7.65(d,J=3.6 Hz, 1H), 7.32(d,J=8.0 Hz, 1H), 7.20(dd,J=7.9 Hz, 2.4 Hz, 1H), 4.62(q,J=9.6 Hz, 2H), 2.38(s, 3H);13C NMR(101 MHz, CDCl3)δ: 187.2, 156.9, 137.3, 134.9, 134.0, 128.5, 126.0, 124.8(q,J=277.1 Hz), 123.7, 54.2(q,J=32.8 Hz), 21.0;19F NMR(376 MHz, CDCl3)δ: -72.32; HR-MS(ESI-TOF)m/z: calcd for C11H9F3NOS{[M+H]+}260.0351, found 260.0351。
3c:黄色固体,收率为34%, m.p. 122.1~122.7 ℃;1H NMR(400 MHz, CDCl3)δ: 7.80(dd,J=7.9 Hz, 2.0 Hz, 1H), 7.24(s, 1H), 7.16(d,J=7.9 Hz, 1H), 4.15~4.01(m, 2H), 2.46(s, 3H);13C NMR(101 MHz, CDCl3)δ: 183.6, 162.8, 149.6, 142.1, 128.4, 127.8, 125.9, 125.4, 123.9(q,J=278.2 Hz), 58.6(q,J=33.3 Hz), 22.4;19F NMR(376 MHz, CDCl3)δ: -70.18; HR-MS(ESI-TOF)m/z: calcd for C11H8F3NOS{[M+H]+}260.0351, found 260.0355。
3d:黄色油状液体,收率为34%;1H NMR(400 MHz, CDCl3)δ: 7.79(s, 1H), 7.54(d,J=8.0 Hz, 1H), 7.35(dd,J=8.1 Hz, 2.1 Hz,1H), 4.13~4.02(m, 2H), 3.01~2.91(m, 1H), 1.28(d,J=2.1 Hz, 3H), 1.26(d,J=2.1 Hz, 3H);13C NMR(101 MHz, CDCl3)δ: 184.4, 163.1, 148.8, 138.9, 136.4, 128.0, 125.7, 124.8, 123.9(q,J=278.0 Hz), 58.6(q,J=33.4 Hz), 33.7, 23.7;19F NMR(376 MHz, CDCl3)δ: -70.17; HR-MS(ESI-TOF)m/z: calcd for C13H12F3NOS{[M+H]+}288.0664, found 288.0668。
3e:黄色固体,收率为38%, m.p. 108.5~108.9 ℃;1H NMR(400 MHz, CDCl3)δ: 7.86(d,J=8.5 Hz, 1H), 6.88(d,J=2.2 Hz, 1H), 6.84(dd,J=8.6 Hz, 2.3 Hz, 1H), 4.07(q,J=9.0 Hz, 2H), 3.93(s, 3H);13C NMR(101 MHz, CDCl3)δ: 182.2, 167.1, 163.0, 144.7, 130.0, 123.9(q,J=278.1 Hz), 121.6, 113.9, 109.7, 58.6(q,J=33.3 Hz), 56.2;19F NMR(376 MHz, CDCl3)δ: -70.16; HR-MS(ESI-TOF)m/z: calcd for C11H8F3NO2S{[M+H]+}276.0301, found 276.0303。
3f:黄色固体,收率为54%, m.p. 111.5~111.9 ℃;1H NMR(400 MHz, CDCl3)δ: 7.95(dd,J=8.5 Hz, 5.4 Hz, 1H), 7.17(dd,J=7.9 Hz, 2.2 Hz, 1H), 7.12~7.02(m, 1H), 4.10(q,J=8.9 Hz, 2H);13C NMR(101 MHz, CDCl3)δ: 182.2, 168.0(d,J=263.9 Hz), 161.5, 144.7(d,J=11.2 Hz), 130.5,(d,J=10.9 Hz), 124.5(d,J=2.5 Hz), 123.7(q,J=278.2 Hz), 115.4(d,J=23.3 Hz), 112.6(d,J=26.2 Hz), 58.6(q,J=33.6 Hz);19F NMR(376 MHz, CDCl3)δ: -70.16, -95.47; HR-MS(ESI-TOF)m/z: calcd for C10H5F4NOS{[M+H]+}264.0101, found 264.0101。
3g:黄色固体,收率为26%, m.p.117.5~118.3 ℃;1H NMR(400 MHz, CDCl3)δ: 7.32(d,J=7.8 Hz, 1H), 7.04(d,J=7.7 Hz, 1H), 4.16~4.04(m, 2H), 2.64(s, 3H), 2.30(s, 3H);13C NMR(101 MHz, CDCl3)δ: 185.3, 162.6, 141.9, 140.6, 137.0, 131.0, 129.6, 125.4, 124.0(q,J=278.2 Hz), 58.5(q,J=33.1 Hz), 18.6, 18.5;19F NMR(376 MHz, CDCl3)δ: -70.22; HR-MS(ESI-TOF)m/z: calcd for C12H11F3NOS{[M+H]+}274.0508,found 274.0509。
3h:黄色固体,收率为31%, m.p.92.5~93.1 ℃;1H NMR(400 MHz, CDCl3)δ: 7.91~7.82(m, 1H), 7.12~6.98(m, 2H), 4.63(q,J=9.4 Hz, 2H);13C NMR(101 MHz, CDCl3)δ: 185.7, 165.9(d,J=258.5 Hz), 155.3(d,J=2.2 Hz), 139.7(d,J=10.2 Hz), 127.9(d,J=9.7 Hz), 125.0(d,J=3.3 Hz), 124.7(d,J=277.2 Hz), 114.8(d,J=23.0 Hz), 111.6(d,J=26.2 Hz), 54.2(q,J=33.0 Hz);19F NMR(376 MHz, CDCl3)δ: -72.32, -101.76; HR-MS(ESI-TOF)m/z: calcd for C10H6F4NOS{[M+H]+}264.0101, found 264.0101。
3i:黄色固体,收率为24%, m.p.179.3~179.7 ℃;1H NMR(400 MHz, CDCl3)δ: 9.15(d,J=8.5 Hz, 1H), 8.11(dd,J=8.6 Hz, 2.0 Hz, 1H), 7.86(d,J=8.2 Hz, 1H), 7.78~7.69(m, 1H), 7.61~7.53(m, 1H), 7.46(dd,J=8.5 Hz, 2.0 Hz, 1H), 4.23~4.10(m, 2H);13C NMR(101 MHz, CDCl3)δ: 184.2, 162.2, 146.2, 138.7, 132.4, 131.1, 130.8, 128.9, 127.3, 123.9(q,J=278.2 Hz), 123.3, 122.1, 121.5, 58.7(q,J=33.3 Hz);19F NMR(376 MHz, CDCl3)δ: -70.08; HR-MS(ESI-TOF)m/z: calcd for C14H8F3NOS{[M+H]+}296.0351, found 296.0350。
1.3 含三氟甲基的多环杂环化合物(5)的合成
以有机碱DABCO为催化剂,二氯甲烷(DCM)为溶剂,室温下搅拌反应24 h,能够以>20 ∶1dr和88%收率得到含三氟甲基的多环杂环化合物5;1H NMR(400 MHz, CDCl3)δ: 7.47(s, 1H), 7.41(d,J=8.1 Hz, 1H), 7.17(dd,J=8.0 Hz, 4.9 Hz, 2H), 6.92(d,J=7.7 Hz, 1H), 6.75(s, 1H), 4.77(d,J=6.5 Hz, 1H), 4.61(q,J=6.3 Hz, 1H), 3.07(d,J=5.4 Hz, 1H), 2.35(s, 3H), 2.35(s, 3H);13C NMR(101 MHz, CDCl3)δ: 198.9, 158.17, 145.7, 138.5, 136.5, 133.8, 131.0, 127.9, 127.5, 125.6, 124.9, 124.5(q,J=279.8 Hz), 124.0, 123.6, 111.4, 84.9, 64.0(q,J=31.5 Hz), 53.8, 21.7, 20.8。
2 结果与讨论
2.1 底物拓展分析
从底物的拓展情况可以看出(图2),当苯环上没有取代基时,反应能以52%收率得到3a;当苯环为各种给电子取代基(如甲基,异丙基和甲氧基)时,无论取代基的位置位于何处,反应都只能以中等的收率得到3b~3e。当苯环上是吸电子取代的氟时,反应能够以54%收率得到相应的产物3f。对于双取代的底物,该反应也能以中等的收率得到化合物3g和3h。而将共轭体系共轭更大的萘环取代苯环后,只能以24%收率得到相应产物3i,这可能是由于存在大位阻。
2.2 去芳构化环加成反应分析
为了展示新型苯并噻吩酮衍生的三氟乙基酮亚胺的应用,本文初步尝试了其和2-硝基苯并呋喃的去芳构化环加成反应,由图3可以看出,该反应构建了含三氟甲基的多环杂环化合物。
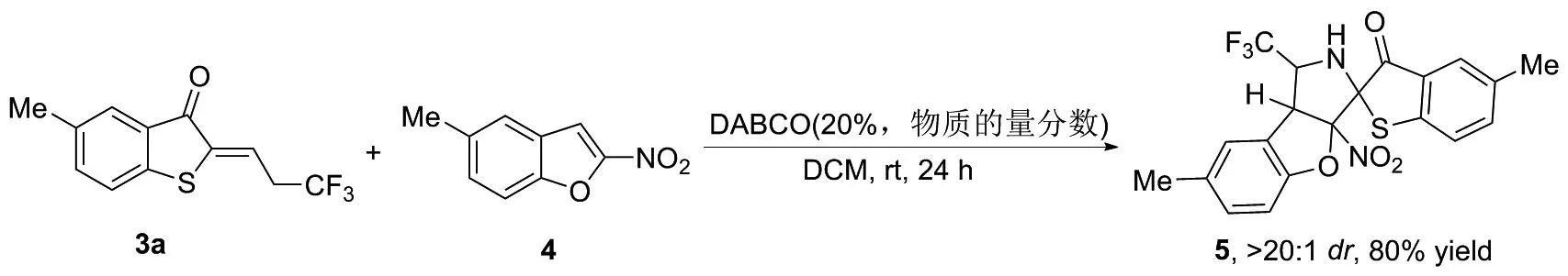
图3 苯并噻吩酮衍生的三氟乙基酮亚胺和2-硝基苯并呋喃的去芳构化[3+2]环加成反应Figure 3 Dearomatizative [3+2] cycloaddition reaction of 2-nitrobenzofuran and benzothiophenone-derived trifluoroethylketimine
本文以苯并噻吩酮和三氟乙胺为原料,四氯化钛为脱水剂,在较温和的条件下反应,以中等收率得到苯并噻吩酮衍生的三氟乙基酮亚胺(3a~3i)。取代基的电子效应与位阻效应对该反应影响不大,都能以中等收率得到相应产物,具有良好的普适性。同时尝试了该亚胺和2-硝基苯并呋喃的去芳构化环加成反应,构建了含三氟甲基的多环杂环化合物。该新型三氟乙基酮亚胺不仅丰富了含三氟甲基立体中心的化合物库,而且可为后续的生理活性研究提供新的结构参考。

