3,4-二氢吡喃[3,2-b]-吲哚-2-酮的合成
李江红, 唐美玲, 石克金, 邓力超, 简 迅, 陈 林
(成都大学 药学院(川抗所)抗生素研究与再评价四川省重点实验室,四川 成都 610106)
吲哚[1-7]骨架和吡喃酮结构[8-12]广泛存在于许多天然产物和药物分子中,其中多数化合物具有抗肿瘤、抗病毒、抗菌、抗炎和抗氧化等多重生理活性。因此,吲哚类生物碱凭借其特殊的结构以及优越的药理活性深受药学研究者的青睐,同时也促进了对含吲哚骨架衍生物的深入研究,如将吲哚和吡喃酮结构融合的研究颇多[13-20]。然而,有关二氢吡喃并[3,2-b]吲哚-2-酮的合成报道较少。
DU和LU课题组[21]以N-杂环卡宾(NHC)为催化剂,将α,β-不饱和醛(包括烯醛和炔醛)与吲哚-3-酮发生迈克尔加成反应,再内酯化,实现了(3+3)的串联环化反应,以中等到优秀的收率得到二氢吡喃并[3,2-b]吲哚-2-酮;ENDERS课题组[22]以吲哚-3-酮和2-溴肉桂醛类物质为原料,手性N-杂环卡宾为催化剂,成功构建二氢吡喃并[3,2-b]吲哚-2-酮,如图1(a)所示。然而可以看出,以上2种方法均为卡宾催化,且尚未见其他催化策略的报道,因此,须发展新的策略来构建二氢吡喃并[3,2-b]吲哚-2-酮结构。
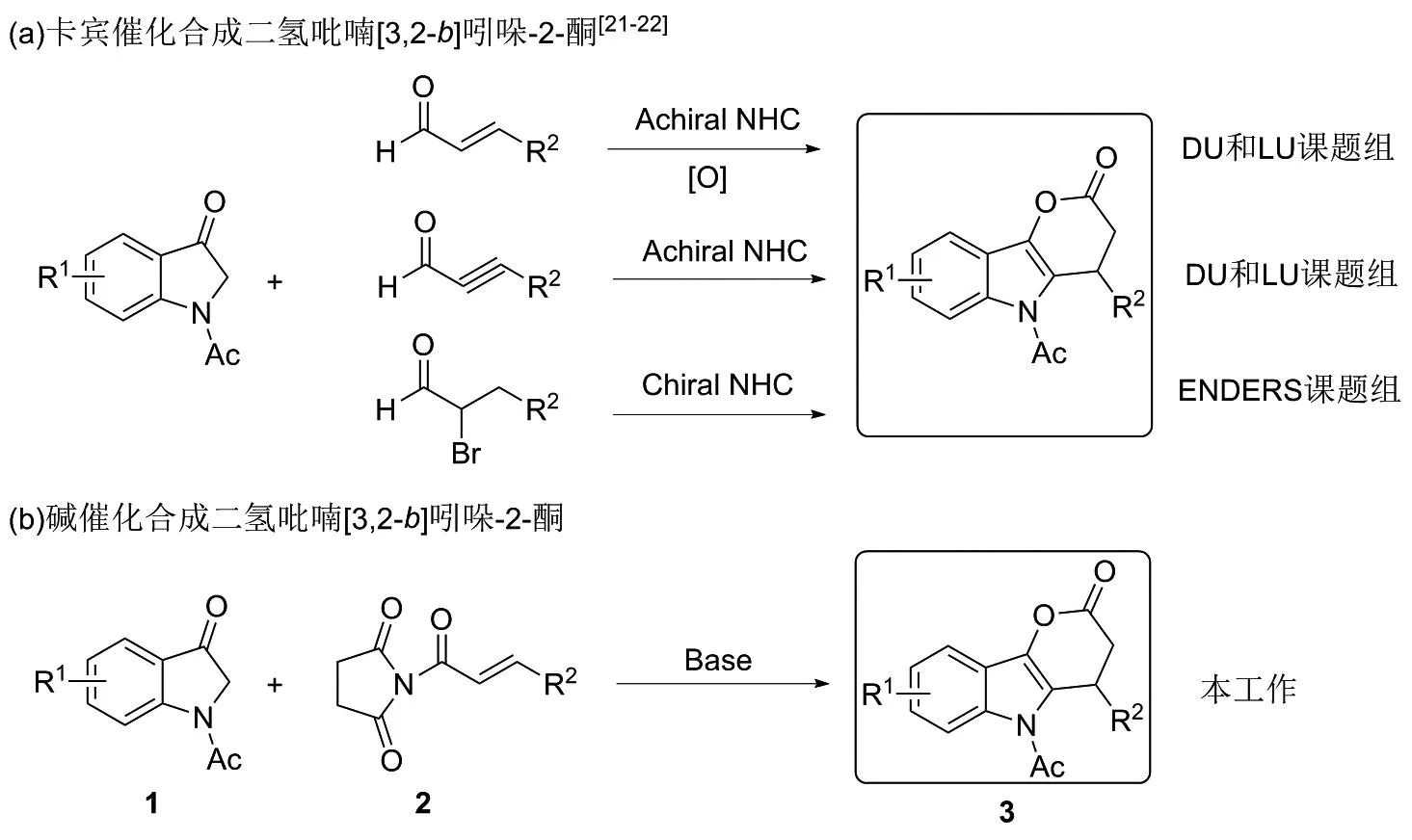
图1 二氢吡喃[3,2-b]吲哚-2-酮的合成路线Figure 1 Synthesis route of dihydropyrano[3,2-b]indol-2-ones
α,β-不饱和酰亚胺是常用的合成子,作为迈克尔受体,广泛地用于构建杂环骨架结构[23-27]。此外,卡宾非常活泼,反应溶剂需要进行无水处理。同时,反应过程中经常会要求无氧密封,操作很不方便,并且卡宾催化剂常常价格昂贵。因此,基于本课题已有的研究基础[23],本文拟用吲哚-3-酮[21-22, 28-31]与α,β-不饱和N-酰基琥珀酰亚胺[23-27, 32-33]在碱的催化下发生迈克尔加成反应介导(Michael-Initiated Ring-Closing, MIRC)的环化反应[34-37]来构建二氢吡喃并[3,2-b]吲哚-2-酮,如图1(b)所示。采用本文所用方法,可避免卡宾催化的缺点,且反应好控制,易操作,成本低。
1 实验部分
1.1 仪器与试剂
WRX-X-4A型熔点仪;JEOL-600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Waters SYNAPT G2型高分辨质谱仪。
吲哚-3-酮和N-酰基琥珀酰亚胺为自制,其余试剂均为市售分析纯。
1.2 3,4-二氢吡喃[3,2-b]吲哚-2-酮类化合物的合成(以3a为例)
向反应试管中依次加入1-乙酰基-6-氯-吲哚-3-酮(1a, 21.0 mg, 0.10 mmol),N-肉桂酰基琥珀酰亚胺(2a, 39.5 mg, 0.15 mmol),碳酸铯(6.6 mg, 0.02 mmol)和乙腈(1 mL)。反应试管于25 ℃磁力搅拌反应,TLC监测。反应结束,浓缩去除乙腈。经硅胶柱层析(洗脱剂:PE ∶EA=10 ∶1~2 ∶1,V∶V)得30.8 mg产物3a,收率91%。用类似的方法合成3b~3o。
3a:黄色固体,收率91%,m.p.170~171 ℃;1H NMR(600 MHz, CDCl3)δ: 8.06(s, 1H), 7.62(d,J=8.3 Hz, 1H), 7.37(d,J=8.3 Hz, 1H), 7.32(t,J=6.9 Hz, 2H), 7.28(d,J=7.6 Hz, 1H), 7.11(d,J=6.9 Hz, 2H), 5.02(d,J=7.6 Hz, 1H), 3.36(dd,J=15.6 Hz, 7.8 Hz, 1H), 3.05(d,J=15.8 Hz, 1H), 2.58(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.7, 165.8, 139.9, 138.1, 134.2, 132.2, 129.5, 128.0, 126.6, 124.6, 119.9, 119.1, 118.2, 116.0, 38.4, 38.3, 26.7; HR-MS(ESI)m/z: calculated for C19H14ClNO3{[M+H]+}340.0735, found 340.0737。
5-乙酰基-7-氯-4-(4-氟苯基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3b):黄色固体,收率83%, m.p.177~180 ℃;1H NMR(600 MHz, CDCl3)δ: 7.96(s, 1H), 7.63(d,J=8.3 Hz, 1H), 7.38(dd,J=8.6 Hz, 1.7 Hz, 1H), 7.09~7.11(m, 2H), 6.99~7.03(m, 2H), 5.06~5.07(m, 1H), 3.35(dd,J=15.6 Hz, 7.8 Hz,1H), 3.02(dd,J=16.2 Hz, 1.7 Hz, 1H), 2.63(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.7, 165.7, 162.2(J=243.0 Hz), 138.0, 135.8, 134.0, 132.2, 128.4(J=8.8 Hz), 124.6, 120.2, 119.2, 118.4, 116.3(J=21.7 Hz), 115.7, 38.3, 37.7, 26.8; HR-MS(ESI)m/z: calculated for C19H13ClFNO3{[M+H]+}358.0641, found 358.0633。
5-乙酰基-7-氯-4-(4-氯苯基)-4,5-二氢吡喃[3,2-b]吲哚-2(3H)-酮(3c):黄色固体,收率93%, m.p.215~218 ℃;1H NMR(600 MHz, CDCl3)δ: 7.93(s, 1H), 7.63(d,J=7.6 Hz, 1H), 7.37(d,J=7.6 Hz, 1H), 7.28(t,J=7.2 Hz, 2H), 7.06(d,J=7.6 Hz, 2H), 5.06(d,J=6.9 Hz, 1H), 3.35(dd,J=15.6 Hz, 7.8 Hz, 1H), 3.01(d,J=15.8 Hz, 1H), 2.63(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.7, 165.6, 138.7, 138.1, 134.0, 133.8, 132.2, 129.6, 128.1, 124.6, 119.9, 119.2, 118.5, 115.6, 38.1, 37.8, 26.9; HR-MS(ESI)m/z: calculated for C19H13Cl2NO3{[M+Na]+}396.0165, found 396.0780。
5-乙酰基-4-(4-溴苯基)-7-氯-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3d):黄色固体,收率88%, m.p.176~180 ℃;1H NMR(600 MHz, CDCl3)δ: 7.93(s, 1H), 7.63(d,J=8.3 Hz, 1H), 7.44(d,J=7.6 Hz, 2H), 7.38(d,J=8.3 Hz, 1H), 7.01(d,J=7.6 Hz, 2H), 5.05(d,J=7.6 Hz, 1H), 3.35(dd,J=15.6 Hz, 8.4 Hz, 1H), 3.01(d,J=15.8 Hz, 1H), 2.63(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.6, 165.6, 139.2, 138.1, 133.9, 132.5, 132.2, 128.4, 124.6, 121.9, 119.9, 119.2, 118.5, 115.6, 38.0, 37.9, 26.9; HR-MS(ESI)m/z: calculated for C19H13BrClNO3{[M+Na]+}439.9660, found 439.9655。
5-乙酰基-7-氯-4-(4-硝基-苯基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3e):黄色固体,收率83%, m.p.170~173 ℃;1H NMR(600 MHz, CDCl3)δ: 8.19~8.17(m, 2H), 7.79(d,J=1.4 Hz, 1H), 7.66(d,J=9.0 Hz, 1H), 7.40(dd,J=8.3 Hz, 1.4 Hz, 1H), 7.32~7.34(m, 2H), 5.26(d,J=6.9 Hz, 1H), 3.40(dd,J=15.6 Hz, 7.8 Hz , 1H), 3.03(dd,J=1.8 Hz, 16.2 Hz, 1H), 2.69(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.8, 165.3, 147.9, 147.5, 138.5, 133.8, 132.6, 127.9, 124.8, 124.7, 119.5, 119.3, 118.9, 115.3, 38.3, 37.6, 27.1; HR-MS(ESI)m/z: calculated for C19H13ClN2O5{[M+H]+}385.0586, found 385.0589。
5-乙酰基-7-氯-4-(对甲苯基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3f):黄色固体,收率86%, m.p.176~180 ℃;1H NMR(600 MHz, CDCl3)δ: 8.10(s, 1H), 7.61(d,J=8.3 Hz, 1H), 7.37(d,J=8.3 Hz, 1H), 7.12(d,J=7.6 Hz, 2H), 7.00(d,J=7.6 Hz, 2H), 4.96(d,J=7.6 Hz, 1H), 3.34(dd,J=16.2 Hz, 7.8 Hz, 1H), 3.03(d,J=15.8 Hz, 1H), 2.57(s, 3H), 2.31(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.8, 165.9, 138.1, 137.8, 136.8, 134.3, 132.1, 130.2, 126.5, 124.5, 120.0, 119.1, 118.1, 116.1, 38.5, 38.1, 26.7, 21.0; HR-MS(ESI)m/z: calculated for C20H16ClNO3{[M+H]+}354.0892, found 354.0887。
5-乙酰基-7-氯-4-(4-甲氧基苯基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3g):黄色固体,收率81%, m.p.168~171 ℃;1H NMR(600 MHz, CDCl3)δ: 8.10(s, 1H), 7.61(d,J=8.3 Hz, 1H), 7.36(dd,J=8.3 Hz, 2.1 Hz, 1H), 7.02~7.05(m, 2H), 6.84~6.86(m, 2H), 4.96(d,J=6.2 Hz, 1H), 3.77(s, 3H), 3.34(dd,J=16.2 Hz, 7.8 Hz, 1H), 3.03(dd,J=15.8 Hz, 2.1 Hz, 1H), 2.58(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.8, 165.9, 159.2, 138.0, 134.2, 132.1, 131.7, 127.8, 124.6, 120.2, 119.1, 118.1, 116.2, 114.8, 55.3, 38.6, 37.7, 26.6; HR-MS(ESI)m/z: calculated for C20H16ClNO4{[M+Na]+}392.0661, found 392.0652。
5-乙酰基-7-氯-4-(3-氯苯基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3h):黄色固体,收率90%, m.p.188~191 ℃;1H NMR(600 MHz, CDCl3)δ: 7.94(s, 1H), 7.64(d,J=8.3 Hz, 1H), 7.38(dd,J=8.3 Hz, 1.4 Hz, 1H), 7.25(t,J=2.4 Hz, 2H), 7.11(s, 1H), 6.99~7.01(m, 1H), 5.07(d,J=6.9 Hz, 1H), 3.35(dd,J=15.6 Hz, 7.8 Hz, 1H), 3.03(dd,J=16.2 Hz, 1.7 Hz, 1H), 2.64(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.6, 165.5, 142.2, 138.3, 135.2, 134.0, 132.3, 130.7, 128.2, 126.9, 124.9, 124.6, 119.5, 119.1, 118.5, 115.6, 38.1, 38.0, 26.9; HR-MS(ESI)m/z: calculated for C19H13Cl2NO3{[M+H]+}396.0165, found 396.0161。
5-乙酰基-7-氯-4-(3-甲氧基苯基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3i):黄色固体,收率82%, m.p.210~214 ℃;1H NMR(600 MHz, CDCl3)δ: 8.08(d,J=1.4 Hz, 1H), 7.61(d,J=9.0 Hz, 1H), 7.36(dd,J=2.1 Hz, 8.3 Hz, 1H), 7.24(t,J=7.9 Hz, 1H), 6.80(dd,J=8.3 Hz, 2.1 Hz, 1H), 6.69(d,J=8.3 Hz, 1H), 6.64(t,J=2.1 Hz, 1H), 4.97~4.98(m, 1H), 3.76(s, 3H), 3.35(dd,J=16.2 Hz, 7.8 Hz, 1H), 3.06(dd,J=15.8 Hz, 1.4 Hz, 1H), 2.59(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.8, 165.8, 160.3, 141.4, 138.2, 134.3, 132.2, 130.6, 124.6, 119.6, 119.1, 118.8, 118.2, 116.1, 112.9, 112.7, 55.2, 38.4, 38.3, 29.6, 26.7; HR-MS(ESI)m/z: calculated for C20H16ClNO4{[M+Na]+}392.0661, found 392.0655。
5-乙酰基-7-氯-4-(2-氯苯基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3j):黄色固体,收率77%, m.p.181~183 ℃;1H NMR(600 MHz, CDCl3)δ: 8.14(s, 1H), 7.61(d,J=8.3 Hz, 1H), 7.46~7.47(m, 1H), 7.37(dd,J=8.3 Hz, 1.4 Hz, 1H), 7.22~7.25(m, 2H), 7.13(td,J=7.6 Hz, 1.4 Hz, 1H), 6.80(dd,J=8.3 Hz, 1.4 Hz, 1H), 5.41~5.42(m, 1H), 3.30(dd,J=16.2 Hz, 8.4 Hz, 1H), 3.11(dd,J=15.8 Hz, 1.4 Hz, 1H), 2.50(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.6, 165.5, 139.2, 136.6, 134.4, 132.7, 132.5, 130.6, 129.5, 127.9, 127.3, 124.7, 118.9, 118.2, 116.3, 36.1, 35.2, 26.1; HR-MS(ESI)m/z: calculated for C19H13Cl2NO3{[M+Na]+}396.0165, found 396.0156。
5-乙酰基-7-氯-4-(2-甲氧基苯基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3k):黄色固体,收率74%, m.p.219~221 ℃;1H NMR(600 MHz, CDCl3)δ: 8.20(s, 1H), 7.60(d,J=8.3 Hz, 1H), 7.36(d,J=8.3 Hz, 1H), 6.92(d,J=8.3 Hz, 1H), 6.85(t,J=7.2 Hz, 2H), 5.24(d,J=7.6 Hz, 1H), 3.88(s, 3H), 3.25(dd,J=15.6 Hz, 7.8 Hz, 1H), 3.08(d,J=16.5 Hz, 1H), 2.49(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.9, 166.3, 156.2, 138.6, 134.5, 132.1, 129.4, 127.9, 127.3, 124.5, 121.1, 119.1, 118.7, 117.9, 116.5, 110.9, 55.2, 36.1, 33.1, 26.1; HR-MS(ESI)m/z: calculated for C20H16ClNO4{[M+H]+}370.0841, found 370.0837。
5-乙酰基-7-氯-4-(呋喃-2-基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3l):黄色固体,收率82%, m.p.170~174 ℃;1H NMR(600 MHz, CDCl3)δ: 7.97(s, 1H), 7.58(d,J=8.3 Hz, 1H), 7.34(d,J=9.0 Hz, 2H), 6.27(s, 1H), 6.10(s, 1H), 5.20(d,J=6.2 Hz, 1H), 3.23~3.27(m, 2H), 2.71(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.8, 165.8, 152.1, 142.8, 137.8, 133.9, 132.1, 124.5, 119.2, 118.4, 118.3, 115.7, 110.5, 106.8, 35.1, 32.2, 26.8; HR-MS(ESI)m/z: calculated for C17H12ClNO4{[M+Na]+}352.0348, found 352.0357。
5-乙酰基-7-氯-4-(噻吩-2-基)-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3m):黄色固体,收率78%, m.p.226~230 ℃;1H NMR(600 MHz, CDCl3)δ: 8.01(s, 1H), 7.60(d,J=8.3 Hz, 1H), 7.36(d,J=8.3 Hz, 1H), 7.20(d,J=4.8 Hz, 1H), 6.92(s, 1H), 6.81(s, 1H), 5.36(d,J=6.9 Hz, 1H), 3.36(dd,J=15.6 Hz, 7.2 Hz, 1H), 3.20(d,J=15.8 Hz, 1H), 2.69(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.8, 165.6, 143.1, 137.5, 134.0, 132.3, 127.4, 125.3, 124.7, 124.6, 120.3, 119.1, 118.5, 115.9, 38.6, 33.6, 26.7; HR-MS(ESI)m/z: calculated for C17H12ClNO3S{[M+Na]+}368.0119, found 368.0110。
5-乙酰基-4-苯基-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3n):黄色固体,收率89%, m.p.215~218 ℃;1H NMR(600 MHz, CDCl3)δ: 7.94(d,J=8.3 Hz, 1H), 7.72(d,J=6.9 Hz, 1H), 7.37~7.45(m, 2H), 7.30~7.33(m, 2H), 7.24~7.27(m, 1H), 7.14~7.15(m, 2H), 5.10~5.11(m, 1H), 3.37(dd,J=15.6 Hz, 7.2 Hz, 1H), 3.06(dd,J=16.2 Hz, 1.7 Hz, 1H), 2.64(s, 3H);13C NMR(151 MHz, CDCl3)δ: 169.0, 166.3, 140.4, 138.4, 133.8, 129.3, 127.8, 126.7, 126.0, 123.9, 120.8, 119.8, 117.6, 115.3, 38.4, 38.4, 26.9; HR-MS(ESI)m/z: calculated for C19H15NO3{[M+Na]+}328.0945, found 328.0940。
5-乙酰基-8-氯-4-苯基-4,5-二氢吡喃并[3,2-b]吲哚-2(3H)-酮(3o):黄色固体,收率92%, m.p.169~173 ℃;1H NMR(600 MHz, CDCl3)δ: 7.94(d,J=9.0 Hz, 1H), 7.68(d,J=2.1 Hz, 1H), 7.37(dd,J=9.0 Hz, 2.8 Hz, 1H), 7.32(t,J=7.2 Hz, 2H), 7.26~7.29(m, 1H), 7.12(d,J=6.9 Hz, 2H), 5.04(dd,J=1.4 Hz, 8.3 Hz, 1H), 3.36(dd,J=15.6 Hz, 7.8 Hz, 1H), 3.06(dd,J=15.8 Hz,1.4 Hz, 1H), 2.59(s, 3H);13C NMR(151 MHz, CDCl3)δ: 168.7, 165.7, 139.8, 137.6, 132.2, 129.8, 129.5, 128.0, 126.7, 126.2, 121.8, 120.9, 117.2, 116.7, 38.4, 38.3, 26.7; HR-MS(ESI)m/z: calculated for C19H14ClNO3{[M+H]+}340.0735, found 340.0745。
2 结果与讨论
2.1 条件优化分析
本文以化合物1a与化合物2a为底物,DBU(1,8-二氮杂二环[5.4.0]十一碳-7-烯)为催化剂,二氯甲烷为溶剂,于25 ℃条件下反应得到目标产物,收率35%(表1, Entry 1)。首先对反应溶剂进行了筛选,结果发现,乙腈作为反应溶剂时,产物收率为70%,相对较优,其余溶媒作为反应溶剂时,收率相对更低(表1, Entries 1~7)。其次,以乙腈为溶剂,于25 ℃条件下对碱进行筛选(表1, Entries 8~12)。结果表明,三乙胺几乎不能促进该反应进行,DABCO(1,4-二氮杂二环[2.2.2]辛烷)和碳酸钠的催化效果也较差,碳酸钾为碱时与碳酸铯为碱时的产物收率相近,但碳酸铯效果更优,收率为79%(表1, Entry 12)。然后,对反应温度进行了筛选。降低反应温度至10 ℃时,反应变慢,收率降低至70%(表1, Entry 13),升高反应温度至35 ℃时,收率为76%,几乎没有变化(表1, Entry 14)。接着,筛选反应物配比,结果表明,底物1a∶2a=1.0 ∶1.5(物质的量之比,下同)时可得到较优效果,收率为84%(表1, Entry 15),然而继续升高2a的配比,收率仍为84%,并无更优的结果(表1, Entry 16)。而当加入0.4 nm分子筛作为添加剂后,可能由于除去了溶剂中的水分,产物不易降解,故收率得以提高至91%(表1, Entry 17)。
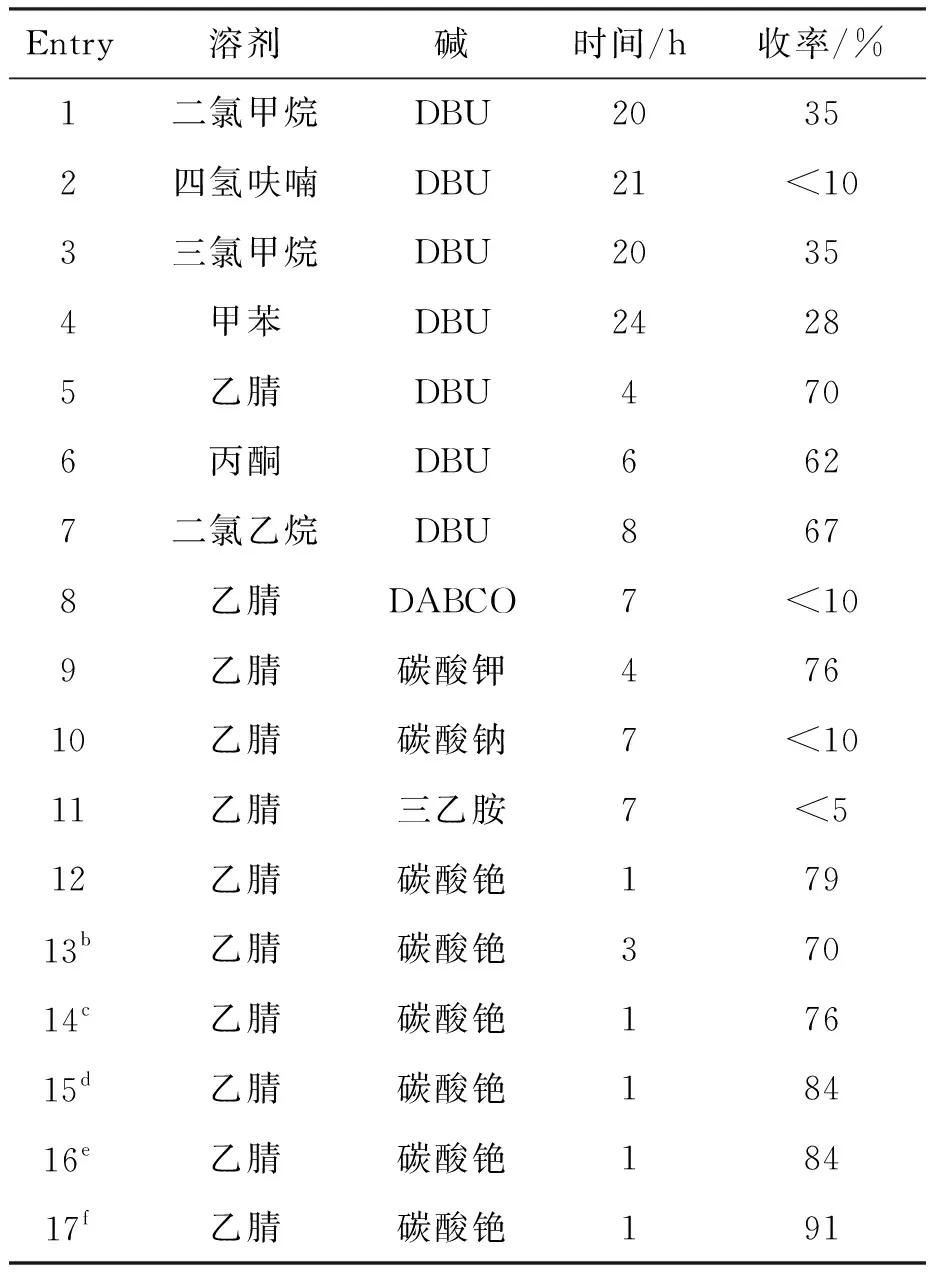
表1 3a合成反应条件的优化aTable 1 Optimization of the synthesis condition of 3a
a1a为0.10 mmol,2a为0.12 mmol,溶剂为1.0 mL,反应温度为25 ℃,收率为分离收率;b反应温度为10 ℃;c反应温度为35 ℃;d底物1a∶2a=1.0 ∶1.5;e底物1a∶2a=1.0 ∶2.0;f底物1a∶2a=1.0 ∶1.5,加入0.4 nm分子筛作为添加剂。
此外,本文还开展了不对称催化合成3a的研究,试验了奎尼丁方酰胺、奎宁和氢化奎宁对该反应的催化效果(表2)。结果发现,以奎尼丁方酰胺为催化剂,反应几乎不能发生(表2, Entries 1~4)。以奎宁和氢化奎宁为催化剂,收率也不理想(表2, Entries 5~12)。然而当以二氯甲烷为溶剂时,收率相对较高,对映选择性仍比较低(表2, Entries 6, 10)。

表2 3a不对称催化aTable 2 Asymmetric catalysis of 3a
综上,反应的最优条件为:乙腈为溶剂,碳酸铯为催化剂,底物1a与底物2a的比例为1.0 ∶1.5,反应温度为25 ℃;
2.2 底物扩展分析
为了验证方法的普适性,在最优反应条件下,本文对底物进行了拓展(图2)。首先,用不同取代基的N-肉桂酰基琥珀酰亚胺进行反应,结果表明,均能以良好到优秀的收率(74%~93%)分离得到目标化合物(3a~3k)。其中,当取代基处于邻位时,产物收率略有下降(3j77%,3k74%)。随后,以芳香杂环替换苯环进行反应,以良好的收率得到目标化合物(3l82%,3m78%)。最后,以苯环无取代基的吲哚-3-酮和5-氯代吲哚-3-酮进行反应,也能以优秀的收率得到相应目标产物(3n89%,3o92%)。此外,本文还进行了克级放大实验(1a, 0.839g),顺利得到产物(3a, 1.126 g, 83%),3a收率虽略有下降,但并不明显,进一步论证了该方法的实用性和高效性。
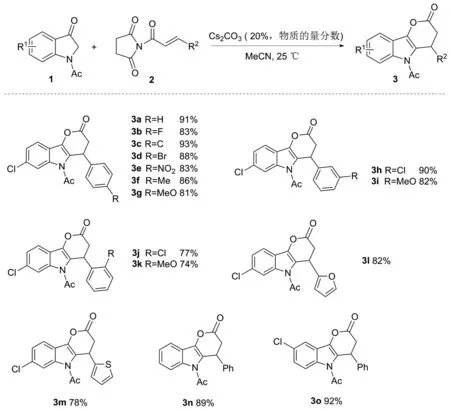
图2 底物的扩展Figure 2 Scope of substrates
2.3 反应可能的机理
反应的可能机理如图3所示。本反应为碱催化下发生的迈克尔加成反应介导的环化反应,其中,吲哚-3-酮(1a)为亲核试剂,作为迈克尔供体;N-酰基琥珀酰亚胺(2a)为双亲电试剂,作为迈克尔受体。参考文献[25-29]并结合实验结果,推测可能的反应机理如下:吲哚-3-酮在碱的作用下,失去质子,得到中间体Ⅰ;之后,Ⅰ作为亲核试剂进攻N-酰基琥珀酰亚胺,得到中间体Ⅱ; Ⅱ发生分子内的质子转移,得到中间体Ⅲ, Ⅲ再发生分子内的酯化反应,琥珀酰基离去,环化得到目标产物(3a)。
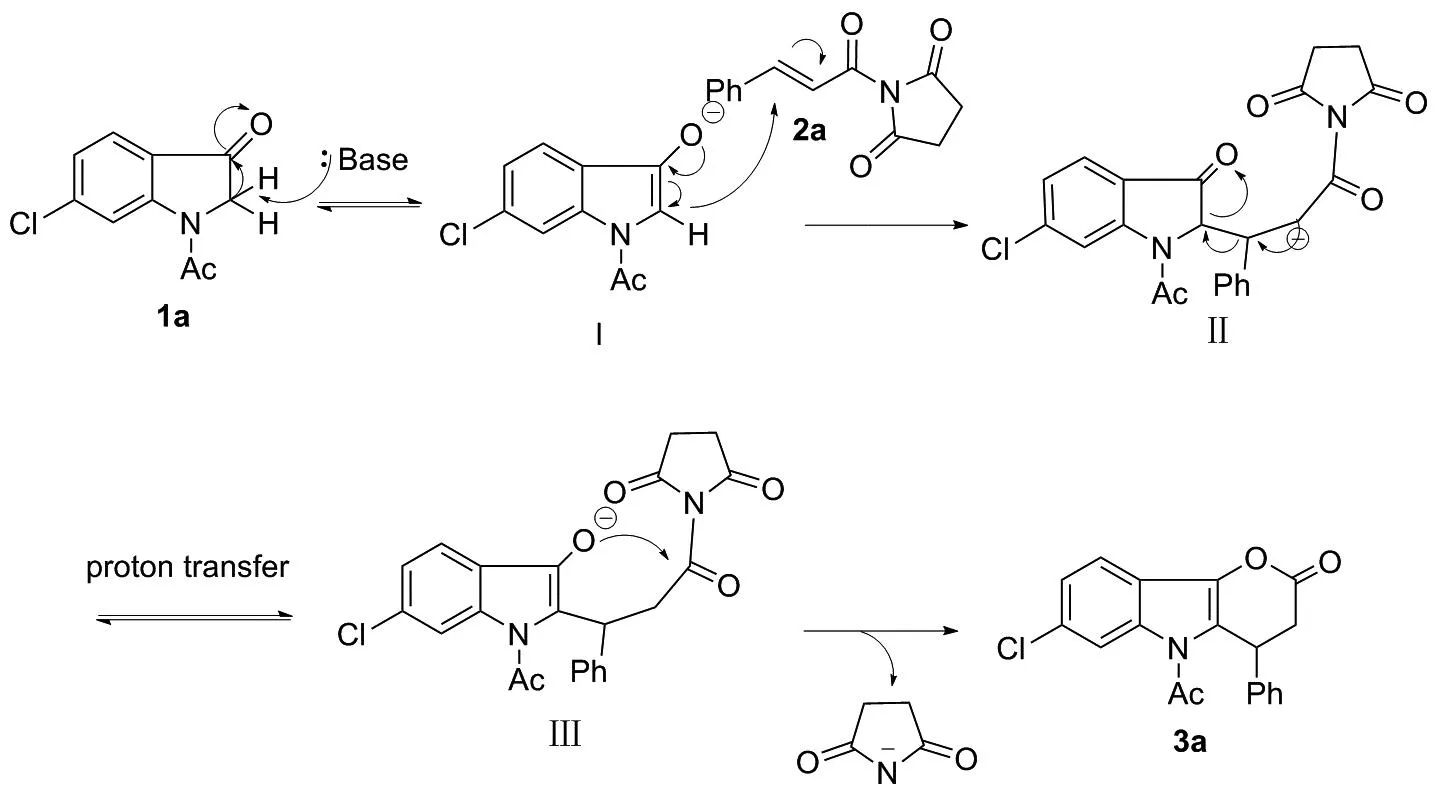
图3 可能的反应机理Figure 3 Possible reaction mechanism
本文成功建立了3,4-二氢吡喃[3,2-b]吲哚-2-酮类化合物新的合成路线,为该类物质的合成提供了新的选择。吲哚-3-酮在碳酸铯的催化作用下,以乙腈为反应溶剂,与α,β-不饱和N-酰基琥珀酰亚胺反应,实现了形式上的(3+3)环化反应,以良好到优秀的收率(74%~93%)得到了系列二氢吡喃[3,2-b]吲哚-2-酮类化合物。该方法简单,易操作且对环境友好。目标化合物普适性良好,各种取代的N-酰基琥珀酰亚胺和吲哚-3-酮均可耐受。此外,本文探究了不对称催化合成方法,分别以单功能叔胺和双功能叔胺方酰胺为催化剂进行了研究,并部分实现了产物的对映选择性(er58 ∶42)。

