碳酸钠介导的芳亚甲基丙二腈和α-氟代酮的环丙烷化反应合成多取代环丙烷
蔡 颖, 廖富民, 徐荣福, 刘晋彪
(江西理工大学 材料冶金化学学部 江西省功能分子材料化学重点实验室,江西 赣州 341000)
环丙烷由于其高张力环系和独特的化合键而受到人们越来越多的关注。环丙烷不仅广泛存在于萜烯、信息素和脂肪酸代谢产物等天然产物中[1-3],而且引入环丙烷环结构也是药物发展领域中的一种重要策略[4]。另外,含多种官能团的环丙烷化合物,如2-芳甲酰基-3-芳基环丙烷-1,1-二腈还可以作为一类重要的有机合成子,发生开环反应用于合成多取代环戊烯、呋喃、吡啶、噻吩以及二氢异噁唑等结构新颖的化合物[5-9]。
为了进一步拓展环丙烷在不同领域的广泛应用,越来越多的环丙烷及其衍生物的合成方法被报道[2-3,7,10-17]。在已报道的多取代环丙烷化合物的合成方法中,α-溴代苯乙酮与贫电子烯烃的环丙烷化反应是合成多取代环丙烷化合物的重要方法之一。在这类反应中,往往涉及吡啶(或胂)叶立德前体和缺电子烯烃的环丙烷化反应较多。
该类反应经历加成-消除反应过程,具有高反应活性和高选择性,常需要使用吡啶或芳基砷试剂作为反应的促进剂,因此受到广泛关注[12-17]。考虑到多取代环丙烷的重要性和使用叶立德前体的原子利用率偏低的情况,开发非金属催化和非叶立德参与的多取代环丙烷构建方法具有重要意义。
众所周知,α-卤代羰基化合物是合成多种杂环化合物和α-官能化酮的前体[18]。但是,目前使用较多的α-溴代芳基乙酮在制备过程中存在后处理较难等不足,且具有高毒性、腐蚀性和催泪性。基于此,本文利用非氮族碱碳酸钠来高效促进芳亚甲基丙二腈与α-氟代酮的环丙烷化反应,高立体选择性合成了一系列顺式多取代环丙烷化合物(图1),其结构经1H NMR,13C NMR和MS确证。

图1 芳亚甲基丙二腈与α-氟代酮的环丙烷化反应Figure 1 Cyclopropanation of arylidenemalonitriles and α-fluoroketones
1 实验部分
1.1 仪器与试剂
Bruker-400/500 MHz型超导核磁共振波谱仪(CDCl3为氘代试剂,TMS为内标);Thermo Scientific Q Exactive型四极杆Orbitrap质谱仪。
试剂或溶剂皆为市售分析纯或化学纯。
1.2 化合物3的合成
在5.0 mL圆柱型棕色螺纹口瓶中加入芳亚甲基丙二腈(1)(0.30 mmol)、α-氟代酮(2)(0.45 mmol)和碳酸钠(0.90 mmol),然后加入3.0 mL无水1,4-二氧六环作为溶剂。在80 ℃下搅拌反应,TLC检测至化合物1完全消失(24~48 h)。然后在减压下除去溶剂,残留物经(洗脱剂:石油醚 ∶乙酸乙酯=7 ∶1,V∶V, 2×120.0 mL)洗脱后,直接进行柱层析,得到顺式产物化合物3。
顺-2-苯甲酰基-3-苯基环丙烷-1,1-二腈(3a)[13]:产率80%,黄色固体(m.p.130~132 ℃);1H NMR(400 MHz, CDCl3)δ: 8.11(d,J=8.0 Hz, 2H), 7.75~7.71(m, 1H), 7.62~7.58(m, 2H), 7.49~7.44(m, 3H), 7.42~7.38(m, 2H), 4.08(d,J=8.0 Hz, 1H), 3.91(d,J=8.0 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 188.87, 135.33, 135.01, 129.74, 129.41, 129.25, 129.24, 128.70, 128.29, 112.15, 111.57, 38.64, 35.44, 15.21。
顺-2-苯甲酰基-3-(对甲苯基)环丙烷-1,1-二腈(3b)[13]:产率83%,黄色固体(m.p.156~158 ℃);1H NMR(500 MHz, CDCl3)δ: 8.11(d,J=5.0 Hz, 2H), 7.74~7.72(m, 1H), 7.61(d,J=5.0 Hz, 2H), 7.26(s, 4H), 4.02(d,J=10.0 Hz, 1H), 3.87(d,J=10.0 Hz, 1H), 2.38(s, 3H);13C NMR(125 MHz, CDCl3)δ: 188.92, 139.95, 135.40, 135.02, 129.98, 129.29, 128.71, 128.14, 126.32, 112.27, 116.62, 38.62, 35.55, 21.23, 15.26。
顺-2-苯甲酰基-3-(2-甲氧基苯基)环丙烷-1,1-二腈(3c):产率69%,黄色固体(m.p.141~143 ℃);1H NMR(500 MHz, CDCl3)δ: 8.12(d,J=10.0 Hz, 2H), 7.72(d,J=5.0 Hz, 1H), 7.61(d,J=10.0 Hz, 2H), 7.43~7.40(m, 1H), 7.16(d,J=10.0 Hz, 1H), 7.00(d,J=5.0 Hz, 2H), 3.99(d,J=10.0 Hz, 1H), 3.95(s, 3H), 3.87(d,J=5.0 Hz, 1H);13C NMR(125 MHz, CDCl3)δ: 189.26, 135.56, 134.90, 131.15, 129.26, 128.68, 128.50, 120.67, 118.51, 112.65, 111.95, 111.00, 55.75, 35.94, 35.08, 14.68; HR-MS(ESI)m/z: calcd for C19H15N2O2{[M+H]+}303.1127, found 303.1128。
顺-2-苯甲酰基-3-(2-溴苯基)环丙烷-1,1-二腈(3d):产率66%,黄色固体(m.p.176~178 ℃);1H NMR(400 MHz, CDCl3)δ: 8.15(d,J=8.0 Hz, 2H), 7.79~7.74(m, 2H), 7.66~7.62(m, 2H), 7.44~7.40(m, 1H), 7.37~7.34(m, 1H), 7.29(d,J=8.0 Hz, 1H), 4.09(d,J=8.0 Hz, 1H), 3.94(d,J=8.0 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 188.47, 135.23, 135.14, 133.54, 131.24, 130.24, 129.51, 129.33, 128.76, 127.93, 126.31, 112.02, 111.31, 39.29, 36.48, 15.35; HR-MS(ESI)m/z: calcd for C18H1279BrN2O{[M+H]+}351.0124, found 351.0128。
顺-2-苯甲酰基-3-(2-萘基)环丙烷-1,1-二腈(3e):产率63%,黄色固体(m.p.191~193 ℃;1H NMR(400 MHz, CDCl3)δ: 8.16(d,J=8.0 Hz, 2H), 7.94(d,J=8.0 Hz, 1H), 7.88(d,J=8.0 Hz, 2H) , 7.84(s, 1H), 7.77~7.73(m, 1H), 7.64~7.60(m, 2H), 7.57~7.55(m, 2H) , 7.47(d,J=8.0 Hz, 1H), 4.20(d,J=8.0 Hz, 1H), 4.08(d,J=8.0 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 188.82, 135.36, 135.10, 133.56, 132.98, 129.41, 129.33, 128.77, 127.96, 127.94, 127.87, 127.28, 127.10, 126.75, 125.14, 112.23, 111.58, 38.85, 35.66, 15.31; HR-MS(ESI)m/z: calcd for C22H15N2O{[M+H]+}323.1183, found 323.1179。
顺-2-(3-甲氧基苯甲酰基)-3-(对甲苯基)环丙烷-1,1-二腈(3f):产率65%,黄色固体(m.p.186~188 ℃);1H NMR(400 MHz, CDCl3)δ: 7.71(d,J=8.0 Hz, 1H), 7.61(s, 1H), 7.55~7.51(m, 1H), 7.28~7.26(m, 5H), 4.04(d,J=8.0 Hz, 1H), 3.88(d,J=8.0 Hz, 3H), 3.91(s, 1H), 2.4(s, 3H);13C NMR(100 MHz, CDCl3)δ: 188.80, 160.25, 139.91, 136.67, 130.21, 129.95, 128.13, 126.32, 121.67, 121.25, 112.70, 112.25, 111.65, 55.58, 38.72, 35.62, 21.22, 15.30; HR-MS(ESI)m/z: calcd for C20H17N2O2{[M+H]+}317.1288, found 317.1285。
顺-2-(4-氯苯甲酰基)-3-(对甲苯基)环丙烷-1,1-二腈(3g):产率62%,黄色固体(m.p.174~176 ℃);1H NMR(400 MHz, CDCl3)δ: 8.07(d,J=8.0 Hz, 2H), 7.60(d,J=8.0 Hz, 2H), 7.28(s, 4H), 3.99(d,J=8.0 Hz, 1H), 3.89(d,J=8.0 Hz, 1H), 2.41(s, 3H);13C NMR(100 MHz, CDCl3)δ: 187.85, 141.86, 140.06, 133.68, 130.05, 130.02, 129.70, 128.11, 126.13, 112.13, 111.48, 38.67, 35.46, 21.24, 15.37; HR-MS(ESI)m/z: calcd for C19H1435ClN2O{[M+H]+}321.0788, found 321.0789。
顺-2-(4-甲基苯甲酰基)-3-(对甲苯基)环丙烷-1,1-二腈(3h):产率78%,黄色固体(m.p.189~191 ℃);1H NMR(400 MHz, CDCl3)δ: 8.03(d,J=8.0 Hz, 2H), 7.41(d,J=8.0 Hz, 2H), 7.28(s, 4H), 4.01(d,J=8.0 Hz, 1H), 3.88(d,J=8.0 Hz, 1H), 2.51(s, 3H), 2.41(s, 3H);13C NMR(100 MHz, CDCl3)δ: 188.33, 146.37, 139.84, 132.95, 129.95, 129.93, 128.84, 128.14, 126.43, 112.37, 111.72, 38.53, 35.50, 21.86, 21.22, 15.13; HR-MS(ESI)m/z: calcd for C20H17N2O{[M+H]+}301.1316, found 301.1355。
2 结果与讨论
2.1 反应条件的优化
以芳亚甲基丙二腈(1a)和α-氟代苯乙酮(2a)的反应作为模板反应,对原料物质的量之比、碱的类型及当量、反应温度和溶剂进行了筛选,结果如表1所示。由表1可知,当使用1,4-二氧六环为溶剂,3 eq.碳酸钠为碱,在70 ℃条件下,化合物1a和化合物2a的物质的量之比为1.5 ∶1.0时,环丙烷化反应能顺利进行,且以61%的产率得到化合物3a(Entry 1)。反应温度从70 ℃升高到80 ℃时,化合物3a的产率提高至73%(Entry 2),继续升高反应温度至100 ℃时,化合物3a的产率下降至24%(Entry 3)。考虑到反应物的物质的量之比可能影响反应产率,于是本文将化合物1a和化合物2a的物质的量之比调整为1.0 ∶1.5,结果发现化合物3a的产率可以进一步提高至80%(Entry 4)。进一步调整化合物1a和化合物2a的物质的量之比为1.0 ∶1.2和1.0 ∶2.0,目标化合物3a的产率均有所下降。此外,使用3.0 eq.的碱在反应中至关重要,因为降低碱的用量以及升高碱的用量均对产率有明显的影响(Entries 4~7)。接着,本文还筛选了其它碱,如碳酸氢钠、三乙胺、吡啶和4-二甲基氨基吡啶,但效果不佳(Entries 8~11)。当使用文献中常用的α-溴代苯乙酮代替化合物2a时,化合物3a的最终产率仅为56%(Entry 12)。另外,本文也考察了乙腈、四氢呋喃、甲苯、苯、N,N-二甲基甲酰胺以及二甲亚砜等常用溶剂,除在甲苯中能以70%产率得到化合物3a外(Entry 13),其余溶剂中几乎得不到化合物3a。
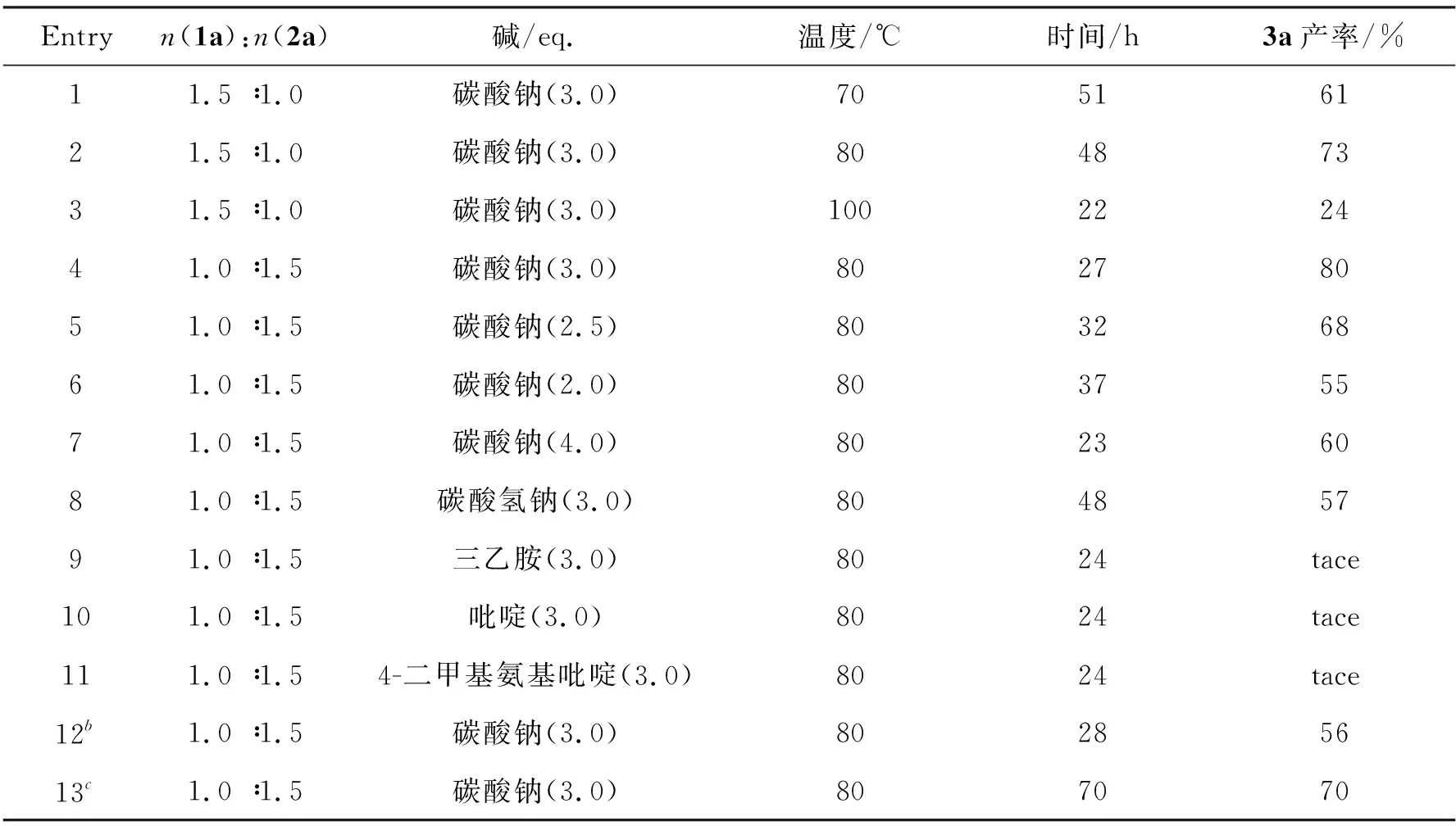
表1 苯亚甲基丙二腈(1a)和α-氟代苯乙酮(2a)的环丙烷化反应条件优化aTable 1 Optimization of reaction conditions for cyclopropanation with benzylidenemalononitrile (1a) and α-fluoroacetophenone (2a)a
2.2 底物拓展分析
在最佳反应条件下,本文进行了碳酸钠促进不同芳亚甲基丙二腈和α-氟代酮的环丙烷化反应的底物范围拓展,合成了之前文献未报道的环丙烷化合物(图1)。芳环上不同取代的芳亚甲基丙二腈化合物1b~1e能顺利发生环丙烷化反应,得到相应的顺式环丙烷衍生物化合物3b~3e,产率为63%~83%,苯环邻位和间位取代的底物反应产率稍低。此外,不同取代的α-氟代酮化合物2b~2d也适用,能以62%~78%产率得到化合物3f~3h。
2.3 可能的反应机理
通过比较位于环丙烷环中相邻碳原子处的2个质子的耦合常数,确定了化合物3a~3h的构型。具有顺式构型的环丙烷相邻碳上质子具有较大的耦合常数(7~10 Hz),而具有反式构型的环丙烷相邻碳上质子具有较小的耦合系数(3~7 Hz)[12]。通过仔细分析产物的1H NMR光谱数据,并与之前结果相比较,发现该环丙烷化反应具有良好的立体选择性,得到的顺式化合物3为唯一产物。
根据上述反应结果,本文提出了反应的可能机理,如图2所示。底物2在以碳酸钠为碱的条件下,发生攫氢产生碳负离子中间体I,随后该中间体I与底物1发生Michael加成反应得到新的碳负离子中间体II,最后中间体II发生亲核取代,C—F键断裂实现分子内的环丙烷化,得到目标产物3。

图2 可能的反应机理Figure 2 Possible reaction mechanism
本文首次报道了非氮族碱碳酸钠促进的芳亚甲基丙二腈和α-氟代酮的C—F键断裂环丙烷化反应。利用文献中制备的芳亚甲基丙二腈和α-氟代酮为原料,在以碳酸钠作为碱,1,4-二氧六环为溶剂,80 ℃条件下,该反应能以62%~83%的产率合成顺式多取代环丙烷化合物。该方法合成的多取代环丙烷化合物具有反应条件温和,操作简单,产率好以及立体选择性高等优点,是对现有合成环丙烷化合物方法的补充。

