肠道菌群水平与早产极低出生体重新生儿坏死性小肠结肠炎预后的相关性
贾益,应海燕,李少芳
(汉中三二〇一医院新生儿科,陕西 汉中 723000)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是一种好发于早产儿的胃肠道危重症,在活产儿中,NEC发病率仅为1‰~3‰,但早产儿NEC发病率增至6%~10%,且低出生体重、胎龄过小、呼吸机辅助通气时间过长均可导致NEC发生风险上升[1]。数据[2]显示,极低出生体重儿NEC发病率高达3%~14%,同时,合并NEC的早产儿死亡率高达46.5%~48.0%。随着产科和新生儿管理技术的提高,早产极低出生体重儿的存活率升至93.6%,但新生儿NEC发病率仍居高不下,且短肠综合征、肠梗阻等并发症不仅导致患儿长期依赖肠外营养,也使其神经系统发育受阻、生长发育面临严重威胁[3]。有学者[4]认为,肠道菌群定植直接影响着NEC的发生发展,早产儿、极低出生体重儿肠道菌群定植延迟、肠道微生态失调均与NEC有关。本研究拟进一步明确肠道菌群水平与早产极低出生体重新生儿合并NEC患儿预后的关联。
1 资料与方法
1.1 一般资料
选取2020年1月至2022年12月汉中三二〇一医院收治的105例早产极低出生体重合并NEC患儿为研究对象并设为NEC组。纳入标准:(1)胎龄<35周;(2)符合极低出生体重儿标准[5]:出生体重<1 500 g;(3)出生后24 h内入住新生儿重症监护病房(NICU);(4)明确NEC诊断[6]:存在体温不稳、呼吸暂停、心动过缓、嗜睡等全身表现,伴胃潴留、腹胀、呕吐、粪便潜血等胃肠道表现,影像学检查示肠扩张、肠梗阻、肠壁积气。排除标准:(1)合并先天性消化道畸形;(2)合并腹泻或染色体异常;(3)合并非NEC相关性肠穿孔;(4)入院后12 h内死亡或1周内自动出院;(5)接受口服益生菌干预。选取同期30例早产极低出生体重新生儿纳入对照组,筛选标准与NEC组(1)~(3)一致,排除标准与NEC组(1)~(5)一致且排除合并NEC或继发NEC患儿。两组新生儿一般资料比较,差异无统计学意义(P>0.05)。见表1。

表1 NEC组与对照组新生儿临床资料比较
1.2 治疗方法
NEC组、对照组新生儿均接受常规治疗及新生儿管理、喂养。根据NEC组患儿并发症发生情况给予对应治疗策略[7]:保守治疗包括肠道休息、禁食等,腹胀、发热、便血活动期禁食水;待患儿呕吐症状消失、便血好转、腹胀消除后给予低渗透压流质饮食,并逐渐增加摄入量。禁食期间持续给予高营养液静脉输注,包括10%葡萄糖、复方氨基酸、水解蛋白等。若患儿出现严重腹胀,给予M胆碱受体阻断药;病情严重者酌情给予糖皮质激素、抗生素干预,以抑制炎症反应、免疫反应、预防或治疗感染。若患儿合并门静脉积气、穿孔、腹膜刺激症等严重并发症且保守治疗未见好转,则及时予以手术治疗,手术方案包括坏死部分肠管切除联合肠吻合、造瘘,或肠外置管后切除坏死肠管联合肠造瘘等,患儿手术均由同组医师完成。NEC组105例患儿中,71例接受保守治疗,34例在保守治疗的基础上接受手术治疗。
1.3 观察指标
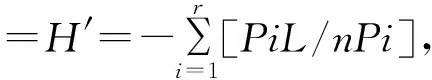
此外,按照NEC组患儿预后,将其分别纳入存活组、死亡组,计算患儿死亡率并比较存活组、死亡组治疗前炎性因子及肠道菌群水平差别,探究不同预后患儿肠道菌群水平差异特点。
1.4 统计学分析

2 结果
2.1 NEC组与对照组新生儿实验室指标比较
NEC组大便潜血阳性、HCO3-<21 mmol/L、血培养阳性、C-反应蛋白>10 mg/L、血小板计数>100×109/L、白细胞计数<5×109/L、白细胞计数>20×109/L比例均高于对照组,差异有统计学意义(P<0.05)。见表2。
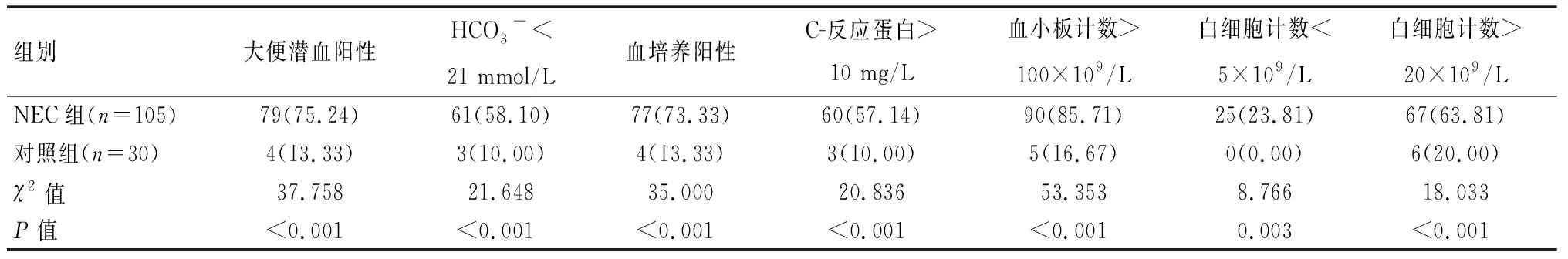
表2 NEC组与对照组新生儿实验室指标比较[n(%)]
2.2 NEC组与对照组炎性因子比较
NEC组IL-1β、IL-6、IL-10、TNF-α均高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 NEC组与对照组新生儿炎性因子指标比较
2.3 NEC组与对照组肠道菌群水平比较
NEC组厚壁菌门、梭菌纲丰度及Shannon指数均高于对照组;变形菌门丰度、γ-变形菌纲丰度低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 NEC组与对照组新生儿肠道菌群水平比较
2.4 预后情况比较
NEC组105例患儿中,存活74例,死亡31例,死亡率29.52%。存活组大便潜血阳性、HCO3-<21 mmol/L、血培养阳性、C-反应蛋白>10 mg/L、白细胞计数<5×109/L、白细胞计数>20×109/L比例均低于死亡组,其IL-1β、IL-6、IL-10、TNF-α均低于死亡组,且厚壁菌门、梭菌纲丰度及Shannon指数均低于死亡组;存活组变形菌门丰度、γ-变形菌纲丰度高于死亡组,差异有统计学意义(P<0.05)。见表5-表7。
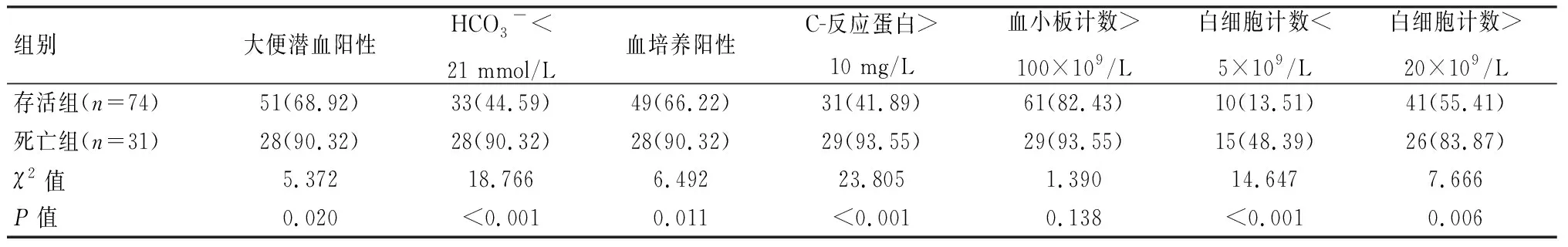
表5 存活组与死亡组新生儿实验室指标比较[n(%)]
表6 存活组与死亡组新生儿炎性因子指标比较

表7 存活组与死亡组新生儿肠道菌群水平比较
3 讨论
近年来,越来越多的研究[9]显示,早产极低出生体重新生儿细菌定植模式改变,与肠道微生态失衡及NEC的发生密切相关。
既往研究[10]显示,低体重、喂养不当、早产等因素均可导致肠道外源性病原体局部富集能力增强,此时B毒素Welchiii杆菌残气荚膜杆菌以及产毒性自身菌群平衡严重失调,与小肠壁缺血坏死有关。随着缺血坏死肠段的增多,病变逐渐累及结肠、回肠、空肠等解剖结构,进而引发广泛性病变,是导致常规解痉、抗炎、免疫抑制等保守治疗效果受限的主要原因[11]。虽然本研究34例患儿接受手术治疗,但105例NEC患儿的死亡率仍高达29.52%,与过往报道[12]数据接近,表明,合并NEC的早产极低出生体重新生儿死亡率较高,且即便行手术治疗亦难以提升患儿生存质量。因此,进一步明确NEC的发病机制及影响患儿预后的相关因素尤为重要。
本研究就NEC患儿与未合并NEC的早产极低出生体重新生儿实验室指标、炎性因子指标进行了对比,发现NEC患儿普遍存在实验室指标异常,并以白细胞、血小板数量改变为主,同时,患儿往往合并显著机体炎症反应。有学者[13]认为,IL-6、TNF-α等炎性因子不仅参与了NEC的发生发展,也与患儿预后密切相关:例如,IL-1β、TNF-α直接参与T淋巴细胞的诱导分化,与肠道黏膜损伤及保护性因子修复抑制有关。
除实验室指标、炎性因子外,NEC患儿亦存在明显肠道菌群水平变化,并以厚壁菌门、梭菌纲丰度上升,及变形菌门、γ-变形菌纲丰度下降为主要变化,同时伴随着Shannon的上升。这一变化一方面意味着NEC患儿肠道菌群定植模式存在明显异常,另一方面,肠道菌群失调也直接导致一氧化氮、超氧自由基生成增多,进而造成肠黏膜损伤加剧[14]。肠黏膜损伤导致硝酸盐生成减少、专性厌氧菌利用物质不足,进一步加剧炎性反应进展[15]。本研究结果示,死亡组患儿肠道菌群水平变化更为明显,印证了上述结论。
综上,合并NEC的早产极低出生体重儿普遍存在肠道功能、血常规相关指标异常及炎症反应、肠道菌群失调,且上述变化越显著,患儿预后越差。

