高位池和工厂化养殖模式下斑节对虾肝胰腺和肠道微生物特征分析







摘 要:为阐述在不同养殖模式下斑节对虾(非洲群体)(Penaeus monodon)肝胰腺和肠道微生物的特征,基于高通量测序、Biolog ECO技术探讨了高位池和工厂化养殖模式下斑节对虾肝胰腺、肠道菌群结构特征及肠道微生物代谢活性。高通量测序结果显示,高位池养殖模式下对虾肠道菌群多样性及丰富度显著高于工厂化养殖模式,且同类样本距离较近,体现了不同模式对虾样品中物种的异质性和多样性。不同样品中的细菌门类及相对丰度结果显示,对虾肠道菌群的优势菌门包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)等,其中比例最高的是变形菌门;在属水平上,工厂化养殖模式中相对丰度最高的是发光杆菌属(Photobacterium),高位池养殖模式中相对丰度最高的是红杆菌属(Rhodobacterium)和弧菌属(Vibrio)。基于Unifrac距离的生态聚集分析结果显示,生态聚集过程应该与环境特征和养殖策略有直接的关系。肠道微生物代谢活性总体变化趋势结果显示,随着时间的延长,72 h前微生物整体代谢活性呈现快速增加趋势,随后变缓并逐渐趋于平稳;不同养殖模式下斑节对虾肠道微生物代谢碳源种类和活性具有显著差异。
关键词:斑节对虾;肝胰腺;肠道微生物;高通量测序;代谢活性
斑节对虾(非洲群体)(Penaeus monodon)又称金刚虾、斑节王、草虾王,隶属于节肢动物门、甲壳纲、十足目、对虾科、对虾属,其体长侧扁、略呈梭形,体色鲜亮且较深,头胸甲厚实,属杂食性动物,适宜在水温25~32 ℃、盐度30左右的沙底质环境中生活。该虾抗病能力较强,适宜工厂集约化、高位池、池塘等多种养殖模式 [1]。
工厂化养殖模式是一种高投入、高产出的新型养殖模式 [2],因其对环境友好、节能、节水等优势特征被应用较多 [3-5]。目前工厂化养殖主要有设施化养殖、流水养殖、半封闭循环水养殖和全封闭循环水养殖等几种类型。但是,对虾工厂化循环水养殖往往初期投入大,能耗和运行成本较高,在现阶段我国的国情下较难立足。发展对虾工厂化循环水养殖必须立足各地不同的环境条件,借鉴现有经验进行开发。高位池养殖模式是推动中国对虾养殖业恢复和发展的重要模式,目前在我国对虾养殖产业中占据重要地位 [6]。高位池是1个半人工半天然的生态系统 [7],对虾与残饲、粪便、生物遗骸等在其中相互作用,通过跟踪监测微生物状况等方法可探索不同区域对虾养殖模式和养殖效果之间的对应关系 [8-10],最终促进系统(气候环境、养殖环境、生理环境、用药环境)的健康循环。
对虾肠道是动物机体获得外界能量、参与外界基础物质循环的主要“场所”,甚至被称为机体的“第二大脑”。肠道菌群是寄居在肠道内的庞大微生物群,与宿主呈相互依存、相互制约的共生状态 [11-12]。肝胰腺是对虾健康生长、代谢及免疫的前提基础,其状态不仅关系着机体对外源营养物质的消化、吸收,也影响着机体免疫系统的正常运转。肝胰腺作为重要器官之一,同样受到微生物菌群的影响。例如,弧菌的增加可能会改变肝胰腺的状态结构,提高疾病感染率 [13];饲料等外源物质的毒素亦可能损伤肝胰腺结构,增加死亡率 [12];对虾肝胰腺还可以分泌各种消化酶,间接在免疫防御中发挥重要作用 [14]。
目前普遍认为,肝脏与肠道是相互作用、相互影响的。有研究报道,对虾肝胰腺病变的同时,机体肠道也会发生不同程度的病变 [15-16]。近年来,针对“肠-肝轴”的研究日益增多,关于条件性致病因素对于水产养殖物种致病机理的研究,特别是针对肝胰腺或者肠道免疫功能的研究越来越受到重视。动物宿主微生物群对周围生长环境具有强烈的选择性,机体微生物群和潜在的生态系统在生长中会受到生物和非生物变异的影响,但其影响机制尚不清楚。本试验尝试通过对虾肝胰腺及肠道微生物的变化来反映养殖模式及环境的重要性,分析存在其中的密切而复杂的相互作用,以期为斑节对虾健康养殖提供参考。
1 材料和方法
1.1 试验设计及试验动物管理
试验在山东省滨州市无棣北海新区养殖场进行。分别采用高位池养殖和工厂设施化养殖两种模式饲养斑节对虾,其中高位池面积为337 m2/口,对虾放养密度为300尾/m2;工厂设施化养殖池面积为36 m2/口,对虾放养密度为600尾/m2。每种养殖模式设3口平行养殖池。
斑节对虾(非洲群体)(以下简称为“对虾”)来自福建某养殖场,暂养后试验初始平均体质量为(1.5±0.3)g。试验共进行31 d(2021年7月2日—2021年8月1日)。试验水源为海水,经砂滤、消毒后进入蓄水池。试验水质条件为:盐度30.0±1.5,pH 7.8±0.5,水温(28±1.5)℃,溶解氧(7.5±1.0)mg/L,氨氮<0.5 mg/L。罗茨鼓风机24 h充气,每日上午10:00换水1次。每日投饲量为对虾体质量的8%~10%,分5次投喂( 6:0 0、10:00、14:00、18:00、22:00),并根据当日天气、剩余饲料情况等进行调整
1.2 试验方法
1.2.1 样品采集
饲养试验结束后,采用5点取样法在每口养殖池各采集100尾健康对虾。随即获取其肠道内容物和肝胰腺组织。混匀后迅速置于液氮中带回实验室备用。样品分为两个部分,一部分用于 Biolog分析,另一部分用于DNA提取及高通量测序分析。
1.2.2 基因组DNA提取、扩增、纯化
采用E.Z.N.A.Stool DNA Kit提取对虾肝胰腺及肠道内容物微生物总基因组DNA,按照操作说明方法进行。提取得到的DNA经1.5 %琼脂糖凝胶电泳检测其完整性,并由超微量核酸蛋白分析仪(Biodropsis BD-1000)测定其浓度,于 -80 ℃保存作为模板使用。反应体系为25 μL,包括基因组DNA模板50 ng,V3+V4区通用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)各2.5 μL, Pusion Hot start flex 2×Master Mix 12.5 μL,补充ddH2O至25 μL。反应条件为:98 ℃变性30 s,扩增98 ℃ 10 s,54 ℃ 30 s,72 ℃ 45 s,共35个循环;72 ℃延伸10 min。PCR产物经回收、纯化后备测。
1.2.3 高通量测序及分析
纯化后的产物由杭州联川生物技术股份有限公司通过文库制备和库检后进行Illumina MiSeq "2×300 bp paired-end上机测序。Miseq测序完成后,得到原始的下机数据,去除reads(读长)的barcode(样品标签)和接头序列,利用overlap将双端数据进行拼接,去除含有N(N表示无法确定碱基信息)的比例大于5%的tags(标签),去除低质量tags(质量值Q<10的碱基数占所有tags的20%以上),通过质控和过滤后,获得高质量的clean数据(有效数据)。对有效数据进行97%的相似度聚类,采用CD-HIT将序列相似性大于97%的clean tags定为一个OUT(operational "taxonomy unit),过滤后获得最终的OTU丰度及代表序列,进一步进行多样性分析和差异分析等。分析内容包括原始数据优化及有效优质序列统计、OTU Venn图、Alpha多样性指数分析、基于weighted UniFrac距离PCoA分析、Rank- aboundance曲线分析、分类学丰度分析、物种差异分析。
1.2.4 ECO代谢活性分析
肠道微生物的整体代谢活性可通过平均吸光值(average well color development,AWCD)来分析,即计算一定时间内微生物的整体代谢平均活性。本研究通过BiologTM的ECO测试板(ECO MicroPlate,USA)对其进行测定。ECO板含有3套31种不同碳源,其中氨基酸类6种、糖类10种、羧酸类7种、聚合物类4种、胺类2种和酚类2种(见表1)。将不同模式的对虾肠道样品混合物按照一定比例用0.9%生理盐水稀释后,倒在无菌加样槽中,然后加样于25 ℃预热的ECO 96孔微板中,每孔加入150 μL;加好样的微板加盖后于28 ℃恒温培养,每隔24 h读取各孔在590 nm波长下的光密度,连续测定120 h,每个样品做3个重复。其计算公式为:
D=∑(Ci-R)/n (1)
式(1)中:D为平均吸光值,Ci为所测定的31个碳源孔的吸光值,R为对照孔的吸光值,n为培养基碳源总数(本试验中n=31)。
1.3 数据分析
16S rDNA测序结果经QIIME 2软件分析获得,数据库包括RDP、Greengenes、NCBI 16S Microbial和Customized database。通过SPSS 20.0软件对所得数据进行统计学分析。
2 结果
2.1 序列质量及特征分析
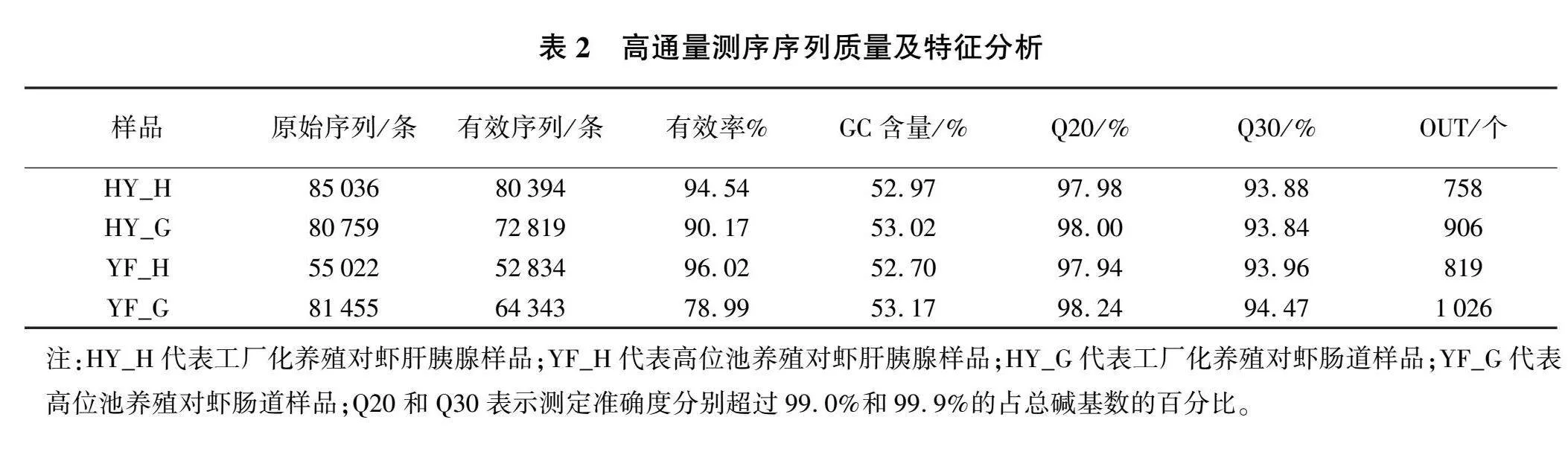
从每个样本的测序下机原始数据整理发现,模糊碱基非常少,G+C碱基数量占比约53.0%,90.0%以上的碱基测定准确率达99.9%,95.0%以上的碱基测定准确率达99.0%(见表2)。因此,本次测序原始数据的平均质量达到预期,可以进行后续分析。
对虾肝胰腺样品高通量测序结果显示,工厂化养殖模式下对虾肝胰腺样品高质量序列平均为85 036条,有效序列数达到94.54%,样本中有758个操作分类单元(OUT);肠道样品高质量序列平均为80 759条,有效序列数达到90.17%,样本中有906个OTU。高位池养殖模式下对虾肝胰腺样品高质量序列平均为55 022条,有效序列数达到96.02%,样本中有819个OTU;肠道样品高质量序列平均为81 455条,有效序列数达到 78.99%,样本中有1 026个OTU。高位池养殖模式的OTU数量(相似度大于97%)多于工厂化养殖模式的。
2.2 不同养殖模式下对虾肝胰腺和肠道菌群 Alpha多样性特征分析
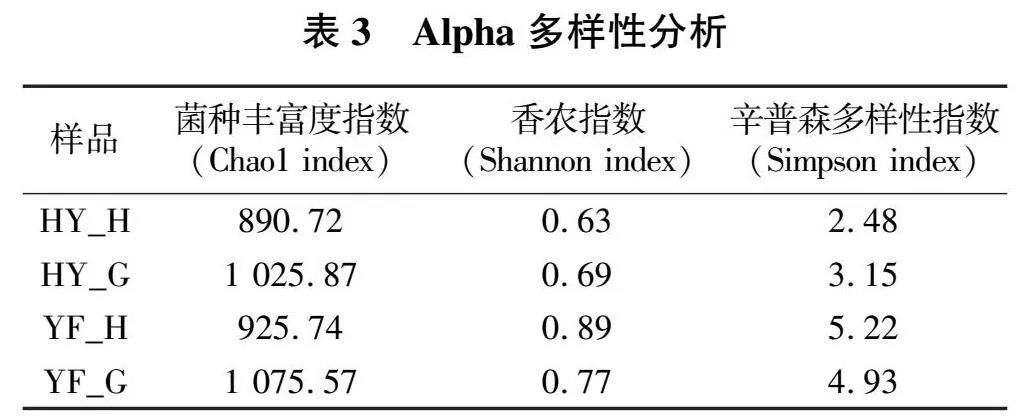
表3呈现了工厂化和高位池养殖对虾肠道菌群Alpha多样性特征,反映了不同模式下对虾肠道菌群特征与模式环境的相互关系。从菌种丰富度指数(Chao1 index)、香农指数(Shannon "index)、辛普森多样性指数(Simpson index)等数据结果分析,高位池养殖模式的菌群多样性和丰富度均大于工厂化养殖模式的。
图1是使用97%相似度的OTU制作的稀释曲线图,表现了样本中物种的丰富度,说明本研究中测序数据量的合理性;折线图横轴上的长度表示样本中的可操作分类单元数量,平缓或陡峭现象反映均匀度大小,说明高位池养殖模式下对虾肠道和肝胰腺样品中的菌落丰富度和菌落组成均匀度略高于工厂化养殖模式。对各个样品细菌多样性的相互关系进行分析,并构建Venn图(见图2),结果显示,工厂化和高位池不同养殖模式下对虾肝胰腺样品中共有294个OTUs,肠道样品中共有401个OTUs。差异可操作分类单元比较结果显示,高位池养殖模式的OTUs多于工厂化养殖模式,说明养殖模式与微生物菌群结构存在必然的联系。
2.3 不同养殖模式下对虾肝胰腺和肠道菌群Beta多样性特征分析
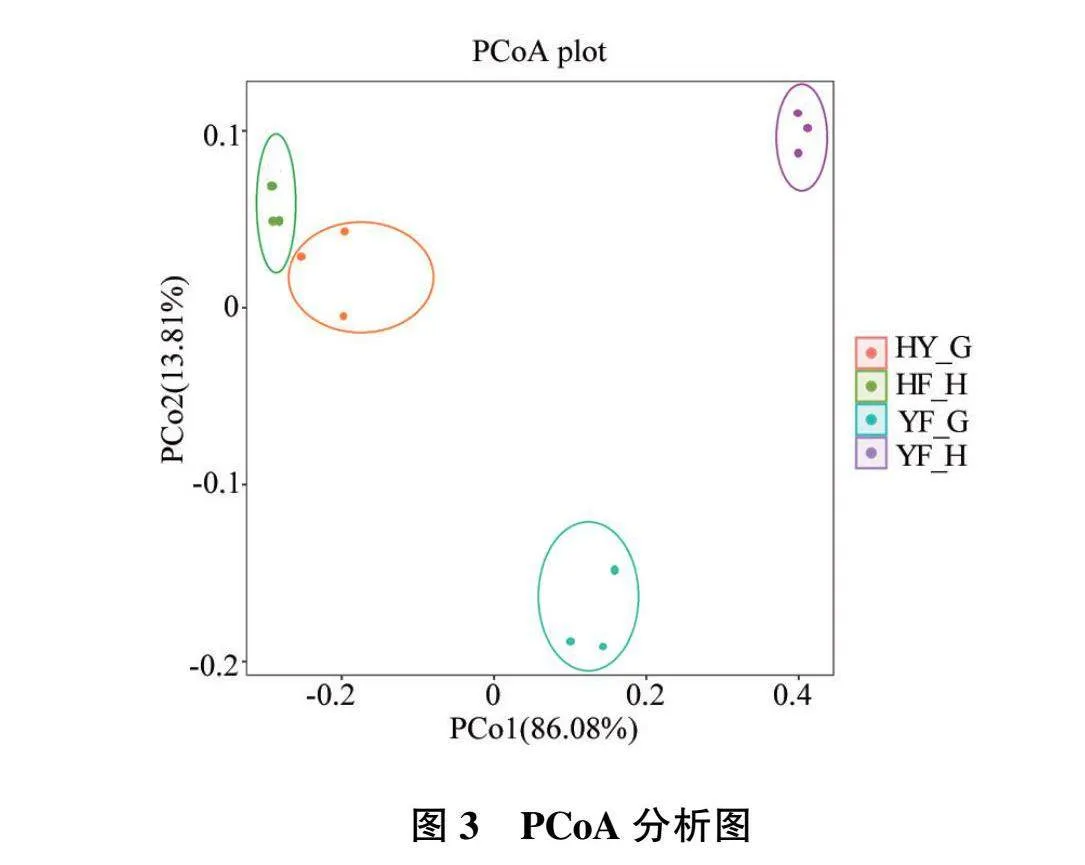
PCoA结果计算了weighted UniFrac距离(考虑了样本之间物种类别差异以及各类别物种的丰富度差异),依据距离矩阵进行主成分分析,与Alpha多样性构成不同菌群的异质性(见图3)。结果显示,加权法横坐标PCoA1,贡献率值为 86.08%;纵坐标PCoA2,贡献率值为13.81%,说明不同养殖模式的对虾样品来自于不同的养殖环境,体现了不同物种的异质性和多样性,同类样本距离较近,多样性差异较小。
2.4 不同养殖模式下对虾肝胰腺和肠道菌群组成分析
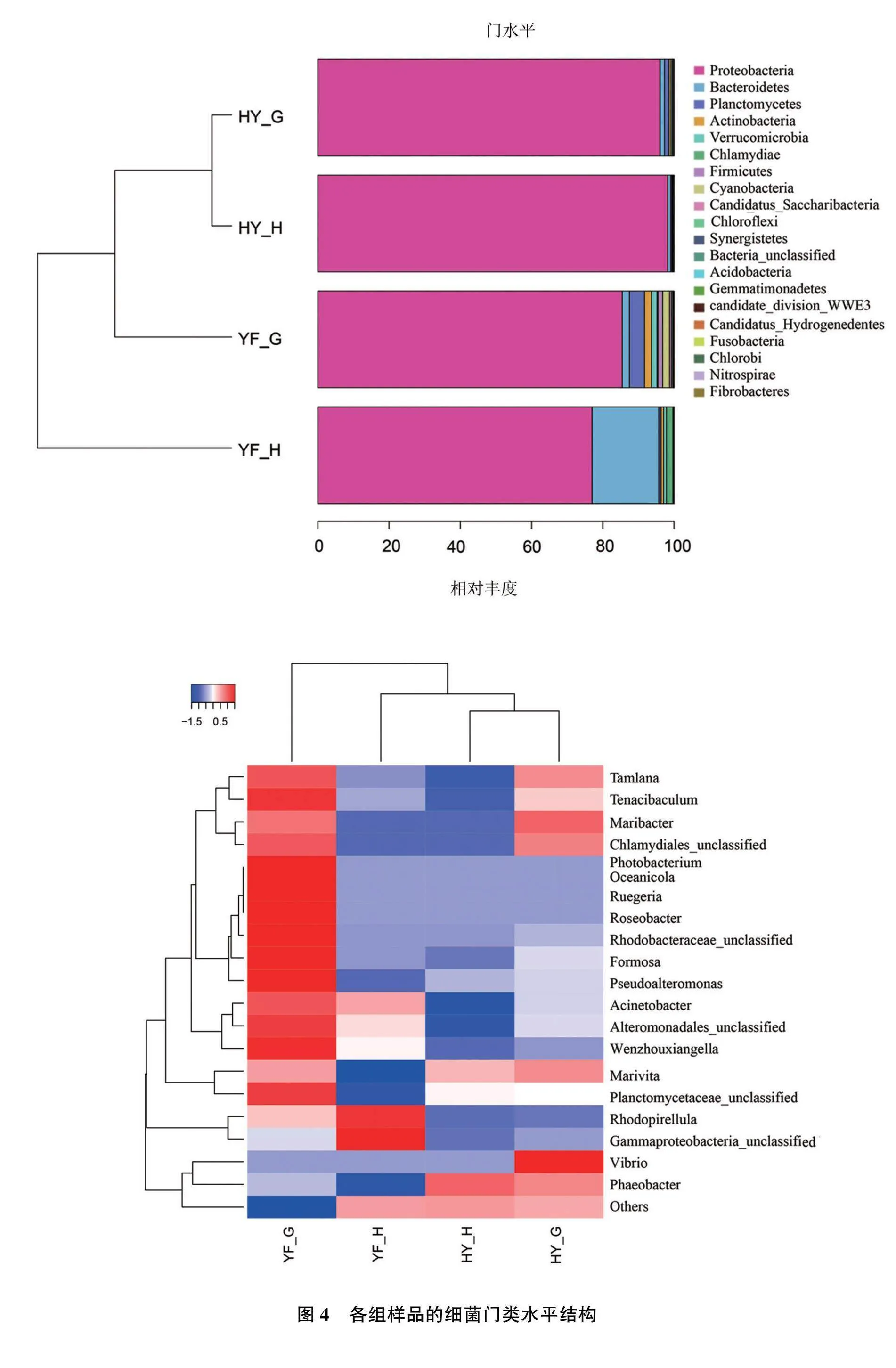
不同养殖模式下对虾肠道及肝胰腺样品中细菌群落的组成见图4、图5。从细菌门水平上分析(见图4),不同样品中的优势菌门包括变形菌门Proteobacteria、拟杆菌门Bacteroidetes、浮霉菌门Planctomycetes、放线菌门Actinobacteria、疣微菌门Verrucomicrobia、衣原体门Chlamydiae、厚壁菌门Firmicutes,其中占比最高的是变形菌门,工厂化养殖模式的相对丰度(肝胰腺98.22%,肠道 96.08%)显著高于高位池养殖模式(肝胰腺 77.02%,肠道85.47%)。从细菌属水平上分析(见图5),工厂化养殖模式下相对丰度最高的是发光杆菌属Photobacterium(肝胰腺96.40%,肠道89.07%),其次是红杆菌属Rhodobacter、弧菌属Vibrio等,这些菌属的丰度比例相对较低;高位池养殖模式下对虾肝胰腺中相对丰度最高的是红杆菌属(33.04%),其次是假交替单胞菌属Pseudoalteromonas(14.12%),对虾肠道中相对丰度最高的是弧菌属(48.45%),其次是红杆菌属( 10.38%),而发光杆菌属、鲁杰氏菌属Ruegeria等的丰度比例相对较低。为进一步探索细菌菌群结构与不同样本之间的联系,基于可分类的不同级别水平构建了含系统发育树、样品聚类关系树的热图(heatmap)。分析表明,门、属水平上细菌菌群进化关系聚为两大分支,其中工厂化模式肝胰腺和肠道菌群构成一支,高位池模式构成另一支,说明不同养殖模式下的细菌群落聚类不同。
2.5 不同养殖模式下样品细菌群落的生态分析
生态相似性(ecological resemblance)以计算不同样本群落组成相似程度或距离(相异程度)为基础,是处理多元生态数据的基本方法之一。
在Unifrac距离中,除了关注物种的存在与否及其丰度外,还将物种之间的进化关系考虑在内,距离0更侧重于表示两个群落的进化分类完全一致。由表4可见,工厂化养殖模式下对虾肠道与肝胰腺的微生物群落距离系数为0.05,生态相似度极高,工厂化养殖模式与高位池养殖模式对虾肠道的微生物群落距离系数为0.44;工厂化养殖模式和高位池养殖模式下的对虾肝胰腺微生物群落距离系数达到0.70,而且高位池养殖模式下对虾肝胰腺微生物群落与工厂化养殖模式下对虾肠道微生物群落的距离系数为0.66。可见生态聚集过程应该与环境和饮食有直接的关系。
2.6 不同养殖模式下肠道样品代谢活性分析
由图6可见,不同养殖模式下肠道微生物代谢活性总体变化趋势相似,72 h内微生物整体代谢活性呈现快速增强的趋势,但随时间的推移,吸光值上升趋缓,微生物代谢活性逐渐趋于平稳。从总体代谢活性来看,高位池养殖模式下对虾样品微生物对其中6类主要碳源的利用情况由强到弱表现为:羧酸类gt;氨基酸类gt;糖类gt;聚合物类gt;胺类gt;酚酸类;工厂化养殖模式下则表现为:羧酸类gt;聚合物类gt;氨基酸类gt;糖类gt;胺类gt;酚酸类,平均吸光值均随着时长的增加而增强。
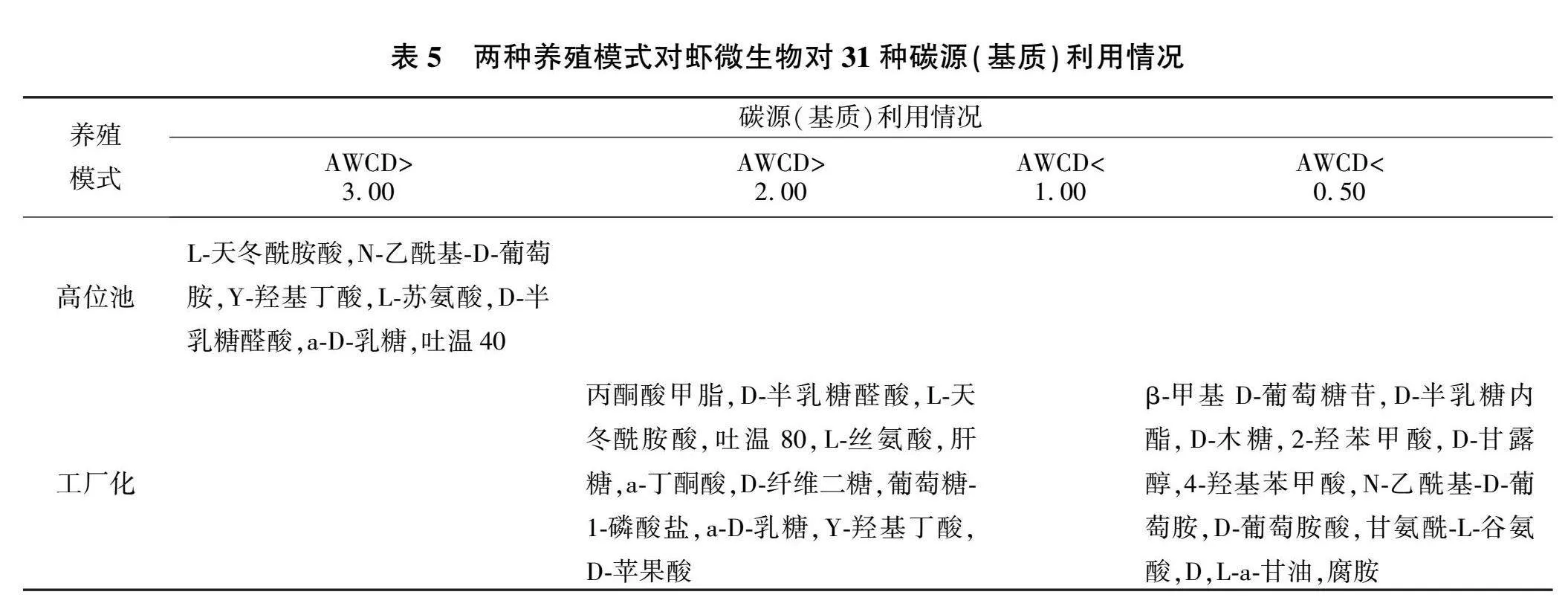
表5列出了两种养殖模式中利用率较高的碳源,其中高位池养殖模式下利用率较高(AWCDgt;3.00)的糖类有3种,氨基酸类有2种,聚合物类有1种,羧酸类有1种,酚酸类和胺类相对较弱;工厂化养殖模式下利用率较高(AWCDgt;2.00)的糖类有5种,氨基酸类有2种,聚合物类有2种,羧酸类有3种,酚酸类和胺类相对较弱。
由图7可见,不同养殖模式下微生物群落对底物碳源的利用种类和利用强度表现出差异的趋势,两种模式的微生物群落均对酚酸类的利用程度最小。
3 讨论
3.1 高位池和工厂化养殖模式下对虾肠道和肝胰腺微生物菌群结构的差异
通过了解不同养殖模式对虾肝胰腺和肠道微生物菌群的结构特征,可预警宿主疾病状态,影响制定宿主养殖过程的病害防控措施,从而降低养殖风险,提高养殖经济效益。对虾肝胰腺微生物主要来自周围环境菌群的定植,肠道微生物群主要是由对虾主动选择后定植共存 [17-19],因此,养殖环境是决定或控制对虾机体微生物菌群的决定性因素 [20-21]。本研究工厂化模式下对虾肝胰腺和肠道优势菌主要是发光杆菌属,原因可能是发光杆菌属来源于养殖水体环境及饲(饵)料的机会菌,摄入后定植于对虾机体内成为共生菌、常居菌,在菌群结构单一且外源营养不充分的情况下,可通过合成和分泌多种初生和次生代谢产物来提供良好的生理环境,维持宿主常规的代谢规律。高位池养殖模式对虾肝胰腺中相对丰度最高的是红杆菌属和假交替单胞菌属,对虾肠道中相对丰度最高的是弧菌属,这些菌属均是对虾实际养殖过程中的条件致病菌,而且,肠道微生物群在一定程度上是受某个或某些外部因素(例如养殖水体的盐度、温度和溶解氧等)的影响,驱动对虾肠道微生物群的演替 [22-23]。有研究报道,水体环境中的硝酸盐等物质可以作为某些细菌的底物能源而促进微生物菌群的结构形成 [24],水环境因子变化通过直接或间接的作用影响了对虾肝胰腺的菌群结构。这与本研究结果是一致的,可能是高位池养殖模式下对虾养殖水体环境中的硝酸盐浓度相对偏高,导致条件性致病菌的生长富集,这些结果也为后续研究提供了思路。在高位池养殖模式下,养殖过程中要更多地关注弧菌相对丰度,在菌群结构的基础上进一步探讨病害防控措施。从PCoA图也可看出,不同养殖模式下菌群结构的贡献关系可能与微生物的代谢差异有关,而代谢差异是由选择不同碳源的差异引起的,这对于后续研究微生物代谢差异的限制性因子或碳源选择偏好性提供了丰富的信息。
3.2 高位池和工厂化养殖模式下对虾肠道和肝胰腺微生物菌群代谢活性的差异
群落水平多样性(community-level "physiological profile)不仅要关注微生物对碳源利用模式,更要关注其中某一碳源的绝对利用情况,再结合其生态学意义,能更好地了解微生物群落代谢特征 [25]。ECO生态微板分析是根据微生物整体对单一碳源利用活性而进行的一种不同微生物群体的差异分析方法,因其具有灵敏度高、分辨力强、无需分离纯培养、测定简便等优点而被研究者们广泛使用 [26-28]。本试验中,两种养殖模式的水源均来自北海新区潮汐海水,水体理化性质同源,AWCD总活性表现出相似的特征,表明在同一区域相似水体的不同养殖模式下微生物的代谢活性表征没有太大差异。
微生物代谢能力可能影响环境中“废物”的存在 [29-30],由两种养殖模式微生物对碳源的总体利用能力对比发现,相比工厂化养殖模式,高位池养殖模式的AWCD活性较高,表明高位池养殖模式下微生物群落对碳源的总体利用能力较强,原因可能是高位池养殖环境中浮游动植物或无机盐等物质为对虾肠道微生物提供了一定的营养物质,加速了其对碳源的利用,而且其优势菌属(弧菌属和红杆菌属等)对羟基丁酸、苹果酸等相应底物的降解增多,这与优势菌群结构的结果相呼应。此外,大功率增氧机等设备的使用,增加了高位池水层的搅动,微生物AWCD总活性增强直观地体现出微生物群落的反应速度和营养消耗效率。有研究报道,肠道微生物菌群中异养微生物的结构和活性与碳源种类有很大的相关性 [31-32]。本研究中,两种养殖模式下的微生物碳源代谢也呈现出选择性差异,这可能与两种模式的养殖策略相关。高位池养殖模式下投喂配合饲料相对较少,而配合其他改良底质或调控水质的微生态制剂较多,且高位池中天然饵料丰富,受自然环境的影响更直接,这些波动性因素都可促使对虾机体内以及水体中微生物的差异繁殖,进而导致微生物结构及代谢活性的不同。试验中还发现,微生物在碳源利用中对胺类和酚类的利用率较低,活性较弱,这一结果可为对虾养殖过程中微生物营养需求的研究提供方向,并可在水质调控方面为研究C/N平衡和物质循环的微生物定向强化提供依据。
4 结论
斑节对虾(非洲群体)在工厂化和高位池养殖模式下肝胰腺和肠道微生物的丰富度和多样性呈现差异,高位池模式下菌群多样性和相对丰度较高,体现了不同模式的异质性和多样性。在群落组成上,工厂化养殖模式下的优势菌属是发光杆菌属,高位池养殖模式下的优势菌属是红杆菌属和弧菌属。相同养殖模式的样品相似性高于不同养殖模式,表明生态聚集过程应该与养殖环境及饲养策略有直接的关系。微生物代谢活性结果表明,高位池和工厂化养殖模式下对虾肝胰腺和肠道微生物的碳代谢能力有显著的差异。该研究结果可为分析养殖系统微生物群落的调理和代谢活性提供理论支撑。
参考文献
[1]王晓璐,樊英,王友红,等.斑节对虾(非洲群体)肠道细菌抗生素耐药性及耐药基因分布特征[J].微生物学报,2022,62(9):3399-3409.
[2]王峰,雷霁霖,高淳仁,等.国内外工厂化循环水养殖研究进展[J].中国水产科学,2013,20(5):1100-1111.
[3]TIMMONS M B, EBELING J M.The role for recirculating aquaculture systems(RAS) Part 1[J].Aquaculture Magazine,2006,32(3):26-31.
[4]程波,刘鹰,杨红生,等.Cu污染条件下封闭循环水养虾系统的效能[J].农业工程学报,2011,27(2):248-254.
[5]PEDERSEN L F,PEDERSEN P B.Hydrogen peroxide application to a commercial recirculating aquaculture system[J].Aquacultural Engineering,2012,46:40-46.
[6]颉晓勇,钟金香,李纯厚,等.高位池循环水养殖模式创新与实践[J].农业环境与发展,2012,29(6):20-22.
[7]周小壮,林小涛,林继辉,等.不同模式对虾养殖的自身污染及其环境效应[J].生态科学,2004,23(1):68-72.
[8]李琦,李纯厚,颉晓勇,等.对虾高位池循环水养殖系统对水质调控效果研究[J].农业环境科学学报,2011,30(12):2579-2585.
[9]胡维安,李纯厚,颉晓勇,等.高位池循环水养殖系统的构建及其水质调控效果[J].广东农业科学,2011,38(23):124-128.
[10]李纯厚,魏小岚,颉晓勇,等.对虾高位池循环水养殖效果比较分析[J].广东农业科学,2011,38(17):91-95.
[11]GENSOLLEN T,IYER S S,KASPER D L,et al.How colonization by microbiota in early life shapes the immune system[J].Science,2016,352(6285):539-544.
[12]NORMAN J M,HANDLEY S A,VIRGIN H W.Kingdom-agnostic metagenomics and the importance of complete characterization of enteric microbial communities[J].Gastroenterology,2014,146(6):1459-1469.
[13]QIN J J,LI R Q,RAES J,et al.A human gut microbial gene "catalogue established by metagenomic sequencing[J].Nature,2010,464(7285):59-65.
[14]KAU A L,AHERN P P,GRIFFIN N W,et al.Human nutrition,the gut microbiome and the immune system[J].Nature,2011,474(7351):327-336.
[15]LIGHTNER D V,REDMAN R M,PANTOJA C R,et al.Early mortality syndrome affects shrimp in Asia[J].Global Aquaculture Advocate,2012,15:40.
[16]LIU W,WU J P,LI Z,et al.Effects of dietary coated protease on growth performance,feed utilization,nutrient apparent digestibility,intestinal and hepatopancreas structure in juvenile Gibel carp (Carassius auratus gibelio)[J].Aquaculture Nutrition,2018,24(1):47-55.
[17]ZHOU Q,ZHU X,LI Y Z,et al.Intestinal microbiome-mediated resistance against vibriosis for Cynoglossus semilaevis[J].Microbiome,2022,10(1):153.
[18]XIONG J B,DAI W F,QIU Q F,et al.Response of host-bacterial colonization in shrimp to developmental stage,environment and disease[J].Molecular Ecology,2018,27(18):3686-3699.
[19]BURNS A R,STEPHENS W Z,STAGAMAN K,et al. Contribution of neutral processes to the assembly of gut "microbial communities in the zebrafish over host development[J].The ISME Journal,2016,10(3):655-664.
[20]HAO Y T,WU S G,XIONG F,et al.Succession and fermentation products of grass carp (Ctenopharyngodon idellus) hindgut "microbiota in response to an extreme dietary shift[J].Frontiers in Microbiology,2017,8:1585.
[21]CORNEJO-GRANADOS F,GALLARDO-BECERRA L, LEONARDO-REZA M,et al.A meta-analysis reveals the "environmental and host factors shaping the structure and "function of the shrimp microbiota[J].PeerJ,2018,6:e5382.
[22]XIONG J B,XUAN L X,YU W N,et al.Spatiotemporal "successions of shrimp gut microbial colonization:high "consistency despite distinct species pool[J].Environmental "Microbiology,2019,21(4):1383-1394.
[23]ZHAO Y T,DUAN C L,ZHANG X X,et al.Insights into the gut microbiota of freshwater shrimp and its associations with the "surrounding microbiota and environmental factors[J].Journal of Microbiology and Biotechnology,2018,28(6):946-956.
[24]KUHN D D,SMITH S A,BOARDMAN G D,et al.Chronic "toxicity of nitrate to Pacific white shrimp,Litopenaeus vannamei:impacts on survival,growth,antennae length,and pathology[J].Aquaculture,2010,309(1/2/3/4):109-114.
[25]OEHMEN A.The competition between polyphosphate accumulating organisms and glycogen accumulating organisms in the enhanced biological phosphorus removal process[D].Brisbane:The University of Queensland,2005.
[26]ZHANG T Y,WU Y H,ZHUANG L L,et al.Screening heterotrophic microalgal strains by using the Biolog method for biofuel production from organic wastewater[J].Algal Research,2014,6:175-179.
[27]李志斐,谢骏,郁二蒙,等.基于Biolog-ECO技术分析杂交鳢和大口黑鲈高产池塘水体微生物碳代谢特征[J].农业环境科学学报,2014,33(1):185-192.
[28]袁翠霖.罗非鱼养殖系统微生物群落生态研究及潜在有益菌的筛选[D].广州:暨南大学,2011.
[29]LPEZ M J,ELORRIETA M A,VARGAS-GARCíA M C,et al.The effect of aeration on the biotransformation of lignocellulosic wastes by white-rot fungi[J].Bioresource Technology,2002,81(2):123-129.
[30]DIGNAC M F,HOUOT S,FRANCOU C,et al.Pyrolytic study of compost and waste organic matter[J].Organic Geochemistry,2005,36(7):1054-1071.
[31]CHOI K H,DOBBS F C.Comparison of two kinds of Biolog "microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J].Journal of Microbiological Methods,1999,36(3):203-213.
[32]魏成,刘平.人工湿地污水净化效率与根际微生物群落多样性的相关性研究[J].农业环境科学学报,2008,27(6):2401-2406.
Distribution characteristics of microorganisms in hepatopancreas and intestine of
Penaeus monodon under industrial and high-pond culture modes
YU Xiaoqing1, WANG Youhong1, BI Yijia2, WANG Xiaolu1, WANG Shuxian1,
GAI Chunlei1, XU La1, YE Haibin1, LI Li1, DIAO Jing1, LIU Xintian2, LIU Hongjun1, FAN Ying1
[1. Marine Science Research Institute of Shandong Province; Key Laboratory for
Disease Control in Mariculture of Shandong Province(National Oceanographic Center, Qingdao),
Municipal Engineering
Research Center of Aquatic
Biological Quality Evaluation and Application,
Qingdao
266104, China; 2. Weihai Oceanic Development Research Institute, Weihai 264200, China]
Abstract: To describe the characteristics of microorganisms in the hepatopancreas and intestine of Penaeus "monodon under different culture modes, the structural characteristics of the hepatopancreas and intestinal "microbiota and the metabolic activities of intestinal microorganisms of P. monodon under high-level pond and "industrial culture modes were investigated based on high-throughput sequencing and Biolog ECO technology. The results of high-throughput sequencing showed that the diversity and richness of intestinal microbiota in the "high-level pond culture mode were significantly higher than those in the factory culture mode, and the similar "samples were closer, reflecting the heterogeneity and diversity of species in the shrimp samples of different modes. The results of bacterial phyla and relative abundance in different samples showed that the dominant phyla of shrimp intestinal flora included Proteobacteria, Bacteroidetes, Planctomycetes, Actinobacteria, etc., and the highest proportion was Proteobacteria. At the genus level, the highest relative abundance in the factory culture mode was Photobacterium, and the highest relative abundance in the high-pond culture mode was Rhodobacterium and "Vibrio. Based on the results of Unifrac distance ecological aggregation analysis, the ecological aggregation process should be directly related to environmental characteristics and breeding strategies. The metabolic activity of "intestinal microorganisms increased rapidly in first 72 hours, but then slowed down and stabilized gradually with time extends. The types and activities of intestinal microbial metabolic carbon sources of shrimp under different culture modes showed different trends.
Key words: Penaeus monodon; hepatopancreas; intestinal microbiome; high-throughput sequencing; metabolic activity

