团头鲂lpin1基因的克隆、表达及对肌肉损伤的响应


关键词 团头鲂; lpin1 基因; 基因表达; 肌肉损伤修复
骨骼肌卫星细胞(skeletal muscle satellite cell,MuSC)是参与肌肉受损后修复和再生过程的肌肉干细胞[1]。一旦肌肉受到损伤,MuSC 就会响应并退出静止状态,然后增殖成为生肌前体细胞或肌母细胞[2],增殖结束后分化成肌细胞,以相互融合或和肌纤维融合的方式来修复受到损伤的肌肉组织,并补充骨骼肌卫星细胞数量[3-4]。在这个过程中,MuSC会受到多种因子的调控,特别是以Pax7(paired box7)表达为特征的MuSC 发挥着十分关键的作用,缺乏Pax7 的卫星细胞,会导致肌肉再生失败[5-6]。
Lpin1 既可以作为一种磷脂酸磷酸化酶(phos⁃pha-tidic acid phophyhydrolase,PAP)参与磷脂和甘油三酯的合成[7],也可以作为一种转录辅激活因子,调节脂类代谢相关基因的表达[8]。之前的研究发现Lpin1 在脂肪分解和脂肪细胞分化[9-10]、肝脏脂肪酸和脂蛋白生成[11]以及线粒体自噬中都发挥重要作用[12-14]。LPIN1 缺乏症患者会出现肌肉萎缩和横纹肌溶解症[15-16],LPIN1 基因杂合子突变的患者也易患他汀类药物诱导的肌病[17]。LPIN1 缺乏的脂肪肝营养不良小鼠在肌肉损伤后,再生肌纤维横截面会减少,肌分化因子(myogenic differentiation,MyoD)的表达降低[18]。另外,小鼠Lpin1 基因缺乏会导致其骨骼肌纤维表型显著变化,肌膜下线粒体质量也有所增加[19]。在斑马鱼中,lpin1 基因的缺失会导致肌分裂缺陷,初级和次级运动神经元减少[20]。以上研究说明,磷脂酸磷酸化酶基因可能在骨骼肌损伤后修复的过程中扮演着重要角色。
前期基于团头鲂骨骼肌损伤后的转录组数据分析发现,lpin1 基因在团头鲂肌肉损伤后差异表达[21],为进一步研究该基因的功能,本研究克隆团头鲂lpin1 基因,检测lpin1 在团头鲂成鱼各组织及胚胎发育过程中的表达模式,并分析肌肉损伤对该基因表达的影响,旨在为深入研究lpin1 基因在鱼类肌肉损伤修复过程中的作用机制提供理论依据。
1 材料与方法
1.1 肌肉损伤试验和样品收集
本研究使用的团头鲂幼鱼(1 龄)全长(15.62±2.33) cm,购自黄冈团头鲂养殖场,充氧袋打包运回华中农业大学水产学院试验基地,并于池中暂养2 周后用于肌肉损伤试验。供试鱼用0.1% 的MS-222(Sigma)麻醉后,用直径0.2 cm 的针头插入其排泄孔上方侧线附近的肌节中进行肌肉损伤操作,其中轻度损伤的长度约为0.3 cm,重度损伤的长度约为1 cm,深度约为0.5 cm。将损伤后的团头鲂鱼体消毒后立即放入清水中,正常养殖。分别于损伤后0、24、48、72、96、144、216 h 取损伤部位的肌肉组织(规格为1.0 cm ×1.0 cm),所取样品立即放入液氮中保存,每个时间点取9 尾鱼样本。
试验所需胚胎及仔鱼是通过3 对团头鲂亲本人工授精而来。受精卵在平均水温27 ℃左右的孵化桶中进行孵化,解剖镜下观察胚胎发育情况,取样后立即放入液氮中保存。原位杂交所用胚胎去卵膜后于4% 多聚甲醛中4 ℃ 固定24 h 后脱水至甲醇中-20 ℃保存。另外,采集团头鲂成鱼(n=3)肝脏、鳃、心脏、大脑、肠道和肌肉等6 个组织样品,用于分析目的基因在各组织中的表达情况。
1.2 总RNA提取及cDNA合成
参照TRIzol® Reagent 说明书提取各时间点团头鲂胚胎、仔鱼和成鱼各组织及损伤肌肉的总RNA,用HiScript®ⅡQRT SuperMix for qPCR(+gDNA wip⁃er)试剂盒将提取的RNA 反转录成cDNA 后保存至-20 ℃。
1.3 基因的克隆
从笔者所在实验室前期已有的团头鲂转录组数据中获得lpin1 基因的序列,通过PCR 验证该基因的ORF 序列,并送至武汉天一辉远科技有限公司测序,PCR 引物见表1。
1.4 生物信息学分析
运用在线网站(www.ncbi.nlm.nih.gox/orffinder)预测氨基酸序列;使用MAGA 6.0 软件构建Lpin1 蛋白的系统进化树、DNAMAN 软件进行Lpin1 蛋白的多序列比对;蛋白质信号肽预测、蛋白质的理论分子质量和理论等电点分析分别用软件SignalP(www.cbs. dtu. dk/services/SignalP/)和Protparam(http://web.expasy.org/protparam)进行;利用NCBI 的CDD数据库(www.ncbi.nlm.nih.gov/cdd)预测Lpin1 蛋白的结构域。
1.5 荧光定量PCR
为分析lpin1 基因的时空表达谱,本研究分别以团头鲂成鱼各组织、胚胎发育各时期和不同损伤程度的肌肉的cDNA 为模板,以ef-1α 作为内参基因,试验步骤参照文献[22],结果通过2-ΔΔCt法计算目的基因的相对表达量并使用GraphPad Prism 6 进行制图。数据以Mean±SD 表示,采用单因素方差分析方法(ANOVA)和Duncan’s 进行差异表达分析,当Plt;0.05 时为差异显著。
1.6 整胚原位杂交
以团头鲂cDNA 作为模板扩增lpin1 基因,PCR产物回收后参照下列反应体系进行体外转录:回收产物1 μg,DIG-labeling UTP Mix(10×)1 μL,Tran⁃scription buffer(5×)2 μL,T7/SP6 RNA 聚合酶(20U/μL)1 μL,RNase Inhibitor 1 μL,DEPC 水加至20μL;吹打混匀后37 ℃水浴2 h,然后加入1 μL DNas⁃eI 37 ℃水浴15 min 除去DNA 后合成探针。整胚原位杂交的步骤参照文献[23]进行。
2 结果与分析
2.1 基因的序列分析
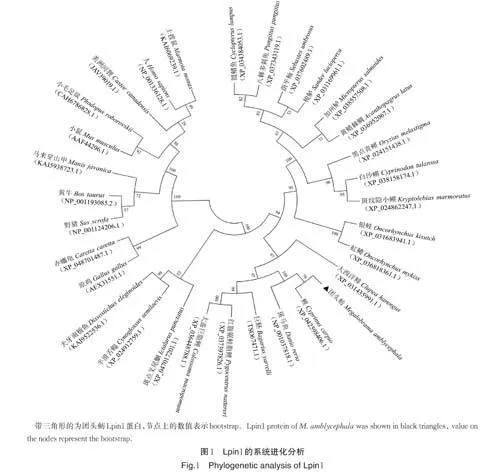
团头鲂lpin1 基因的ORF 序列长度为2 694 bp,编码897 个氨基酸。预测的蛋白理论分子质量为98.93 ku,理论等电点为5.43。SignalP 预测结果显示,Lpin1 蛋白N-末端无信号肽,为非分泌型蛋白。基于多个物种Lpin1 氨基酸序列的系统进化分析显示,鱼类聚为1 个分支,爬行类、鸟类和哺乳类形成另一分支,在鱼类分支中团头鲂与鲤和斑马鱼的亲缘关系最近(图1)。多序列比对结果如图2 所示,团头鲂Lpin1 和鲤的相似性最高(80.92%),其次是斑马鱼(79.55%),最低的是白沙鳉(53.33%)。对不同物种Lpin1 蛋白结构域分析表明,该蛋白的氨基端、中间和羧基端都有一段高度保守的序列,分别为Lipin-N、Lipin-mid 和LNS2(Lipin/Ned1/Smp2)结构域。
2.2 团头鲂lpin1 的时空表达
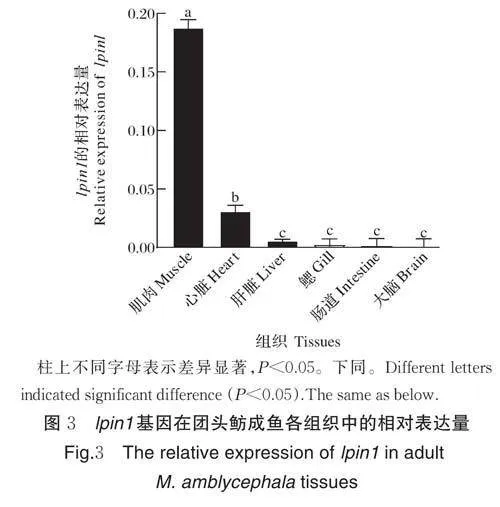
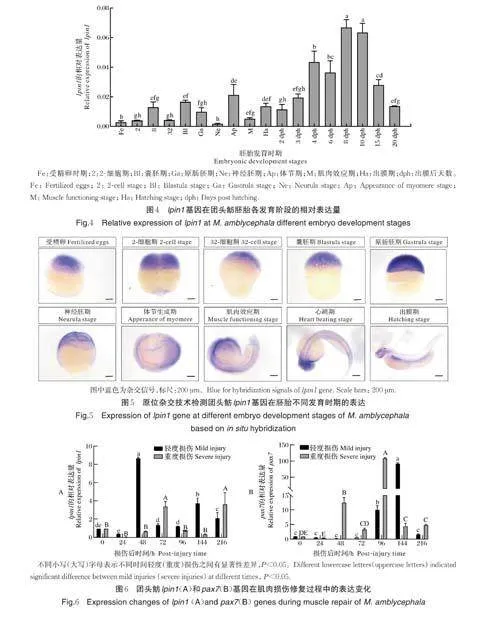
使用荧光定量PCR 分析lpin1 基因在团头鲂成鱼各组织和胚胎各发育阶段的表达,结果发现lpin1mRNA 在肌肉和心脏中的表达量最高且显著高于其他组织(图3)。另外,lpin1 基因在胚胎发育过程中的各个时期均有表达,但在出膜后的表达量相对较高,且随着发育的进行其表达量逐渐增加并在出膜后8 d达到峰值(图4)。整胚原位杂交结果进一步显示,lpin1 在受精卵期就能检测到高表达,并且在体节生成期前的各时期呈现持续而一致的泛表达模式。从肌肉效应期开始,可以在体节肌中观察到弱表达,而在眼、端脑、中脑以及后脑中检测到强信号,心跳期表现得尤其明显;随后的出膜期,其表达主要在大脑、肝脏和肠道,并且在体节肌中持续表达(图5)。
2.3 肌肉损伤后团头鲂lpin1 和pax7 基因表达的变化
荧光定量PCR 结果显示,与未损伤组相比,lpin1 和pax7 基因在轻度和重度损伤后24 h 的表达均下调。轻度损伤后,lpin1 表达量在48 h 达到峰值,然后降低,但在48~216 h 其表达量均高于对照组;而pax7 基因表达量在损伤后96 h 显著升高,并在144 h 达到最高。重度损伤后,lpin1 表达量在72h 和216 h 时显著高于对照组;pax7 表达量在48 h 和96~216 h 均显著高于对照组,且在96 h 达到峰值(图6)。
3 讨论
本研究获得了团头鲂lpin1 基因ORF 全长2 694bp,编码897 个氨基酸。通过对不同物种功能结构域分析发现,该蛋白的氨基末端和羧基末端都有一段高度保守的序列,分别为Lipin-N 和LNS2(Lipin/Ned1/Smp2)结构域。其中LNS2 结构域包含了磷脂酸磷酸酶活性序列DxDxT 和转录共激活因子功能的活性位点基序LxxIL,DxDxT 的存在将Lpin1 鉴定为卤代酸脱卤酶超家族(haloacid dehalogenase super⁃family, HAD)的成员[24],PGC-1α 和PPARα 能通过与LxxIL 直接作用调节脂肪酸氧化基因的转录[8]。进化树分析结果显示团头鲂与其他鱼类聚为一个分支,且与鲤和斑马鱼的亲缘关系最近。Lpin1 的结构域和进化树分析说明其在进化过程中可能具有保守的生物学功能。
本研究发现lpin1 mRNA 在团头鲂成鱼肌肉和心脏中的表达显著高于其他组织。类似地,在小鼠中,lpin1 基因在脂肪、心脏和骨骼肌中高表达[7, 25]。斑马鱼中,l pin1 基因在胚胎早期发育过程中泛表达,随后开始在体节中特异表达,受精后24 h 在头部和体节肌表达,受精后72 h 仅在神经嵴、头肌和胸鳍处检测到,但受精后6 d 在肌节特异性表达恢复[20]。与在斑马鱼中研究相符,我们的研究结果显示,lpin1mRNA 从受精卵到体节生成期呈泛表达;肌肉效应期和心跳期在眼和脑中检测到强表达,出膜期在脑、肝脏和肠道的特异表达尤为明显,在这个过程中,lpin1 在体节肌中持续弱表达。
当骨骼肌出现损伤后,肌卫星细胞被激活,通过增殖、迁移和分化形成肌细胞,经过融合过程后形成新的肌纤维以修复受伤的肌肉组织[7,26-27]。肌卫星细胞增殖分化过程中,受到生长因子和转录因子等不同类型信号分子的调控[28-29]。Pax7 作为肌肉发育和再生所需的MuSC 标志物[30],在哺乳动物损伤后骨骼肌再生中发挥关键作用[31-32]。研究发现团头鲂肌肉损伤后,Pax7+细胞的数量在损伤后96~144 h达到峰值,且重度损伤的肌肉中Pax7+细胞的增殖比轻度损伤的肌肉更显著[21]。在斑马鱼中,pax7 和pax3 的表达水平在损伤后4~5 d 达到峰值[33]。在小鼠成肌细胞中,Lpin1 可以抑制细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)磷酸化进而抑制肌肉再生[18],而ERK 信号的激活发生在肌肉再生的早期阶段[34]和伤口愈合过程中[35]。另外,在脂肪肝营养不良中Lpin1 缺乏会影响骨骼肌的再生能力[18],斑马鱼中lpin1 缺失也会导致骨骼肌发育受损[20]。本研究也发现与损伤前相比,lpin1 基因在肌肉损伤修复过程中的表达发生显著变化,这些结果都说明lpin1 基因可能参与肌肉的损伤修复过程。
综上,本研究克隆获得团头鲂lpin1 基因,其Lip⁃in-N、Lipin-mid 和LNS2 结构域在进化上高度保守。时空表达结果显示lpin1 在团头鲂成鱼肌肉中的表达量最高,从受精卵到出膜后20 d 的各个时期均有表达,且肌肉效应期和心跳期时在头部和体节中特异表达。另外,本研究也发现团头鲂肌肉不同程度损伤后,lpin1 与pax7 基因表达变化呈现相似趋势,这些结果可为研究lpin1 基因在鱼类肌肉损伤和修复过程中的分子机制奠定基础。

