基于CRISPR/Cas9的基因编辑及其在甘蓝型油菜中的应用
关键词 CRISPR/Cas9; 基因编辑; 甘蓝型油菜; 种质资源创新; 作物遗传改良
油菜是世界上最重要的油料作物之一。甘蓝型油菜(Brassica napus L., AACC, 2n=38)是由二倍体亲本白菜(B. rapa, AA, 2n=20)与甘蓝(B. olera⁃cea, CC, 2n=18)在距今7 500 年前通过自然杂交产生的异源四倍体物种,拥有复杂的基因组,包含大量重复基因。甘蓝型油菜中多拷贝基因序列相似性高,阻碍了油菜基因功能研究。对油菜来说,敲除基因的所有同源拷贝是获得可靠表型的必要条件。近几十年来,X 射线辐射诱变等物理方法、甲基磺酸乙酯(EMS)诱变等化学方法以及T-DNA 插入等生物方法已被广泛应用于功能基因组学研究和作物育种。上述这些方法虽然能够产生可遗传的稳定突变,但是它们诱发的突变都是随机的。后续需要经过耗时且费力的大规模筛选,才能获得有效的目标突变体,这对于异源四倍体的油菜来说尤为不便。因此,需要寻找高效、省时、低成本、稳定遗传的新方法来促进作物遗传改良,加快种质资源创新。
近几十年来,基因编辑技术从无到有,发展迅
速。这项技术是在DNA 水平上对基因靶点进行一系列定点修饰或改造,包括碱基的插入、缺失或替换。由于能实现对靶基因的精准调控,自诞生以来基因编辑技术便被广泛地应用于不同物种的基因组DNA 修饰。基因编辑技术主要分为3 类:锌指核酸酶系统(zinc-fingers nucleases, ZFNs)、转录激活效应器样核酸酶系统(transcription activator-like effec⁃tor nucleases, TALENs)以及CRISPR/Cas 系统(clustered regularly interspaced short palindromic re⁃peats/CRISPR-associated proteins, CRISPR/Cas)。ZFN 系统和TALEN 系统由于结构复杂、成本高、效率低等问题迅速被简单快捷高效的CRISPR/Cas 系统取代。CRISPR/Cas 系统可以缩短作物改良领域中基因功能鉴定和新品种选育的时间。截至目前,CRISPR/Cas 系统已成功应用于包括油菜在内的50多种植物上[1]。本文简要介绍了基于CRISPR/Cas9系统开发的几种基因编辑工具,总结了迄今为止CRISPR/Cas9 基因编辑技术在甘蓝型油菜基因功能探究和遗传改良方面的研究现状和未来发展方向,以期为相关研究者快速了解该领域发展现状提供参考。
1 基于CRISPR/Cas9 系统的基因编辑技术
1.1 CRISPR/Cas9 编辑系统
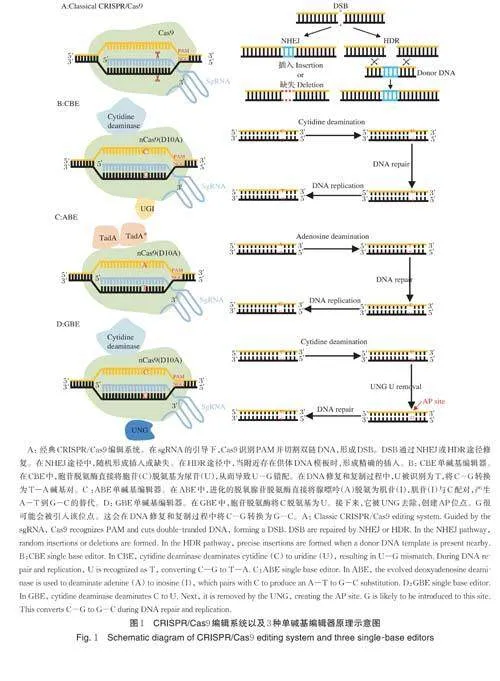
经典的CRISPR/Cas 系统根据效应模块的架构可分为2 类:Ⅰ型和Ⅱ型(图1A)。通常Ⅰ型CRIS⁃PR/Cas 系统通过多个效应子的配合来发挥其DNA切割功能,基因编辑操作相对较为复杂。与之相反,Ⅱ型CRISPR/Cas 系统仅使用1 个大的效应蛋白来进行DNA 切割,操作更简单。目前最常用的有CRISPR/Cas9 和CRISPR/Cpf1。
CRISPR/Cas9 属于Ⅱ型CRISPR 系统,由两部分组成:Cas9 蛋白和sgRNA。其工作原理是,sgRNA 通过碱基互补配对引导Cas9 蛋白靶向目标基因特定位点,该位点被称为PAM 位点(protospac⁃ers adjacent motif, PAM),Cas9 蛋白随后在PAM 位点附近切割双链DNA,造成双链断裂(DSB, doublestrandbreak)。DSB 引发细胞自损修复机制,即同源重组修复(homology directed repair, HDR)和非同源末端连接(non-homologous end joining, NHEJ),在修复的过程中随机引入碱基的插入或缺失,从而在目标基因靶点处产生随机突变。得益于其巨大的优势,CRISPR/Cas9 已用于水稻、小麦、玉米、大豆和油菜等作物的遗传改良。
1.2 碱基编辑技术
基于CRISPR/Cas9 介导的单碱基编辑能够以可设计的方式实现直接、不可逆的碱基转换,并且不需要创建DSB。目前的碱基编辑器是由人工改造的Cas9 核酸酶和单链DNA 特异性脱氨酶组成的融合蛋白。在sgRNA 的引导下,d/nCas9 将脱氨酶定位到靶点序列,形成1 个R-loop。R-loop 内的核苷酸充当脱氨酶的底物,这些核苷酸的位置定义了碱基编辑的“活动窗口”。目前广泛使用的单碱基编辑技术有2 类:胞嘧啶碱基编辑器(cytosine base editor,CBE,图1B)和腺嘌呤碱基编辑器(adenine base edi⁃tor, ABE,图1C)。除此之外,还有在CBE 基础上开发的糖基化酶碱基编辑器(glycosylase base editor,GBE,图1D)以及将2 种不同的单碱基编辑器融合形成的双碱基编辑器(dual base editor)。
1)胞嘧啶碱基编辑器。2016 年报道的胞嘧啶碱基编辑器(CBE)是第1 个建立的基于CRISPR 的单碱基编辑系统[2]。在CBE 中,nCas9(D10A)与胞苷脱氨酶和尿嘧啶DNA 糖基化酶(uracil DNA glyco⁃sylase, UNG)抑制剂(uracil DNA glycosylase inhibi⁃tor, UGI)形成融合蛋白。在sgRNA 的引导下,融合蛋白定位到靶点序列,在编辑窗口内直接诱导C/G变成T/A。为了提高CBEs 的编辑效率,CBEs 已经历了从CBE1 到CBE4 共4 代的发展。最初CBE1 是由大鼠胞苷脱氨酶(rAPOBEC1)和dCas9 组成,体内编辑效率较低,仅有7.7%;CBE2 的体内编辑效率高达20%;CBE3 的编辑效率是CBE2 的2~6 倍;而优化后形成的CBE4 的编辑效率又比CBE3 提高了1.5 倍,并且C 到G 或A 和indel 出现的频率大大降低[2]。
2)腺嘌呤碱基编辑器。腺嘌呤碱基编辑器(ABE)于2017 年首次报道[3]。理论上ABE 可以通过用腺苷脱氨酶代替胞苷脱氨酶来产生。然而自然界中没有已知的酶可以使DNA 中的腺苷脱氨基。因此,科学家将大肠杆菌tRNA 腺苷脱氨酶(ecTa⁃dA)改造为脱氧腺苷脱氨酶(TadA*),可以使ssDNA上的腺苷脱氨基。接下来nCas9(D10A)与腺苷脱氨酶TadA*融合形成ABE 系统。ABE 可以直接诱导A:T 到G:C 的转换。在这些ABE 系统中,ABE7.10被推荐用于A/T 到G/C 的转换,其效果已在多种细胞和生物中得到验证[3]。
3)糖基化酶碱基编辑器。糖基化酶碱基编辑器(GBE)于2020 年首次报道,是一种可以将C 转换为A 或者G 的碱基编辑技术。GBE 由nCas9、胞苷脱氨酶和尿嘧啶DNA 糖基化酶(UNG)组成,该系统在sgRNA 的引导下定位到靶点序列,UNG 将胞苷脱氨酶产生的U 切除,形成一个诱导DNA 修复机制的无嘌呤/无嘧啶(apurinic/apyrimidinic, AP)位点。该位点启动DNA 损伤修复,从而诱导C 转换为A 或者G[4]。为了进一步提高GBE 的性能,研究人员在GBE 的基础上构建了APOBEC(R33A)-nCas9-Rad51-Ung1 的融合蛋白,并命名为GBE2.0。该编辑器能够实现更高的编辑效率(平均30.88%),同时C 到G 的转换纯度更高。
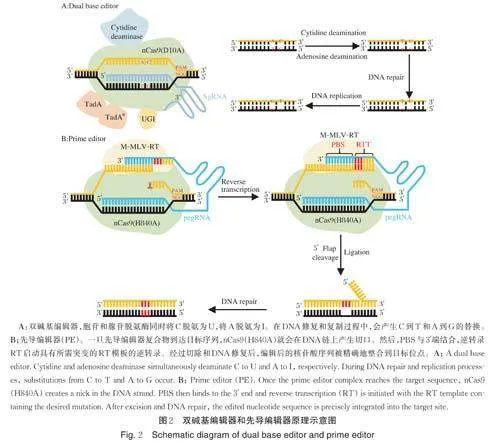
4)双碱基编辑器。上述几种单碱基编辑技术只能实现单一的碱基转换,具有局限性。为了实现同时产生不同类型的碱基转换,研究者开发出了双碱基编辑技术(图2A)。该编辑器可以同时诱导C 到T和A 到G 的碱基转换。例如,Zhang 等[5]成功开发了一种nCas9(D10A)-NG 介导的高效胞嘧啶和腺嘌呤双碱基编辑融合系统STCBE-2,并利用该系统对水稻OsEPSPS 基因编码区和预测的草甘膦结合区域进行近饱和突变,获得了高抗草甘膦的水稻新型基因资源。
1.3 先导编辑技术
先导编辑器(prime editor, PE)首次报道于2019年,它可以实现所有12 种碱基替换,特别是碱基颠换、精确插入和删除,而无需依赖DSB 和供体DNA。PE 由nCas9(H840A)和逆转录酶形成的融合蛋白以及pegRNA(prime editing guide RNA)组成(图2B)。pegRNA 包含2 个功能部分,sgRNA 靶定位序列和逆转录模板(reverse transcription template, RTT)。RTT 包括引物结合位点和编码突变信息的位点。当PE 系统融合蛋白锚定到靶位点时,nCas9 切割非互补链,逆转录酶通过RTT 逆转录出相应的含突变位点的ssDNA,然后通过DNA 修复将突变整合到受体基因组中。为了提高其效率和准确性,研究者在PE的基础上开发了PE2、PE3、PE3b3、PE4、PE5 和PEmax 共6 种编辑器[6]。最近,Sun 等[7]建立了一种在染色体上精确插入大片段DNA 的先导编辑技术PrimeRoot,能够将高达11.1 kb 的大片段DNA 精确插入植物基因组中,效率达到6.3%。
2 基因编辑技术在甘蓝型油菜中的应用
2.1 CRISPR/Cas9 在甘蓝型油菜中的应用
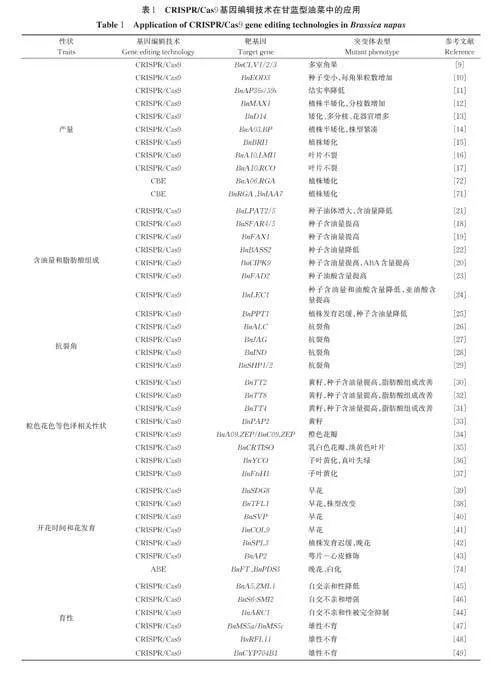
甘蓝型油菜是一种经济价值高、用途广泛的油料作物。CRISPR/Cas9 基因编辑技术可在甘蓝型油菜中实现1 个或多个基因的有效突变,产生稳定遗传的突变体。后续通过杂交分离出无T-DNA 的基因编辑植株。目前油菜中的基因编辑主要是利用CRISPR/Cas9 进行基因功能的鉴定与优异种质资源创新[ 8],包括油菜产量、含油量和脂肪酸组成、宜机收、粒色花色、开花时间和花发育、育性、营养成分、生物和非生物胁迫耐受性等性状。
1)产量相关性状。产量相关性状一直是作物育种中重点关注的性状之一,种子大小、每角果粒数和单株角果数与油菜产量密切相关。Yang 等[9]敲除了CLV-WUS 通路中的BnCLV1(CLAVATA1)、Bn⁃CLV2 和BnCLV3,每个基因均获得了双拷贝纯合突变体。其中BnCLV3 的双拷贝突变体每角果粒数和千粒重增加,可能有助于增加种子产量。Khan 等[10]敲除了BnEOD3(ENHANCER3 OF DA1)的4 个同源拷贝,观察到突变体种子变小,每角果粒数增加,4拷贝突变体的单株产量平均提高了13.9%。Wang等[11]敲除了2 种调控花粉管引导性的天冬氨酸蛋白酶基因BnAP36s(ASPARTATE PROTEASES 36)和BnAP39s,突变体的结实率分别降低了50% 和60%,由此导致产量的降低。
株型,包括株高、分枝数和叶形等性状,也是影响产量的相关性状。Zheng 等[12]敲除BnMAX1(MORE AXILLARY GROWTH 1)获得了分枝数增加的半矮化突变体。Stanic 等[13]敲除独脚金内酯受体基因BnD14 获得了分枝数和花器官增加、植株矮化的突变体。Fan 等[14]敲除BnBP(BREVIPEDI⁃CELLUS)基因发现BnBP.A03 和BnBP.C03 突变后植株均变矮,株型变紧凑,它们的双拷贝突变体极度矮化并且不育。Song 等[15]敲除BnBRI1(BRASSI⁃NOSTEROID INSENSITIVE 1)产生了半矮株系,但对产量无影响。甘蓝型油菜存在广泛的叶形多样性,包括边缘完整的不裂叶、边缘锯齿状的浅裂叶以及裂叶。油菜的裂叶已被证实是高密度种植和杂交生产的理想性状。Hu 等[16-17]通过敲除裂叶亲本的BnA10.LMI1(LATE MERISTEM IDENTITY 1)和BnA10.RCO(REDUCED COMPLEXITY),产生了不裂叶和浅裂叶的突变体,验证了BnA10.LMI1 和BnA10.RCO 正向调控甘蓝型油菜叶形的发育。
2)含油量和脂肪酸组成。提高油菜种子含油量和改善脂肪酸组成一直是油菜育种的2 个关键目标。敲除BnSFAR4/5(SEED FATTY ACID REDUC⁃ER 4/5)、BnFAX1(FATTY ACID EXPORTER 1)和BnCIPK9 (CALCINEURIN B-LIKE INTER⁃ACTING PROTEIN KINASE 9)基因可以提高种子含油量[18-20],而敲除BnLPAT2/5(LYSOPHOS⁃PHATIDIC ACID ACYLTRANSFERASE 2/5)和BnBASS2(BILE ACID SODIUM SYMPORTERFAMILY PROTEIN 2)种子含油量会降低[21-22]。脂肪酸组成是决定菜籽油品质的关键因素,脂肪酸去饱和酶基因BnFAD2(FATTY ACID DESATU⁃RASE 2)是影响脂肪酸3 种主要成分油酸、亚油酸和亚麻酸组成和比例的关键基因。敲除BnFAD2 后种子中油酸的含量提高,亚油酸和亚麻酸的含量相应降低[23]。Yan 等[24]敲除BnLEC1(LEAFY COTY⁃LEDON 1)后,突变体种子含油量和油酸含量降低,亚油酸含量提高。磷酸烯醇丙酮酸/磷酸转运蛋白(phosphoenolpyruvate/phosphate translocator, PPT)将磷酸烯醇丙酮酸从细胞质转运到质体中,用于脂肪酸(FA)和其他代谢物的生物合成。敲除BnPPT1后,植株生长缓慢,叶片变黄,种子含油量也下降了2.2%~9.1%[25]。
3)抗裂荚性状。油菜角果成熟易开裂的特性是造成田间产量损失的主要原因。Braatz 等[26]敲除BnALC (ALCATRAZ)基因发现突变体角果抗裂。Zaman 等[27]敲除BnJAG (JAGGED)的5 个同源拷贝,发现其中BnJAG.A08 拷贝突变后角果抗裂性能提高了2 倍。Zhai 等[28]敲除BnIND (INDEHIS⁃CENT)的2 个同源拷贝,发现BnIND.A03 单拷贝突变体和BnIND.A03/C03 双拷贝突变体的角果均显著抗裂。Zaman 等[29]敲除BnSHP1/2 (SHATTER⁃PROOF1/2)的所有同源拷贝,其中BnSHP1.A09、BnSHP1. A04、BnSHP1. C04-A、BnSHP2. C04-B 和BnSHP2.A05 5 个拷贝突变体表现出明显的角果抗裂性。
4)粒色、花色、叶色等色泽相关性状。油菜的黄籽性状是一种优良表型,与黑籽相比,具有种皮薄、原花青素含量低、油脂和蛋白质含量高的优点。目前已知通过敲除类黄酮途径的关键基因获得黄籽突变体的基因有BnTT2 (TRANSPARENT TESTA2)、BnTT4、BnTT8 以及BnPAP2 (PRODUCTIONOF ANTHOCYANIN PIGMENT 2),上述突变体均可提高种子含油量并改善脂肪酸组成[30-33]。
油菜花具有重要的观赏价值,花色是油菜遗传育种中备受关注的问题。与黄籽性状不同,甘蓝型油菜的花色是由类胡萝卜素含量决定的,敲除参与类胡萝卜素生物合成的玉米黄质环氧化酶基因BnZEP (ZEAXANTHIN EPOXIDASE),得到的Bna09.zep/Bnc09.zep 双突变体呈现出橘色花瓣[34]。而敲除类胡萝卜素异构酶基因BnCRTISO(CA⁃ROTENOID ISOMERASE),得到花瓣乳白色、叶片淡黄色的突变体[35]。
叶色主要与叶绿体的发育相关,Liu 等[36]敲除参与叶绿体发育的基因BnYCO (YELLOWCOTYLEDON)后,其突变体子叶黄化、真叶失绿。Xu 等[37]敲除与光合系统PSⅡ周期修复循环有关的基因BnFtsH1,突变体子叶黄化、生物量积累降低。
5)开花时间和花发育。油菜开花时间不仅影响油菜产量,还会影响下茬作物的播期,因此适宜的花期也是油菜育种的重要目标。TERMINAL FLOW⁃ER 1(TFL1)是磷脂酰乙醇胺结合蛋白(phosphati⁃dylethanolamine-binding protein, PEBP)家族成员,在高等植物的花分生组织决定和开花时间调控中起重要作用。Sriboon 等[38]敲除BnTFL1 的5 个拷贝,发现只有BnC03.TFL1 的突变体具有早花表型。Ji⁃ang 等[39]敲除组蛋白赖氨酸甲基转移酶基因BnS⁃DG8( SET DOMAIN GROUP 8),发现BnSDG8.A/C 功能缺失突变体植株开花时间提前。Ahmar 等[40]敲除BnSVP(SHORT VEGETATIVE PHASE)的所有拷贝得到不同拷贝组合的突变体,开花时间平均缩短了40.6%~50.7%。COL9 (CONSTANSlike9) 作为锌指转录因子家族的一员,控制着许多不同植物的生长发育。Guo 等[41]敲除油菜BnCOL9的4 个拷贝,得到的突变体具有早花表型。Li 等[42]敲除BnSPL3 (SQUAMOSA PROMOTER BIND⁃ING PROTEIN-LIKE 3)后,突变体发育迟缓,开花延迟。
许多芸薹属作物的产量经常受到花器官发育异常的阻碍。然而,这些异常花器官的分子机制尚不清楚。APETALA2 (AP2)作为植物ABCE 模型中的A 类基因,调控着花器官的发育。Zhang 等[43]敲除BnAP2,发现4 拷贝突变体出现萼片-心皮修饰表型。
6)育性。自交不亲和(self incompatibility, SI)是雌雄同体被子植物通过排斥自交花粉来阻止近亲交配的遗传机制,自交不亲和株系有利于杂种优势的利用。通过敲除BnMLPK (M-LOCUS PROTEINKINASE) 和BnARC1 (ARM-REPEAT-CON⁃TAINING PROTEIN 1),油菜自交不亲和性被完全抑制,自花授粉后种子比野生型显著增加[44]。与此相反的是,敲除BnA5.ZML1 和BnS6-SMI2 (SCRmethylation-inducing region 2),油菜自交不亲和性增强[45-46]。
雄性不育是提高作物产量最有效的杂种优势技术之一。Xin 等[47]敲除BnMS5a (MALE STERILI⁃TY 5)或BnMS5c,均会导致雄性不育,证明恢复等基因MS5a 和维持等位基因MS5c 都是甘蓝型油菜雄性育性所必需的。Farooq 等[48]敲除BnRFL11(RESTORATION OF FERTILITY-LIKE 11),bn⁃rfl11 表现出营养缺陷,包括分枝减少和叶片变小,同时也表现出雄性不育。细胞色素P450( CYP450)单加氧酶超家族在植物生长发育中起着重要作用。Wang 等[49]敲除BnCYP704B1,编辑后的单株在成熟花药中表现出无花粉、不育的表型。
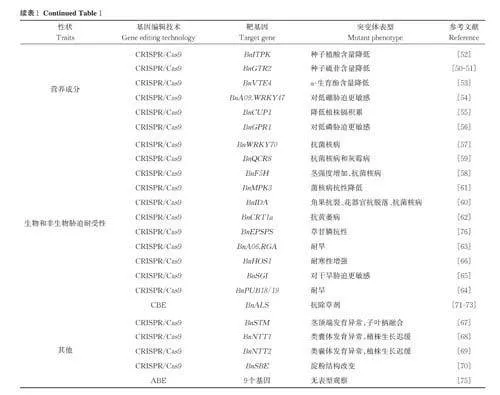
7)营养成分。硫代葡萄糖苷(glucosinolates,GSLs)是一种抗营养因子,消除或降低油菜籽中硫苷的含量是提高饲料和食品价值的必要条件。敲除硫代葡萄糖苷转运蛋白基因BnGTR2( GLUCOSINO⁃LATE TRANSPORTER 2),种子硫苷含量显著降低[50- 51]。植酸 (phytic acid, PA),同样是一种抗营养因子。 Sashidhar 等[52]通过敲除PA 生物合成的关键基因BnITPK (INOSITOL TETRAKISPHOS⁃PHATE KINASE)的3 个拷贝,得到低植酸的突变体。生育酚,即维生素E,是人体健康必不可少的营养素。Zhang等[53]通过敲除BnVTE4( VITAMIN EDEFICIENT 4),突变体的α-生育酚含量降低。
油菜在生长过程中会从土壤中吸收多种营养元素,营养元素在植物的生命代谢中各自有不同的生理功能,相互间是不可代替的。硼(B)在细胞壁形成、花粉管生长、膜完整性、固氮、糖转运和植物代谢中起着关键作用。Feng 等[54] 敲除BnA09.WRKY47,突变体对低硼胁迫更敏感,而BnA09.WRKY47 的过表达系对低磷胁迫耐受。甘蓝型油菜是一种镉(Cd)超富集植物,对食品和饲料安全构成严重威胁。Yao 等[55]敲除BnCUP1 (Cd UPTAKERELATED1),突变体降低了油菜植株体内镉的积累。磷(P)缺乏是影响油菜根系生长发育的主要环境因素。Xu 等[56]敲除BnGPR1 (GLYCINE-RICHPROTEIN 1),突变体植株对低磷胁迫更敏感,但是过表达系表现出对低磷胁迫的耐受性。
8)生物和非生物胁迫耐受性。油菜在生长发育过程中会受到生物和非生物胁迫的考验。油菜菌核病是油菜的一种重要病害,通常会导致5%~100%的田间产量损失。Sun 等[57]发现敲除BnWRKY70的3 个同源拷贝,突变体对菌核病的抗性增强。Cao等[58] 敲除BnF5H (FERULATE-5-HYDROXY⁃LASE)后,突变体的茎杆强度增加,茎叶对菌核病的抗性增强。Zhang 等[59]编辑BnQCR8 的1 个或多个拷贝,获得的突变体均对菌核病和灰霉病具有较强的抗性,并且主要的农艺性状与野生型没有显著差异。Geng 等[60]敲除BnIDA (INFLORESCENCEDEFICIENT IN ABSCISSION),突变体表现出角果抗裂、花器官不脱落、抗菌核病等优良特性。Zhang等[61] 敲除BnMPK3 (MITOGEN-ACTIVATEDPROTEIN KINASE 3)后,突变体菌核病抗性降低,但其过表达系对菌核病的抗性增强。Probsting 等[62]敲除BnCRT1a( CALRETICULIN1a)后突变体降低了对黄萎病的敏感性。
油菜生长过程中大部分时期对缺水十分敏感,因此,培育抗旱油菜品种至关重要。Wu 等[63]敲除BnRGA (REGULATORS OF GA)的4 个拷贝,发现BnA06.RGA 的突变体BnA6.rga-D 抗旱性增强。Linghu 等[64]敲除U-box E3 泛素连接酶基因Bn⁃PUB18/19( Plant U-box 18/19),突变体耐旱性显著提高。而Liu 等[65]敲除BnSGI (STRESS ANDGROWTH INTERCONNECTOR)后,突变体对干旱胁迫变得更敏感。Song 等[66]敲除BnHOS1(HIGH EXPRESSION OF OSMOTICALLY RE⁃SPONSIVE GENES 1)增强了油菜耐寒性。
9)其他。拟南芥同源域转录因子STM(SHOOT MERISTEMLESS )对于茎尖分生组织功能至关重要,它与CLV3 ( CLAVATA3)/WUS(WUSCHEL )反馈调节通路配合维持茎尖分生组织中干细胞的稳态。Yu 等[67]敲除BnSTM,突变体出现茎顶端发育异常、子叶柄融合的表型。通过敲除质体核苷酸转运蛋白基因BnNTT1 (NUCLEO⁃TIDE TRIPHOSPHATE TRANSPORTER 1)和BnNTT2,突变体均生长迟缓、类囊体发育异常以及光合效率低下[68- 69]。Wang 等[70]敲除淀粉分支酶基因BnSBE (STARCH BRANCHING ENZYMES) 6拷贝突变体中淀粉结构改变。
2.2 CRISPR/Cas9 介导的其他编辑技术在甘蓝型油菜中的应用
传统的CRISPR/Cas9 已成熟地用于甘蓝型油菜基因功能研究和种质资源创新,同时碱基编辑技术(CBE、ABE)以及病毒介导的定点插入等基于CRISPR/Cas9 的基因编辑技术也在甘蓝型油菜中有成功应用。
Cheng 等[71]在甘蓝型油菜中建立并开发了由人A3A 胞苷脱氨酶与Cas9 切口酶和尿嘧啶糖基化酶抑制剂融合组成的A3A-PBE 系统。设计了3 种sgRNA 分别靶向ALS (ACETOLACTATE SYN⁃THASE)、RGA和IAA7( INDOLE-3-ACETIC AC⁃ID 7)基因。所有3 个目标基因的碱基编辑效率均超过20%。Hu 等[72]对4 个CBE 系统进行了改造,实现油菜中5 个靶基因的胞苷碱基编辑。结果表明,3 个CBE 系统都能实现基因组编辑,其中BnA3A1-PBE与之前报道的油菜CBE 系统相比,具有最高的碱基编辑效率(最高达50.5%)。BnA06.RGA 和BnALS靶位点发生的胞苷取代可稳定遗传,分别为矮化表型和用于杂草控制的除草剂抗性。Wu 等[73]利用CBE 编辑BnALS1 和BnALS3,但在T1 代仅得到BnALS1 的编辑单株,赋予了油菜苯磺隆抗性。
最近开发的腺嘌呤碱基编辑器(ABE)能够在高等植物真核细胞中实现高效、精确的A 到G 的碱基转换。Kang 等[74]证明ABE 系统可以通过瞬时转染成功应用于拟南芥和甘蓝型油菜的原生质体,并通过农杆菌介导的转化成功应用于植物。在FLOW⁃ERING LOCUS T( FT)蛋白中进行A到G替换,产生单个氨基酸变化或PHYTOENE DESATU⁃RASE 3( PDS3)的RNA转录本的错误剪接,从而获得分别具有晚花和白化表型的转基因植物。Hu等[75]改造了4 个ABE 骨架,分别针对BnPDS、BnALS 等9 个基因设计了18 个sgRNA 进行不同ABE 系统的效率测试,在甘蓝型油菜中创建了有效的ABE 单碱基编辑系统。
油菜在种植过程中经常受到杂草的影响,培育抗除草剂品种是应对杂草威胁的有效途径。草甘膦对大面积的杂草防治非常有效,对环境的危害很小。但由于其对油菜的毒性,很少直接用于油菜田。研究表明,在不同植物中,烯醇丙酮酰莽草酸-3-磷酸合成酶(enolpyruvylshikimate-3-phosphate synthase,EPSPS)的草甘膦结合位点突变赋予了对草甘膦的抗性。Wang 等[76]为了在甘蓝型油菜中实现有效的基因替换,采用了表达由来自铜绿假单胞菌的CRIS⁃PR 相关RNA 内切核糖核酸酶Csy4 切割的单链引导RNA(sgRNA)的CRISPR/Cas9 系统,在内源性甘蓝型油菜EPSPS 基因BnC04.EPSPS 中实现了精确的基因替换,氨基酸替换频率高达20%。含有这些基因替换的油菜苗具有较强的草甘膦耐受性。
综上所述,目前已有大量研究利用CRISPR/Cas9 技术及其介导的ABE 和CBE 技术进行油菜基因功能鉴定与优异种质资源创新,从多个方面改良了油菜种质资源,我们从产量等9 个方面进行分类和汇总(表1)。
3 展望
CRISPR/Cas9 基因编辑技术显示出强大的、特异的、多重基因组编辑的能力,已广泛用于油菜重要性状的基础研究和遗传改良。但CRISPR/Cas9 基因编辑技术的潜力远远不止这些,未来该技术在油菜中应该会有更广阔的应用前景。
3.1 采用更加精确且多功能的基因编辑工具
CRISPR/Cas9 基因编辑技术虽然在油菜中已经建立了成熟的体系,但是大部分在油菜中的应用都是产生功能缺失突变体。然而许多有价值的性状是由单核苷酸多态性或者是精确设计的indel 赋予的。因此,利用遗传多样性和精确修改基因组对于作物育种非常重要。到目前为止,除了CBE 和ABE 在油菜上有初步应用外,其他精确的基因编辑例如GBE、双碱基编辑以及先导编辑PE 均未在油菜中成功实现。如果能将这些精确且多功能的技术应用于油菜中,将会极大地提高基因编辑对油菜遗传改良的有效性。
3.2 突破油菜遗传转化受体限制
目前为止,CRISPR/Cas9 在油菜中的应用主要依靠农杆菌介导的稳定转化来传递CRISPR 载体。然而,一些优良的甘蓝型油菜品种往往由于缺乏适合再生的性状而不易转化。目前报道的农杆菌介导遗传转化的油菜品种有春性品种和半冬性品种,其中春性品种有Westar、862、Haydn 等,半冬性品种有J9707、J9712、ZS6 等。除此之外,对于那些难以转化的商品油菜品种,可以通过利用形态发生基因打破遗传转化的受体限制,玉米中已经成功利用形态发生基因WUS2 和BBM 实现了稳定的遗传转化。在过去的30 a 里,基础研究为我们提供了关于控制形态发生基因的详细资料。这些见解将继续为测试形态发生基因提供灵感,并与控制表达的新方法一起,将导致不断改进,扩大适合转化的不同油菜品种的范围。此外,组织培养过程通常在技术上要求很高,耗时且费力。因此,开发无需组织培养的递送方法,如纳米颗粒或病毒递送,将有助于进一步扩大CRIS⁃PR/Cas9 在油菜中的应用。
3.3 利用CRISPR/Cas9 在油菜中构建全基因组突变体文库
CRISPR/Cas9 技术的高效率非常适合在各种生物体和细胞类型中进行高通量基因编辑。由于CRISPR/Cas9 的靶向特异性是由1 个20 bp 的sgRNA 赋予的,因此可以很容易地大规模地基于阵列合成寡核苷酸文库。这种强大的基因组级CRIS⁃PR/Cas9 诱变系统已经成功地用于水稻和玉米的研究。例如,Lu 等[77]利用CRISPR/Cas9 系统在水稻中进行基因组规模的诱变,并生成了靶向功能缺失突变体文库,为水稻研究和育种提供了有用的资源。Liu 等[78]将基于CRISPR/Cas9 的多重高通量靶向诱变与遗传定位和基因组学方法相结合,成功靶向了743 个与农艺和营养性状相关的候选基因。最近,He等[79]使用CRISPR 混合文库在甘蓝型油菜异源四倍体作物中实现基因组规模的靶向编辑,总共设计了18 414 个sgRNA 来靶向10 480 个感兴趣的基因,随后获得了1 104 株含有1 088 个sgRNA 的再生转基因植物,编辑结果显示,178 个基因中有93 个被鉴定为突变,编辑效率为52.2%。由此可见,利用CRISPR/Cas9 实现高通量的靶向基因编辑,筛选大规模突变文库,将是发现改善油菜品种目标性状新基因的良好途径。
3.4 基因编辑技术应用的前提条件和限制因子
虽然CRISPR/Cas9 基因编辑技术以其简单、高效的独特优势被广泛应用于油菜的基因功能研究和遗传改良,但是关于基因编辑技术的使用并非毫无限制。其使用的前提条件,一是需要对目标基因组有深入的了解,包括基因的功能和调控机制;二是需要严格的实验条件和操作规范,以确保基因编辑的准确性和安全性。
基因编辑技术并不是万能的,它同样具备一些限制因子:(1)细胞类型和组织的可编辑性。不同类型的细胞和组织基因编辑的可行性不同,有些细胞和组织基因编辑的效率较低;(2)基因编辑的准确性和安全性。基因编辑可能面临脱靶风险或其他不良影响,需要确保编辑的准确性和安全性;(3)道德和伦理问题。基因编辑涉及到生命和遗传信息的改变,需要考虑道德和伦理问题,以及相关的法律法规。

