冬小麦根际细菌多样性及其促生活性

摘 要:以分离自新疆冬小麦根际的36 株细菌为研究对象,通过16S rRNA 基因序列测定、系统进化分析研究其多样性,并检测其溶磷和固氮活性. 结果发现: (1)36 株菌分布于3 门5 纲11 目14 科14 属,其中α-变形菌门和放线菌纲为优势菌门(各占总菌株数的47.2%),红球菌为最主要的优势菌属(占总菌株数的36.1%),并有一个潜在的新物种;(2)以磷酸钙为底物,定性检测表明待测菌株中50.0% 具有溶磷活性,定量测定的5 株优选菌中菌株57 溶磷活性最高(11.5 mg/L);(3)66.7% 菌株具有固氮活性,其中45.8% 具有较强固氮活性.
关键词:冬小麦;根际细菌;多样性;促生活性
中图分类号:Q939.96
DOI: 10.19504/j.cnki.issn1671-5365.2024.06.17
植物根际促生菌(plant growth promoting rhizo⁃bacteria, PGPR)是一类生活在植物根系表面,能够促进植物吸收和利用养分、对危害宿主植物健康的病虫害具有抑制活性作用的有益微生物[1]. PGPR 可通过直接作用,如固氮、解磷、解钾,或产生植物生长调节物质,促进根系生长,提高对土壤中有效养分及水分的吸收效率[2]. PGPR 还可与植物有害菌竞争养分和生存空间、抑制病原菌生长,诱导植物对病原菌产生抗性[3]. 因此,开展植物根际促生菌资源的收集与挖掘,对开发植物促生菌剂、微生物肥料,实现土壤生态健康可持续化发展具有重要意义.
小麦是一种重要的禾本科粮食作物,在我国广泛种植. 近年来,与小麦根际促生菌的相关研究较多,如苜蓿根瘤菌对小麦茎长、茎重和根重有一定的促生作用[4],根际促生菌能诱导小麦苗期的抗旱性[5]、提高小麦产量[6]等作用. 然而,人们对地处欧亚大陆腹地新疆小麦根际促生菌的报道较少,相关认识有限. 新疆属干旱半干旱地区、温带大陆性荒漠气候,该区域农田土壤盐渍化和次生盐渍化较为严重[7]. 因此,收集和挖掘该区域特有的、能很好适应其特殊生态环境的植物根际促生菌,对干旱区农业绿色高效发展意义深远. 本研究拟以分离自新疆和田地区冬小麦根际、在含3% NaCl 培养基上正常生长的36 株细菌为研究对象,以16S rRNA 基因为标记对其进行鉴定,并检测其溶磷、固氮活性,以期为干旱区农业微生物资源收集与挖掘提供依据.
1 材料与方法
1.1 菌株
实验所用菌株分离自2019 年3 月中旬通过抖根法从新疆墨玉县加汗巴格乡冬小麦根际采集的土样. 分离纯化的菌株制备成20% 甘油细胞悬液,冻存于-80 ºC 超低温冰箱中.
1.2 仪器与设备
立式高压蒸汽灭菌器(LDZX-50L,上海申安);恒温培养箱(SPX-50,上海跃进医疗器械有限公司);恒温摇床(LYZ-100B,上海龙跃摇床);低速离心机(LC-LX-L60D,武汉力振科技有限责任公司);PCR 扩增仪(ABI-2720,天津金思德生物技术有限公司);分光光度计(UV1600A 型,尤尼科(上海)仪器有限公司).
1.3 方法
(1)菌株活化. 取适量甘油管保藏的菌种悬液,分别转接无机磷细菌培养基和解磷培养基上,置于30ºC 培养3 d,然后划线纯化.
(2)菌株的分子鉴定及系统进化树构建. 用EZ-10 柱式细菌基因组DNA 抽提试剂盒提取菌株基因组DNA,按说明书操作. 菌株16S rRNA 基因的PCR 扩增、序列测定、分析,及系统进化树的构建参考文献[8]进行.
(3)溶磷活性的定性检测. 参照标准NY/T1847-2010[9],采用平板透明圈法定性对菌株溶磷活性进行初测,用钼锑抗比色法定量测定优选菌株的溶磷活性.
(4)固氮活性检测. 将新鲜菌体接到无氮培养基平板上,在30ºC 恒温培养箱中培养5 d,连续传代5 次. 如果最后菌落生长良好,说明具有固氮能力.
2 结果与分析
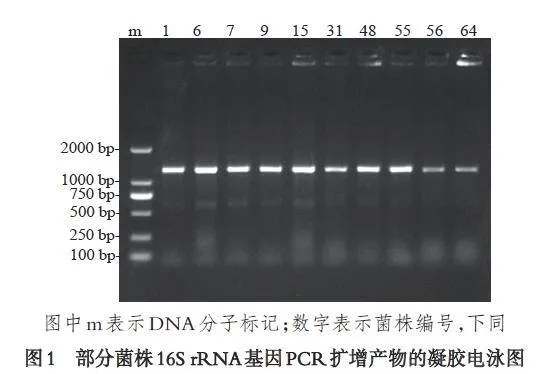
2.1 根际细菌16S rRNA 基因的扩增
在众多生物大分子中,16S rRNA 基因高度保守,是一种被公认最合适的研究细菌谱系进化的分子标记. 本研究采用通用引物扩增了小麦根际细菌的16S rRNA 基因,部分菌株的PCR 扩增结果见图1. 在标记菌株号的泳道中检测到一个大小约为1500 bp 的条带,与预期的16S rRNA 基因扩增产物的大小相符,表明扩增得到了目的基因. 得到的阳性PCR 产物送生工生物工程(上海)股份有限公司进行序列测定.
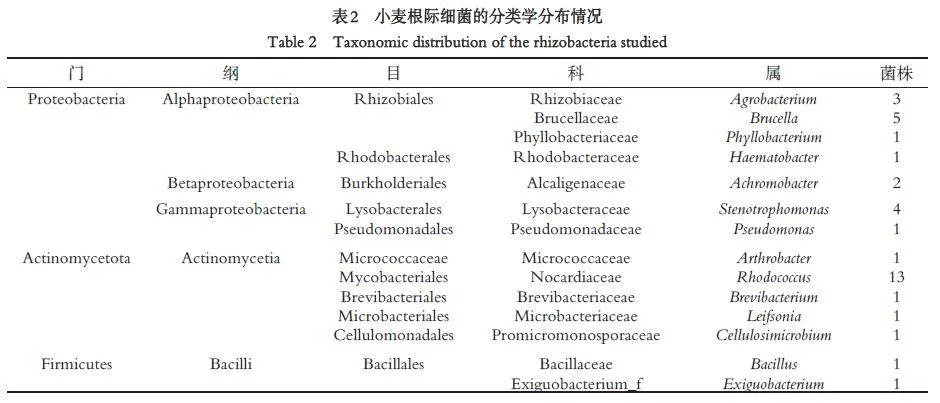
2.2 根际细菌物种的多样性
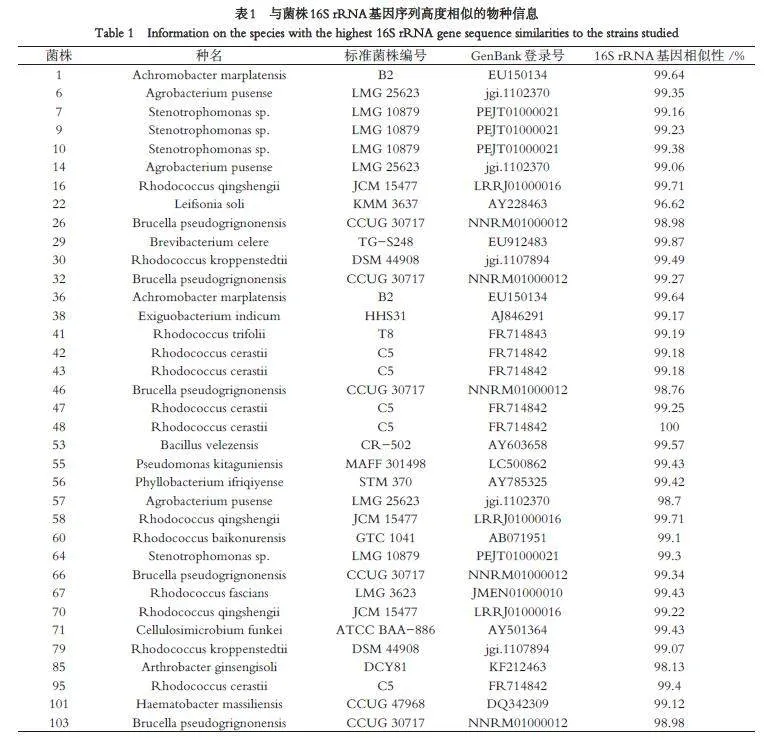
测序结果经质量判定后,提交到EzBioCloud 数据库和GenBank 数据库中进行Blast 搜索,下载与其相似性最高的相关序列,然后进行进化分析. 36 株菌与其16S rRNA 基因序列相似性最高的物种序列信息见表1.
对菌株分类信息进行统计,结果见表2. 36 株菌分布在3 个门、5 个纲、11 个目、14 个科和14 个属内.3 个菌门中,变形菌门(Proteobacteria)和放线菌门(Actinomycetota)为优势菌门,各占总菌株数的47.2%,厚壁菌门(Firmicutes)仅占5.6%. α-变形菌纲和放线菌纲为优势菌纲,红球菌(Rhodococcus)为最主要的优势菌属(占总菌株数的36.1%),其次为Brucella、Stenotrophomonas 和Agrobacterium.
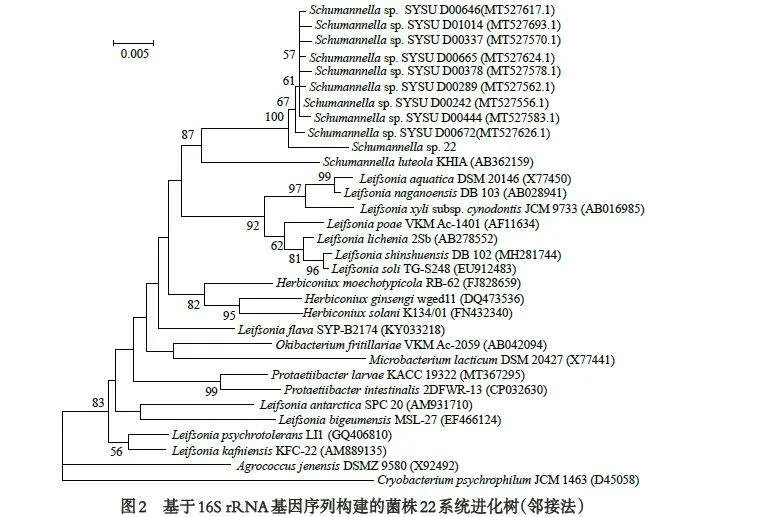
待测菌中35 株与已知物种的16S rRNA 基因序列相似性超过98.65%,根据Kim 等的观点[10],可将其归为对应的物种. 仅菌株22 与其亲缘关系最近物种的16S rRNA 基因序列相似性低于98.65%. 为准确地确定其分类学地位,用软件Mega 6.0 构建了邻接法系统进化树(图2).结果显示,菌株22 与Schumannela luteola KHIA 聚在一起,形成一个单独的进化枝,1 000 次重复抽样中出现这种情况的概率为87.0%;用最大似然法和最大简约法构建的系统进化树也同样支持上述观点. 这说明菌株22 与S. luteolaKHIA 亲缘关系最近,二者的16S rRNA 基因相似性低于98.65%[10],由此推测菌株22 可能为该属一个潜在的新种.
2.3 菌株溶磷能力
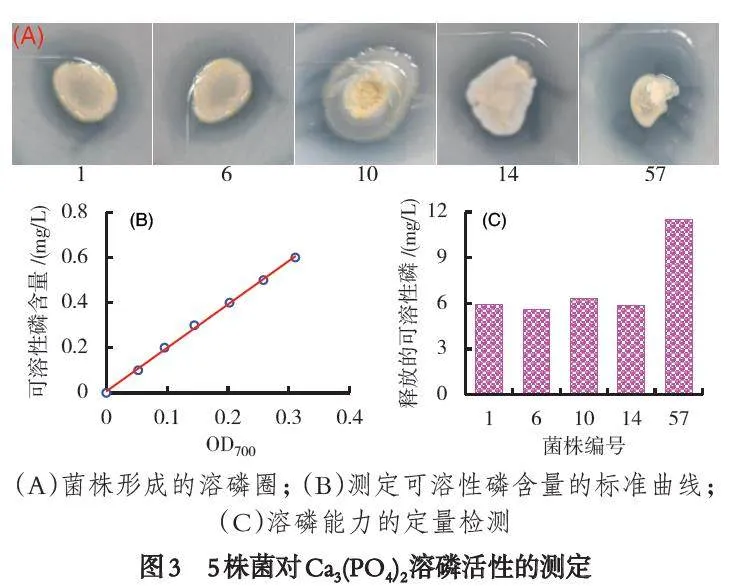
以磷酸钙为难溶性磷源,通过透明圈法定性测定了菌株的溶磷活性,结果显示50.0% 的菌株具有溶磷活性. 其中,菌株1、6、10、14 和57 形成较大的透明圈(图3),其水解圈与菌落直径的比值分别为1.6、1.6、1.5、1.6 和1.9. 在未优化溶磷条件的情况下,采用钼锑抗比色法定量测定了优选菌株的溶磷活性,结果菌株1、6、10 和14 溶磷活性约为6.0 mg/L,菌株57 的溶磷活性最高,为11.5 mg/L,如图3 所示.
2.4 菌株的固氮活性
在无氮培养基上连续转接5 代,结果显示,待测菌株中66.7% 具有固氮能力;菌株6、7、30、41、43、53、56、64、67、95 和101 在无氮培养基上生长良好.部分具有固氮活性的菌株同时具有较强的溶解磷酸钙活性(如表3).
3 讨论与结论
大量PGPR 栖息在植物根际,它们可促进宿主植物吸收营养、生长、抗逆和拮抗病原菌等[1-3],因此,这些资源的分离、多样性及功能等研究,对微生物肥料开发和农业绿色发展意义深远. 土壤中难溶性的无机磷约占总磷的35% ~ 70%,主要由Achromobacter、Aerobacter 和Agrobacterium 等13 个属细菌溶解循环[11]. 在本研究中,5 株优选的溶磷菌中有4株属Achromobacter 和Agrobacterium 菌属,很好地证明了Oleńska 的观点. Stenotrophomonas 属菌株具有促进植物吸收元素、产生吲哚乙酸类似生长调节剂、抑制病原菌或增强粮食作物抗逆性等促生属性[12]. 本文中属Stenotrophomonas 的菌株10 具有一定的溶磷活性(图3),佐证了该属具有促磷元素循环的生态功能.
由固氮菌驱动的生物固氮作用在农田生态系统中占有重要地位. 根据固氮菌与植物的关系,固氮菌可分为共生固氮菌( 如Rhizobium 和Bradyrbizobium)和自生固氮菌(如Azospirillum)[3]. 小麦为禾本科植物,缺少共生固氮菌,故此土壤中尤其是根际的自生固氮作用尤为重要. 本研究中未分离到上述3 个属的菌株,可能特殊的气候、土壤、地貌等非生物因素对固氮菌具有一定的环境选择作用.Kuhl 等基于基因组学技术研究了放线菌门的Rhodococcus qingshengii 和Rhodococcus erythropolis 耐胁迫及与植物互作的基因,并做了实验验证[13]. 本研究筛选到的11 株高固氮活性菌中5 株属Rhodococcus,这也很好地证明了小麦根际分布的Rhodococcus 具有植物促生活性.
最近,Youseif 等以宏基因组学结果为指导开展了小麦根际可培养细菌多样性研究,发现变形菌门、放线菌门、绿杆菌门、拟杆菌门和厚壁菌门是最丰富的门,21% 的可培养菌株表现出多种促生特性,包括磷的溶解活性和铁载体的产生[14]. 本研究在未优化分离方法的情况下,从小麦根际分离到变形菌门、放线菌门和厚壁菌门(图2),前2 个门为优势门,未分离到绿杆菌门、拟杆菌门菌株,说明根际细菌分布与土壤特征及所处生境相关;测定菌株中50.0% 具有一定的溶磷活性,66.7% 在无氮培养基上可以生长,表明大部分菌株同时具有这两种促生活性.
综上,本文围绕新疆冬小麦根际细菌开展了多样性及促生活性研究,可得到以下结论:新疆冬小麦根际细菌多样性极为丰富,优势菌门为变形菌门和放线菌门;大多数菌株具有溶磷或固氮活性,少数菌株同时具有溶磷和固氮活性. 后续,可开展促生机制、盆栽及应用研究,便于充分挖掘这些宝贵的根际促生菌资源.
参考文献:
[1] 穆文强, 康慎敏, 李平兰. 根际促生菌对植物的生长促进作用及机制研究进展[J]. 生命科学, 2022, 34(2): 118-127.
[2] GUPTA K, DUBEY N K, SINGH S P, et al. Plant Growth-Promoting Rhizobacteria (PGPR): Current and Future Pros⁃pects for Crop Improvement[M]//Yadav A N, Singh J, SinghC, et al. Current Trends in Microbial Biotechnology for Sus⁃tainable Agriculture. Singapore: Springer, 2021. doi:10.1007/978-981-15-6949-4_90.
[3] MOHANTY P, SINGH P K, CHAKRABORTY D, et al.Insight into the role of PGPR in sustainable agriculture andenvironment[J]. Frontiers in Sustainable Food Systems, 2021(5): 667150. doi:10.3389/fsufs.2021.667150.
[4] 赵慧云, 戚名扬, 党长喜, 等. 植物根围促生菌诱导小麦幼苗耐旱性的研究[J]. 云南农业大学学报( 自然科学版),2020, 35(1): 8-14.
[5] 李永斌, 李云龙, 关国华, 等. 植物根际促生菌的筛选、鉴定及其对小麦的减肥增产效果[J]. 农业生物技术学报: 2020,28(8): 1471-1476.
[6] 常慧萍, 邢文会, 夏铁骑, 等. 根际促生细菌的筛选及其对小麦幼苗的促生作用[J]. 河南农业科学, 2016, 45(12):52-57.
[7] 中国科学院新疆生态与地理研究所, 新疆维吾尔自治区水利厅农牧水利处. 新疆灌区土壤盐渍化及改良治理模式[M]. 乌鲁木齐: 新疆科学技术出版社, 2008.
[8] 张永光, 刘晴, 王宏飞, 等. 新疆阜康盐碱地可培养兼性嗜碱放线菌多样性及其酶活筛选[J]. 微生物学报, 2014, 54(2): 183-190.
[9] 中华人民共和国农业部. 微生物肥料生产菌株质量评价通用技术要求: NY/T 1847-2010[S]. 北京: 中国农业出版社,2010.
[10] KIM M, OH H S, PARK S C, et al. Towards a taxonomiccoherence between average nucleotide identity and 16SrRNA gene sequence similarity for species demarcation ofprokaryotes[J]. International Journal of Systematic and Evolu⁃tionary Microbiology. 2014, 64(2): 346-351. doi: 10.1099/ijs.0.064931-0.
[11] OLEŃSKA E, MAŁEK W, WÓJCIK M, et al. Beneficialfeatures of plant growth-promoting rhizobacteria for improv⁃ing plant growth and health in challenging conditions: A me⁃thodical review[J]. Science of The Total Environment, 2020(743): 140682. doi:10.1016/j.scitotenv.2020.140682.
[12] GHOSH R, CHATTERJEE S, MANDAL N C. Chapter 20 -Stenotrophomonas[M]//AMARESAN N, SENTHIL KUMARM, ANNAPURNA K, et al. Beneficial Microbes in Agro-Ecology: Bacteria and Fungi. Elsevier, 2020: 427-442. doi:10.1016/B978-0-12-823414-3.00020-4.
[13] KUHL T, CHOWDHURY S P, UHL J, et al. Genomebasedcharacterization of plant-associated Rhodococcus qing⁃shengii RL1 reveals stress tolerance and plant-microbe inter⁃action traits[J]. Frontiers in Microbiology, 2021(12): 708605.doi:10.3389/fmicb.2021.708605.
[14] YOUSEIF S H, EL-MEGEED F H A, HUMM E A, et al.Comparative analysis of the cultured and total bacterial com⁃munity in the wheat rhizosphere microbiome using culturedependentand culture-independent approaches[J]. Microbiol⁃ogy Spectrum. 2021, 9(2): e0067821. doi: 10.1128/Spec⁃trum.00678-21.s.
【编校:许洁】
基金项目:宜宾学院科学研究基金项目(2020YY01);中国科学院“西部之光”基金项目(2017-XBQNXZ-A-003);宜宾学院博士启动基金项目(2020QH04)

