UV-B 辐射对滇黄精幼苗生长、抗性生理及代谢物的影响
摘 要:为探究滇黄精幼苗对UV-B 辐射的生理响应机制,以两年生药用植物滇黄精为材料,在540 mw/cm2的UV-B 辐射强度下,以5 d 为一个周期,分别测定处理了0~25 d 后的滇黄精幼苗的生物量、抗氧化酶活性、MDA、类黄酮的含量. 结果表明:在UV-B 辐射下,滇黄精幼苗的株高与叶绿素含量呈下降趋势,并随着辐射时间延长,影响效果更明显,UV-B 辐射对POD、SOD 活性的影响呈升高趋势,在UV-B 辐射中期,相较于CK 显著升高. 对MDA 含量的影响呈现先升高后降低的趋势. 滇黄精叶片中类胡萝卜素含量及叶片和块茎中类黄酮含量也随着辐射时间的延长而增加. 因此,UV-B 辐射处理可抑制滇黄精幼苗的生长,使其抗氧化酶活性以及类黄酮含量显著增加,从而增强滇黄精对UV-B 辐射的抗性,对植株起到保护作用.
关键词:滇黄精;UV-B 辐射;生物量;抗氧化酶;类黄酮
中图分类号:Q945.78
DOI: 10.19504/j.cnki.issn1671-5365.2024.06.12
黄精(Polygonati Rhizoma)为百合科(Liliaceae)黄精属(Polygonatum Mill.)的多年生草本植物,是药食同源类的中药. 黄精中含有多糖、黄酮、甾体皂苷、挥发油、生物碱等多种活性成分[1],具有抗肿瘤、降血糖、提高骨密度、提高免疫力以及抗疲劳等功能[2].由于其独特的药用和食用价值,近年来相关保健产品开发也逐渐增多,深受中老年和体弱群体喜爱,具有巨大的研究价值和开发潜力.
由于目前市场上对黄精的需求量不断扩大,为满足市场的需求,不同品种的黄精部分实现人工栽培管理. 黄精生长偏好阴湿环境,腐殖土最佳,适于林下种植. 然而,受到栽培条件和成本的影响,绝大部分人工栽培环境均为全露天土地,仅有少量仿野生栽培地(林下,半遮阴).并且近年来由于人类大量排放人造有机卤化物化合物(特别是氯氟烃),使臭氧分子分解,致使臭氧层变薄甚至出现“臭氧空洞”,导致到达地面的太阳紫外线辐射增强[3-6].
大量研究表明,UV-B 辐射的增加会导致植物形态结构、生理活性和代谢产物发生变化. 植株通过增强UV-B 紫外辐射处理后表型会出现作物产量降低[3]、株高矮化[4],叶面积比减少[5]、厚度增加[6]以及叶片萎黄褐变等现象. 李元[7]发现,报春花的总叶绿素含量会随UV-B 辐射强度增加而降低. 辐射胁迫会使小麦叶片超氧化物歧化酶(SOD)活性先升后降,过氧化物酶(POD)活性上升[8]. 夏枯草中的有机酸及黄酮类成分含量在UV-B 处理后一定时间内呈增加趋势[9]. 但是,目前的相关研究主要集中在马铃薯[10]、水稻[11]等常见农作物,对药用植物(如黄精等)产生的影响研究较少.
因此,本实验以滇黄精幼苗为材料,通过人工模拟UV-B 辐射,测定与分析了其在一定强度UV-B辐射处理下黄精类黄酮、MDA、叶绿素含量及POD、SOD 酶活性的变化,探究黄精对UV-B 辐射胁迫的响应机制,为黄精等药用植物的抗逆性研究及栽培管理技术提供理论参考.
1 材料与方法
1.1 黄精育苗及实验设计
本研究中使用的材料为2 年生滇黄精幼苗,于2023 年3 月9 日栽种于本校临港校区后山农场进行栽培种植. 选择生长时间状况一致的幼苗,移入花盆(10×20 cm),每盆种植一株幼苗,待缓苗后进行室内UV-B 辐射处理. 本实验共设置两个处理:紫外(UV-B)和正常光照(CK),每个处理7 ~ 10 株滇黄精幼苗. 通过UV-B 灯管辐射处理,调整灯管与幼苗的距离,UV-B 灯管(功率15 W,深圳市锐普贸易有限公司生产)保持悬挂于幼苗顶端上方10 cm处,并且随着植株的生长灵活调整灯管与幼苗顶端的距离,保持照射距离不变. UV-B 强度平均为540μW·cm-2,处理时间为上午8:30-9:00,每天30 min.过程中使用手持式单通道UV-B 紫外辐照计(北京师范大学光电仪器厂)测定UV-B 辐射强度. 因属于室内实验,光照不充足,则使用红蓝补光灯(中山市灯饰厂)对植株进行补光,处理时间为早晨9:00-15:00,每天6 h. 以5 d 为一个周期,连续处理5 个周期,分别于处理第0、5、10、15、20 和25 d 后进行样品采集与各指标测定.
1.2 黄精苗期生物量测定
株高的测定使用卷尺测量植株从容器边界到植物茎顶部的高度;叶绿素和类胡萝卜素含量的测定参照张志良[12]的方法并稍作修改. 称取0.2 g 样品洗净剪碎置于研钵,加入少量石英砂、碳酸钙粉和2~3ml 95% 乙醇,研成匀浆,再加入10 ml 95% 乙醇,继续研磨至组织变白. 静置3~5 min,过滤后定容至25ml,采用分光光度计测定提取液在665、649 和470nm 下的分光光度值.
1.3 黄精苗期抗氧化酶活性测定
使用过氧化物酶活性检测试剂盒以及超氧化物歧化酶活性检测试剂盒(北京索莱宝科技有限公司,中国)对两种酶活性进行测定. 称取0.1 g 组织,加入1 mL 提取液,进行冰浴匀浆. 8 000 g 4℃离心10min,取上清,上清即为粗酶液,置冰上待测. 按照说明书处理待测粗酶液,SOD 粗酶液处理后,充分混匀,37℃水浴30 min 后,置于1 mL 玻璃比色皿测定560 nm 下的吸光度,POD 粗酶液处理后,立即混匀并计时,记录470 nm 下30 s 时的吸光值A1 和1 min30 s 后的吸光值A2. 以每分钟A470变化值表示POD酶活性大小. 根据试剂盒提供的计算方法测定抗氧化酶的活性.
1.4 黄精苗期类黄酮和MDA 含量测定
使用类黄酮含量检测试剂盒(北京索莱宝科技有限公司)进行类黄酮含量测定:将样本烘干至恒重,粉碎,过30-50 目筛之后,称取约0.1 g,加入1mL 提取液,用超声提取法进行提取,超声功率300W,温度60℃,提取30 min. 12 000 rpm,25℃,离心10 min,取上清,用提取液定容至1 mL,待测. 按照说明加入试剂后,涡旋混匀,置于37 ℃水浴锅/恒温培养箱中准确反应45 min,10 000 g,室温离心10min,取上清于470 nm 下测定吸光值. 根据试剂盒提供的计算方法测定类黄酮的含量.
使用丙二醇含量检测试剂盒(北京索莱宝科技有限公司)测定MDA 含量:称取约0.1g 组织,加入1mL 提取液进行冰浴匀浆;8 000 g 4℃离心10 min,取上清,置冰上待测. 按照说明书处理上清液,混合液在100℃水浴中保温60 min 后(盖紧,防止水分散失),置于冰浴中冷却,10 000 g,常温,离心10 min.测定样本在532 nm 和600 nm 处的吸光度. 根据试剂盒提供的计算方法测定丙二醇的含量.
1.5 数据分析
使用Excel 2019 对实验数据进行统计,使用IBM SPSS Statistics 20 对数据进行差异显著性分析,使用Origin 2023b 作图.
2 结果分析
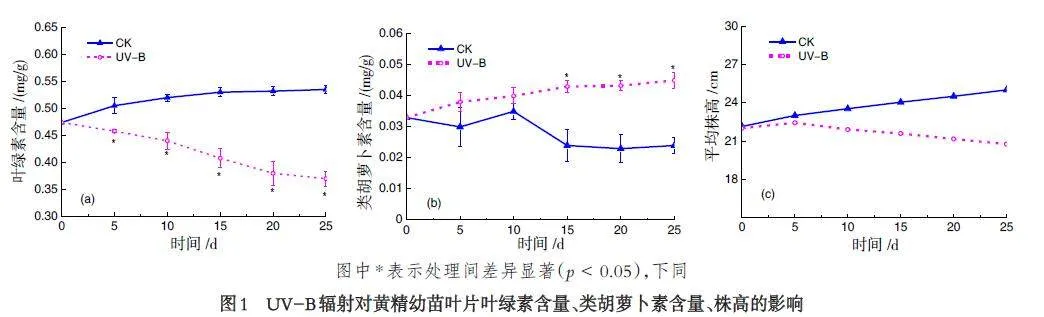
2.1 UV-B 辐射对滇黄精幼苗生物量的影响
UV-B 辐射处理的滇黄精幼苗平均株高在实验初期生长趋势与CK 相比较弱(如图1),但在光照实验5 d 后较CK 相比开始明显下降,在光照实验25 d后,平均株高比CK 组降低了17%. 并且,随着时间推移,CK 组叶绿素先呈现上升趋势后趋于稳定,而UV-B 处理组始终处于下降趋势,5d 后,显著低于对照组,在5~25 d,分别降低了9.3%、14.85%、23%、29.07% 和30.84%. 可以看出在10~15 d 下降最多,之后下降幅度减小,可能与类胡萝卜素含量的增加有关,类胡萝卜素的变化趋势与叶绿素较为不同,CK组类胡萝卜含量呈现先上升,10 d 后下降并趋于稳定,相较于CK 组,UV-B 辐射使类胡萝卜素含量增加,在15 d 后显著高于CK 组. 这表明UV-B 辐射会使植株矮化,且对叶绿素含量有降低作用,类胡萝卜素含量的增加可以增强植物的抗逆境能力.
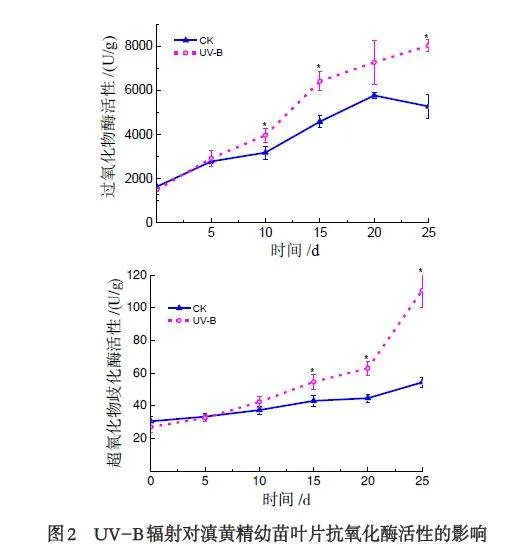
2.2 UV-B 辐射对滇黄精幼苗叶片抗氧化酶活性的影响
SOD 是一种抗氧化酶,能有效清除超氧阴离子自由基,普遍存在于植物体内,参与对逆境的生理生化反应. 由图2 可知,UV-B 处理组和CK 组的SOD活性均随生长时间的延长呈上升趋势,但在光照实验15 d 后,UV-B 辐射处理的滇黄精幼苗叶片SOD活性显著高于CK 组,在光照实验第25 d 时,UV-B辐射处理达到最高相较于CK,增加了103.50%.POD 是一类在植物体内能够将过氧化物转换为低毒或无害物质的抗氧化酶,由图2 可知,POD 活性变化趋势与SOD 类似,UV-B 辐射处理组在10、15 和25 d 均显著高于CK 组,分别增加了24.64%、39.91%和52.14%. 这表明UV-B 辐射可显著提高抗氧化酶的活性.
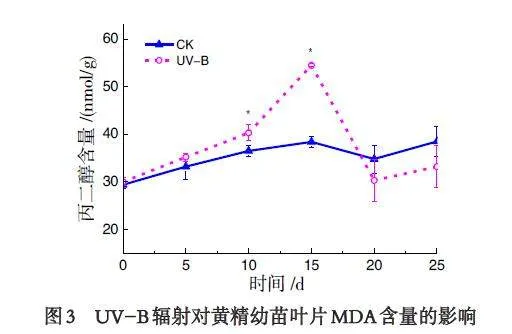
2.3 UV-B 辐射对滇黄精幼苗叶片MDA 含量的影响
植物遭受外界逆境胁迫的时候,细胞膜结构和功能会最先受到伤害,膜脂质过氧化反应是植物细胞膜受损的一个重要标志,MDA 含量的多少能直接反映细胞质膜过氧化水平. 由图3 可知,UV-B 处理组和CK 组滇黄精幼苗MDA 含量随时间增加逐渐升高,CK 组随时间缓慢增加后趋于稳定,在10~15d,UV-B 处理组显著高于对照组,在15 d 达到最高,较CK 相比,增加了42%,但15d 后急剧降低,20~25 d均低于对照组,分别低于12.96% 和13.68%.
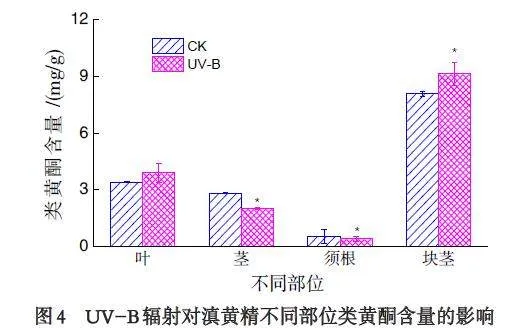
2.4 UV-B 辐射对滇黄精不同部位类黄酮含量的影响
由图4 可知,UV-B 辐射对滇黄精不同部位的类黄酮含量产生了不同的影响,UV-B 处理组的滇黄精叶片的类黄酮含量相较于CK 组,增加了14.7%,茎秆和须根的类黄酮含量显著低于CK 组,分别降低了29.58% 和23.47%;而块茎的类黄酮含量相较于CK 组,增加了12.90%,含量差异显著.
3 讨论
近年来,由于大量卤素化合物和氮氧化物对大气层造成了严重污染,从1970 年到2000 年以来检测发现地球的臭氧层在变薄. 变薄的臭氧层就会导致UV-B 辐射增加,特别是在高纬度地区其辐射指数更高. UV-B 辐射(280-315 nm)由于其光化学效应和潜在的破坏性影响了植物的正常生长和发育[5].已有研究表明,高纬度地区由于臭氧的消耗变薄,陆地植物中干物质积累量减少了近6%. 而生物量的变化代表了植物在生长过程中生理及生化上的变化,对衡量植物在遭受到逆境胁迫后的影响有重要意义[8]. 药用植物同其它植物一样易受外界环境条件的影响,从而使其生长及药用品质发生变化. 然而,在药用植物黄精中对UV-B 胁迫的响应机理等相关研究较少. 因此,本研究以滇黄精为材料进行了模拟UV-B 胁迫条件处理. 结果发现,经过UV-B 照射后黄精幼苗植株的生物量发生了显著变化. 与对照(CK)相比,UV-B 胁迫后,黄精幼苗的株高显著降低. 与前人研究结果相一致,韩雯[13]发现UV-B 辐射会抑制拟南芥植株的生长. 本实验也发现,在UV-B 辐射的影响下,滇黄精幼苗矮化且叶片萎黄,随辐射时间的延长,该现象愈发明显. 这些结果表明,在UV-B 胁迫的过程中,植物的叶绿素(光合色素)含量发生了改变.
叶绿素是绿色植物进行光合作用,以合成糖类等碳水化合物的重要成分. 多糖是黄精中含量最高的一类药用活性成分,由小分子糖聚合而成. 因此,黄精植株的光合作用强度和效率可能会影响多糖成分的积累. 本试验结果表明,在经过UV-B 辐射后,黄精叶片中的叶绿素含量显著低于CK,这与高晓玲[14]研究发现,增强的紫外B 辐射会显著降低花生幼苗光合色素含量和净光合速率的结果一致. 分析其原因可能是UV-B 辐射破坏了植物叶绿素的代谢调节所致[15]. 然而,在UV-B 辐射处理后,类胡萝卜素呈上升趋势,这与王园[9]研究夏枯草幼苗在不同强度UV-B 辐射下类胡萝卜素均有显著增加的结果一致,但与石新新[16]研究高粱幼苗在UV-B 辐射下胡萝卜素含量下降的结果不一致,这可能与植物本身的差异性有关. 并且在15 d 之后,类胡萝卜素较CK 比呈显著上升,叶片叶绿素下降幅度减小,可能是因为植株在受到UV-B 照射后,启动了生理防御机制[17],增加类胡萝卜素来保护叶绿素. 由此推测,在本实验结果中由于UV-B 辐射抑制了滇黄精幼苗的生长且使得叶绿素含量显著降低,不利于光合作用的进行,甚至可能会影响黄精多糖的积累从而降低其药用品质.
植物的生物膜透性易受到逆境的影响而改变,植物的抗逆性也与之有紧密联系[16]. 膜脂过氧化会产生大量的MDA,可以根据MDA 的含量鉴定植物细胞膜结构受破坏程度,植物体内的MDA 含量高说明细胞正处于胁迫状态. 本试验中,UV-B 辐射处理10 d 后,MDA 含量相较于CK 显著增加,与刘茜等[18]的研究一致,但在15 d 达到最高且开始下降,20~25 d 低于CK,与阮文晓[19]对多肉植物研究结果一致,可能是因为在15 d 后,滇黄精提高了对于环境辐射胁迫的应对能力.
通常植物的抗逆能力也与体内的抗氧化酶活性密切相关. 在逆境下植物体内的抗氧化酶类与其它酶类相互协调,能有效地清除代谢过程产生的自由基,从而减轻植物细胞的胁迫影响,是植物抵抗逆境的重要防御机制之一. 刘敏[20]研究发现,UV-B 处理的烟草幼苗中SOD 活性显著增加,王红等[21]研究发现,96 kJ·(m-2·d-1) UV-B 处理的芒果叶片中POD 活性随处理时间不断升高,并且始终显著高于自然光处理组,与本试验结果相符,本试验供试的滇黄精幼苗在UV-B 辐射下,POD 与SOD 活性相较于CK,分别在10 d 和15 d 起显著增加,表明在UV-B 辐射照射下黄精幼苗体内抗氧化酶SOD、POD 活性提高,以适应UV-B 对其产生的胁迫.
类黄酮是植物抵御UV-B 辐射的一种有效物质,也是黄精的药用活性成分之一. 在本试验中,UV-B 辐射处理25 d 后,滇黄精幼苗的叶片和块茎类黄酮含量高于CK,且块茎与CK 的差异显著. 这一结果与李玟[22]研究的结果一致,紫外(UV-B)补光处理22 d 后的茄子幼苗叶片类黄酮含量比不补光处理组有显著升高. 但滇黄精幼苗的茎和须根中的黄酮含量在辐射处理后却显著低于CK,与莫运才等[17]对铁皮石斛的研究结果类似. 可能原因是滇黄精不同部位对UV-B 辐射的承受阈值不同,在UV-B 辐射下,滇黄精的类黄酮含量增加以抵御辐射伤害,但随着辐射时间延长,导致茎和须根先达到了承受阈值,造成了不可逆的伤害,导致了类黄酮降解加速而合成困难,具体原因有待进一步研究.
综上所述,本研究通过人工模拟UV-B 辐射,探究黄精幼苗对UV-B 辐射胁迫的响应机制. 整合试验结果并分析发现,在UV-B 辐射下,黄精幼苗的株高与叶绿素含量呈下降趋势,并随着辐射时间延长,影响效果更明显. UV-B 辐射对POD 和SOD 活性的影响呈升高趋势. 且在辐射中期,相较于CK 显著升高. UV-B 辐射对MDA 含量的影响呈现先升高后降低的趋势. 然而,UV-B 辐射对类黄酮含量的影响于黄精不同部位却呈现相反的结果. 叶片中类胡萝卜素含量以及叶片、块茎类黄酮含量的增加可以帮助黄精幼苗抵抗UV-B 辐射造成的伤害. 本实验揭示了滇黄精对UV-B 辐射胁迫的响应机制,对黄精幼苗的栽培管理技术提供一定依据.
参考文献:
[1] 张泽锐, 黄申, 刘京晶, 等. 多花黄精和长梗黄精花主要营养功效成分[J]. 中国中药杂志, 2020, 45(6): 1329-1333.
[2] 于纯淼, 刘宁, 宫铭海, 等. 黄精药理作用研究进展及在保健食品领域的应用开发[J]. 黑龙江科学, 2019, 10(18):66-68.
[3] ALBERT K R, MIKKELSEN T N, RO-POULSEN H.Ambient UV-B radiation decreases photosynthesis in high arctic Vaccinium uliginosum[J]. Physiologia Plantarum, 2008,133(2): 199-210. doi:10.1111/j.1399-3054.2008.01065.x.
[4] 李元, 王勋陵. 紫外辐射增加对春小麦生理、产量和品质的影响[J]. 环境科学学报, 1998, 18(5): 504-509.
[5] KATARIA S, GURUPRASAD K N. Intraspecific variations in growth, yield and photosynthesis of sorghum varieties to ambient UV (280-400 nm) radiation[J]. Plant Science, 2012,196: 85-92. doi:10.1016/j.plantsci.2012.07.011.
[6] 安黎哲, 冯虎元, 王勋陵. 增强的紫外线-B 辐射对几种作物和品种生长的影响[J]. 生态学报, 2001,21(2): 249-253.
[7] 李元, 祖艳群, 高召华, 等. UV-B 辐射对报春花的生理生化效应[J]. 西北植物学报, 2006, 26(1): 179-182.
[8] QIU Z B, ZHU X J, LI F M, et al. The optical effect of a semiconductor laser on protecting wheat from UV-B radia⁃tion damage. Photochemical amp; Photobiological Sciences,2007, 6(7): 788-793. doi:10.1039/b618131g.
[9] 王园, 党悦方, 张典, 等. 夏枯草幼苗中有效成分与生理指标对增强UV-B 辐射的动态响应[J]. 西北大学学报(自然科学版), 2017, 47 (3): 414-421.
[10] 崔玲艳, 王琼, 徐笑宇, 等. 马铃薯对UV-B 辐射增强的生理生化响应[J]. 山西农业大学学报(自然科学版), 2022, 42(5): 93-101.
[11] 战莘晔, 吕晓, 金丹丹, 等. UV-B 辐射增强对粳稻营养生长时期叶片光合特性的影响[J]. 农业环境科学学报, 2020,39(11): 2515-2523.
[12] 张学良. 植物生理学实验指导[M]. 第三版. 北京: 北京高等教育出版社, 1990.
[13] 韩雯, 韩榕. 不同时间的UV-B 辐射对拟南芥幼苗生长的影响[J]. 植物学报, 2015, 50(1): 40-46.
[14] 高晓玲, 何应森, 徐晓燕. 激光与增强的紫外B 辐射对花生幼苗光合作用的影响[J]. 贵州农业科学, 2013, 41(7):36-38.
[15] 张文会, 张朋, 刘立科, 等. 紫外线B 辐射增强对大豆生长及光合作用相关指标的影响[J]. 大豆科学, 2009, 28(2):229-232.
[16] 石新新, 李佐同, 杨克军, 等. 增强的UV-B 辐射对高粱幼苗光合和抗氧化系统的影响[J]. 光谱学与光谱分析, 2016,36(5): 1389-1395.
[17] 莫运才, 曾令杰, 黄涵, 等. UV-B 辐射对铁皮石斛叶片光合色素、类黄酮及PAL 酶活性的影响[J]. 贵州农业科学,2015, 43(7): 34-37.
[18] 刘茜, 刘博文, 王洋, 等. UV-B 辐射对不同生态型垂穗披碱草幼苗生长和抗氧化酶系统的影响[J]. 草地学报, 2019,27(4): 898-905.
[19] 阮文晓, 傅敏杰, 朱月清, 等. UV-B 多光谱补光对多肉植物观赏特性与理化性质的影响[J]. 河南农业科学, 2022, 51(6): 126-133.
[20] 刘敏, 李荣贵, 范海, 等. UV-B 辐射对烟草光合色素和几种酶的影响[J]. 西北植物学报, 2007, 27(2): 291-296.
[21] 王红, 岳堃, 郭钰柬等. UV-B 辐射诱导芒果叶片抗氧化响应研究[J]. 热带亚热带植物学报, 2020, 28(1): 70-77.
[22] 李玟, 傅敏杰, 方月, 等. 新型UV-B 补光灯对茄子幼苗生长、抗性生理及抗病性的影响[J]. 中国蔬菜, 2022(5):60-67.
【编校:许洁】
基金项目:四川省自然科学基金项目(2023NSFSC1268);宜宾学院高层次人才“启航”计划项目(2022QH07)

