环糊精对动脉粥样硬化ApoE-/-小鼠血管功能的影响
柯永鑫 林立建
(福州市长乐区医院心血管内科,福建 福州 350005)
随着我国人口的老龄化,动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的发病率和死亡率逐年攀升。脂质代谢改变、炎症反应和氧化应激被认为是动脉粥样硬化的主要发病机制[1]。控制甚至逆转动脉粥样硬化斑块的进展,对于防治ASCVD具有重大的意义。环糊精是一种天然的由葡萄糖分子组成的环状淀粉类物质,可在水溶液中形成环状的空腔结构。研究发现,环糊精能够与血液中的胆固醇和脂类相结合,形成水溶性的复合物,从而减少动脉壁的脂质物质的沉积,可能对动脉粥样硬化的防治具有一定的潜在益处[2]。本研究拟通过高脂诱导的载脂蛋白E基因敲除(apolipoprotein E knockout,ApoE-/-)小鼠构建动脉粥样硬化模型,采用皮下注射环糊精,观察其对ApoE-/-小鼠胸主动脉结构及内膜斑块面积、血清胆固醇以及血管功能的影响,并探讨其可能机制。
1 材料与方法
1.1 实验动物和主要试剂 ApoE-/-小鼠,C57BL/6小鼠(体重20~22 g,SPF级,许可证号:SYXK(京)2019-0022),羟丙基-β-环糊精(HP-β-CD,美国MCE公司),乙酰胆碱(Ach),去甲肾上腺素(NE),硝普纳(SNP),RIPA蛋白裂解液、NO检测试剂盒、MDA检测试剂盒,小鼠IL-6检测试剂盒(云克隆),Tris-base缓冲液,聚偏二氟乙烯(PVDF)膜(德国Millipore公司),NFκB p65抗体、p66Shc抗体、p-p66Shc抗体、内皮型一氧化氮合酶(eNOS)抗体(美国CST公司),β-actin单克隆抗体和免疫印迹化学发光试剂。
1.2 实验动物和分组方案 选取20只8周龄雄性小鼠做基因敲除,并被随机分为2组:ApoE-/-组+安慰剂(安慰剂组)、ApoE-/-+环糊精2 g/kg(环糊精组),每组10只。饲养条件:室温(22±2)℃,人工光照明每天12 h,高脂饲料(在标准饲料配方中添加1%胆固醇,0.5%胆酸钠,10%蛋黄粉、10%猪油)。自由饮水。另外选取10只8周龄雄性C57BL/6小鼠作为对照组,自由取食饮水。将HP-β-CD溶于生理盐水中,每周皮下注射2次,连续12周,其他两组小鼠均予注射等量生理盐水。
1.3 苏木素-伊红染色(Hematoxylin-Eosin staining,HE染色)用10%水合氯醛腹腔注射麻醉大鼠,将其仰卧于手术台上,暴露腹主动脉,腹主动脉抽血处死动物,立即行腹主动脉插管,用0.1 mg/mL硝普钠充分扩张血管后,用加入伊红的10%甲醛溶液在60 cm H2O~80 cm H2O柱压下灌注固定血管6 h~12 h。取小鼠降主动脉0.5 cm,PBS漂洗1~2 min,于10%福尔马林浸泡24 h后自来水冲洗5~10 min,酒精梯度脱水、二甲苯透明、石蜡包埋、切片、HE染色,封片,显微镜下观察拍照,采用自动成像软件系统(Image5.0)分析并计算胸主动脉内膜斑块面积。
1.4 小鼠血清样本制备 采用摘眼球法约取0.5 ml小鼠全血于1.5 ml的EP管中,在室温下静置10 min;离心10 min,取上清液在离心管中备用。
1.5 胸主动脉血管环试验 采用Powerlab多导生理记录仪采集处理系统(ADInstruments,Australia),取胸主动脉放入4 ℃饱和氧 Kreb’s液中,在解剖镜下分离出动脉周围组织,显微剪剪取3 mm血管环,挂钩,连接张力换能器,调前负荷至0.5 g,加37℃Kreb's液5 ml并通入95% O2和5% CO2混合气体;血管平衡20 min,通过PowerLab多导生理仪测血管环对Ach(10-9~10-5mmol/L)和硝普纳(10-9~10-5mmol/L)的舒张反应。血管舒张效应=该血管舒张张力绝对值/ NE(10-5mmol/L)诱导血管收缩张力绝对值×100%表示,用Probit法计算半数最大效应浓度(EC50),舒张反应敏感性采用pD2值表示(pD2表示产生产生半数最大效应的摩尔浓度的负对数)。
1.6 小鼠血脂水平的测定 使用全自动血清生化分析仪测定各组小鼠的血脂水平,包括总胆固醇(TC)水平、甘油三酯(TG)水平、低密度脂蛋白胆固醇(LDL-C)水平和高密度脂蛋白胆固醇(HDL-C)水平等。
1.7 硫代巴比妥酸(TBA)法测血清丙二醛(MDA)水平 根据试剂盒说明书准备测量试剂,吸取0.6 ml试剂1加入0.2 ml样本血清混匀;90 ℃水浴30 min,10000 g室温离心10 min,取上清液,测定样品在532 nm和600 nm下的吸光度(A532,A600),按试剂盒上的说明进行MDA含量的计算:MDA含量(nmol/mL)=[(A532-A600)×V反总÷(ε×d)×109]÷V样本=25.8×(A532-A600)[6]。
V反总:反应体系总体积;ε:MDA 摩尔吸光系数;V样本:加入样本体积;d:比色皿光径。
1.8 酶联免疫吸附法(ELISA)测血清炎症因子IL-6水平 应用ELISA法测血清中IL-6水平。根据ELISA试剂盒说明书步骤进行测定。用酶标仪(Thermo,USA)测定IL-6在450 nm处的吸光度。
1.9 硝酸还原酶法测血清NO含量 运用硝酸盐还原酶将硝酸盐还原成亚硝酸盐,通过Griess试剂检测亚硝酸盐,测定总一氧化氮的含量。遵循试剂盒说明书中的步骤进行测定,使用酶标仪(Thermo,USA)测定一氧化氮在540 nm处的吸光度。
1.10 蛋白提取和免疫印迹法测定蛋白的氧化水平 选取ApoE-/-小鼠胸主动脉(隔肌上)长约1 cm,剥去血管外膜组织,用PBS漂洗1~2次,加0.5 ml RIPA裂解缓冲液匀浆,根据等体积 2×SDS上样缓冲液,震荡15 s,在放入100℃水浴煮10 min,12000 g 4℃离心10 min,静置后取上清-80℃保存备用。对蛋白进行聚丙烯酰胺凝胶电泳,再转膜和封闭,加入一抗Total-p66Shc、p-p66Shc、NF-κB-P65、eNOS 抗体(1:1000)、β-actin(1:2000),二抗(1:5000)孵育、显影,采用β-actin作为内参照,蛋白表达水平采用目的蛋白/β-actin的比值。测定各组小鼠胸主动脉促氧化衔接蛋白(p66Shc)磷酸化水平。
1.11 统计学方法 统计处理试验数据时,采用SPSS 19.0软件进行分析,实验计量数据结果以表示。针对单一因素多个组的比较采用单向方差分析(one-way ANOVA),而两两比较则使用最小显著性差异(least significant difference,LSD)法。显著性水平设定为P<0.05,表明存在统计学上差异。
2 结果
2.1 环糊精抑制ApoE-/-小鼠胸主动脉内膜粥样斑块的形成 病理结果显示,对照组小鼠的胸主动脉内膜表现为平滑,无增厚,内皮细胞连续性良好且完整,中膜肌层的厚度均匀,平滑肌层的细胞排列整齐;安慰剂组小鼠的胸主动脉内膜出现增厚和斑块形成,内皮细胞连续性中断,中膜肌层的厚度不均匀且平滑肌层的细胞排列不规则;环糊精组小鼠的胸主动脉内膜相对光滑,内膜连续性相对较好且相对完整,中膜肌层的厚度相对均匀,平滑肌层的细胞排列规则。
斑块面积及血管中膜厚度分析显示:与对照组(无斑块)相比,安慰剂组胸主动脉内膜斑块面积(205.48±23.61)µm2显著增加;与安慰剂组相比,环糊精组胸主动脉内膜斑块面积显著减小[(78.06±9.03)μm2vs.(205.48±23.61)μm2,P<0.01](图1)。
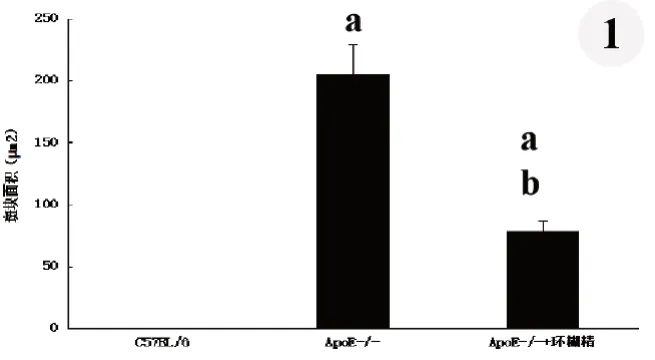
图1 三组小鼠胸主动脉内膜粥样面积的比较
2.2 环糊精对高脂诱导的ApoE-/-小鼠血脂水平的影响 与对照组相比,安慰剂组和环湖精组小鼠空腹血TG、TC、LDL-C水平均增加(P<0.01);与安慰剂组相比,环糊精组血TG、TC、LDL-C水平降低,环糊精可降低高脂喂养ApoE-/-小鼠的血脂水平(P<0.01);但HDL-C水平在三组间均无统计学差异(P>0.05)(表1)。
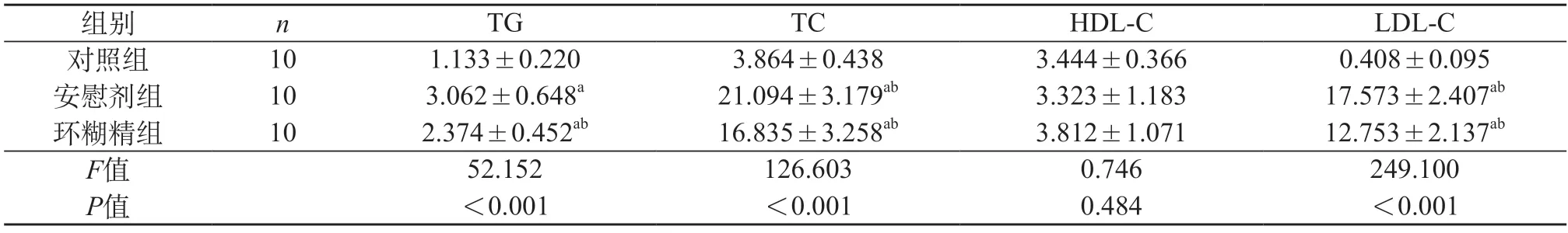
表1 三组小鼠血脂水平的比较(mmol/L)
2.3 环糊精对ApoE-/-小鼠胸主动脉舒张功能的影响 与对照组相比,安慰剂组小鼠胸主动脉内皮依赖性(Ach介导)与非内皮依赖性(SNP介导)的舒张作用降低,当Ach为10-7mol/L,SNP为10-7mol/L时,安慰剂组舒张功能pD2值较对照组均显著降低(Ach:10.187±1.162vs.74.254±0.481,t=19.647,P=0.000;SNP:22.543±2.712vs.43.248±5.556,t=10.622,P=0.000);与安慰剂组相比,环糊精组胸主动脉内皮依赖性及非内皮依赖性舒张功能(pD2值)均明显增高(Ach:7.286±0.432vs.6.147±0.285,t=6.949,P<0.001;SNP:8.453±0.456vs.6.864±0.483,t=7.570,P<0.001(图2)。
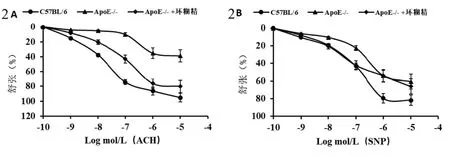
图2 环糊精对ApoE-/-小鼠胸主动脉舒张功能的影响
2.4 环糊精对ApoE-/-小鼠血清MDA、IL-6及NO水平的影响 与对照组相比,安慰剂组小鼠血清MDA、IL-6水平均升高(P<0.01),NO水平降低(P<0.01);与安慰剂组相比,环糊精组小鼠血清MDA及IL-6均降低(P<0.01),NO水平均升高(P<0.01)(表2)。
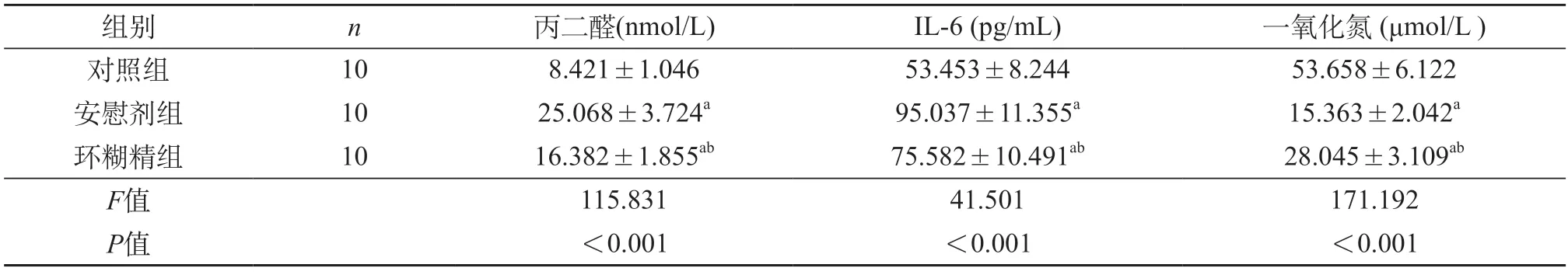
表2 环糊精对ApoE-/-小鼠血清丙二醛、IL-6及一氧化氮水平的影响
2.5 环糊精对ApoE-/-小鼠胸主动脉促氧化衔接蛋白(p66Shc)磷酸化水平的影响 与对照组相比,安慰剂组小鼠胸主动脉促氧化衔接蛋白磷酸化水平增加(P<0.01);与安慰剂组相比,环糊精组小鼠胸主动脉促氧化衔接蛋白磷酸化水平降低(P<0.01),提示环糊精可抑制ApoE-/-小鼠胸主动脉促氧化衔接蛋白磷酸化水平(图3)。
2.6 环糊精对ApoE-/-小鼠胸主动脉NF-κB p65及eNOS表达水平的影响 与对照组相比,安慰剂组小鼠胸主动脉NF-κB p65蛋白表达水平明显增加(P<0.01),eNOS蛋白表达水平明显降低(P<0.01);与安慰剂组相比,环糊精组小鼠胸主动脉NF-κB p65蛋白表达水平明显降低(P<0.01),而eNOS蛋白表达水平明显增加(P<0.01)(图4)。
3 讨论
高脂诱导的ApoE-/-小鼠作为动脉粥样硬化的经典模型,已广泛用于高脂血症、动脉粥样硬化的研究中[3]。本研究采用高脂诱导ApoE-/-小鼠成功建立动脉粥样硬化模型。安慰剂组小鼠血清TG、TC、LDL-C水平升高。此外,ApoE-/-小鼠内皮依赖性和非依赖性的血管功能下降。
环糊精是由D-吡喃葡萄糖单体通过α-1,4-糖苷键相互连接而成的一类环状化合物,环糊精内腔疏水而外腔亲水,具备剔除脂蛋白复合分子中或活细胞表面脂质分子的能力。近年来环糊精在动物模型中对动脉粥样硬化的治疗作用已被大量研究所证实[4]。本研究结果显示,环糊精组ApoE-/-小鼠血清TC、TG、LDL-C水平显著降低,胸主动脉内膜斑块面积及血管中膜厚度减小,内皮依赖性和非依赖性血管功能显著改善;环糊精可增加巨噬细胞和动脉粥样硬化斑块中氧化型低密度脂蛋白胆固醇的表达,增强胆固醇外流和抗炎作用,抑制动脉粥样斑块的病程进展[5]。
氧化应激在动脉粥样硬化中起到至关重要因素,环糊精具有抗氧化作用,从而抑制氧化损伤动脉壁[6]。本研究中,环糊精改善血管功能可能与其改善血脂水平、减轻血管炎症反应、抑制氧化应激等因素有关。Xiao等[7]研究显示p66Shc介导的线粒体氧化应激损伤血管内皮功能。p66Shc是Shc蛋白家族成员之一,可表达于内皮细胞。在氧化应激条件下,Jun氨基末端激酶(JNK)、蛋白激酶Cβ和P53等激活,促进线粒体产生活性氧,并且66Shc缺失抑制动脉粥样斑块形成,其机制与p66Shc的氧化还原功能有关[8]。ox-LDL通过NADPH氧化酶产生活性氧,进而激活PKCβ和JNK,促进p66Shc磷酸化,进一步促进活性氧生成。ox-LDL亦通过p66Shc启动子去甲基化,促进p66Shc转录及活性氧生成,导致内皮功能障碍。与上述研究一致,本研究发现,相比对照组,安慰剂组胸主动脉p-p66Shc水平显著上调,MDA水平升高,SOD活性下降,导致血管内皮功能障碍;环糊精可能通过降低p-p66Shc介导的线粒体氧化应激,上调eNOS的表达水平,改善动脉粥样硬化小鼠的血管功能[9]。炎症通路在动脉粥样硬化发病过程中起重要作用,NF-κB作为炎症通路的关键成员,其激活可导致eNOS表达下降,引起血管内皮功能障碍[10]。本研究结果显示安慰剂组小鼠NF-κB p65蛋白表达水平显著增加,IL-1β及IL-6水平升高,eNOS表达水平显著下降;与安慰剂组相比,环糊精组小鼠NFκB p65蛋白、IL-1β及IL-6水平降低,eNOS表达水平升高。
综上所述,基于环糊精在动物实验中环糊精能够降低血脂水平、减少动脉粥样硬化面积、改善血管舒张功能等优势。因此,环糊精有望作为动脉粥样硬化的潜在治疗药物。

