蓝色刺孢霉QY229产天然蓝色素液态发酵条件的优化
黄露文,朱丽萍,颜世敢
齐鲁工业大学(山东省科学院) 生物工程学部,山东 济南 250353
食用色素可以根据来源不同,分成天然色素和人工合成色素两大类[1]。在以往的研究中,天然色素已经被证明具有良好的着色性能和促进健康的作用,但运用于工业生产仍然存在着成本较高、来源有限等挑战[2]。近年来,合成色素在食品工业中被广泛应用,但所有的人工合成色素几乎都不是营养物质,部分甚至有致癌危险。因此,天然色素再次回归大众的视野[3]。在天然色素中,天然蓝色素出现的频率远低于红色、绿色或黑色[4]。目前市面上所使用的蓝色素,例如常被用来装点食物的辉煌蓝(FD&C Blue No.1)和靛青(FD&C Blue No.2)大多是由人工合成[5]。虽然在一定程度上这些人造蓝色素被认为是安全的,但消费者无疑更喜欢天然的东西[6]。因此,从自然界中分离出稀有的天然蓝色素,并找到大规模的生产方法具有重要的现实意义和巨大的市场前景[7]。
大多数天然色素是从植物组织中提取,但考虑到工业应用,这类原材料的获取将受到众多自然因素的制约[8]。近年来,利用微生物发酵代谢的方式获取天然色素受到了广泛关注[9]。然而,目前所研究的产色素的菌种中只有极少数能够产生蓝色素,所以开发新的生产蓝色素的菌种是当今市场的一个主要需求[10]。本研究采用由实验室保藏的蓝色刺孢霉菌株在液态摇瓶培养条件下生产蓝色素,并对其发酵培养基及发酵条件进行系统优化,旨在为天然蓝色素的规模化生产奠定基础。
1 材料与方法
1.1 材料与试剂
实验所采用的蓝色刺孢霉QY229为本实验室保藏菌株;碳源(葡萄糖、蔗糖、麦芽糖、乳糖、淀粉和果糖)、氮源(蛋白胨、硝酸铵、硫酸铵、酵母膏、牛肉膏和硝酸钠)、琼脂粉、无机盐等试剂均购自国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 微生物培养方法
斜面培养基采用马铃薯葡萄糖琼脂培养基(PDA);种子培养基:40 g/L葡萄糖、20 g/L蛋白胨、1.0 g/L NaCl、1.0 g/L MgSO4、1.0 g/L KH2PO4、pH为5.5~6.0。初始发酵培养基:60 g/L葡萄糖、30 g/L蛋白胨、1.0 g/L NaCl、1.0 g/L MgSO4、1.0 g/L KH2PO4、pH为5.5~6.0。
取蓝色刺孢霉QY229划线接种到PDA斜面培养基,35 ℃下恒温培养5~7 d。吸取5 mL无菌水反复冲洗斜面制备孢子悬浮液,并将其添加到30 mL的种子培养基中(250 mL锥形瓶),于32 ℃恒温培养振荡器(150 r/min)上培养48 h,获得种子培养液。最后,以体积分数5%的接种量将种子培养液转移到100 mL的发酵培养基中(250 mL锥形瓶),6层纱布封口,在32 ℃的恒温培养振荡器(180 r/min)上培养6 d,获得含蓝色素的发酵液。
1.2.2 发酵液的预处理与色价测定方法
收集含蓝色素的发酵液于4 ℃下离心20 min(6 000×g),弃去沉淀,上清液用蒸馏水定容至原发酵液体积。
参照已报道的方法进行发酵液色价的测定[11]。每毫升含蓝色素的发酵上清液,稀释合适倍数后,在pH为9,于580 nm下测定吸光度,吸光度值为0.1时相当于1个色素效价相对单位(U/mL),蓝色素发酵液色价计算公式如下:
色价=总稀释倍数×OD_580 nm。 (1)
1.2.3 单因素试验设计
以初始发酵培养基成分为基础,添加不同种类的碳源(乳糖、蔗糖、葡萄糖、可溶性淀粉、麦芽糖、果糖)和氮源(硝酸铵、硫酸铵、酵母膏、蛋白胨、硝酸钠、牛肉膏),检测其对蓝色刺孢霉产蓝色素的影响。
1.2.4 Plackett-Burman试验设计
在单因素试验结果的基础上,选取葡萄糖质量浓度、蛋白胨质量浓度、温度、装瓶量、时间、接种量、初始pH、转速、种龄9种因素作为考察对象,以发酵液色价(Y)为响应值,通过Design-Expert 8.0软件中Plackett-Burman筛选影响发酵液色价的显著性因素。各因素试验设计水平如表1所示。
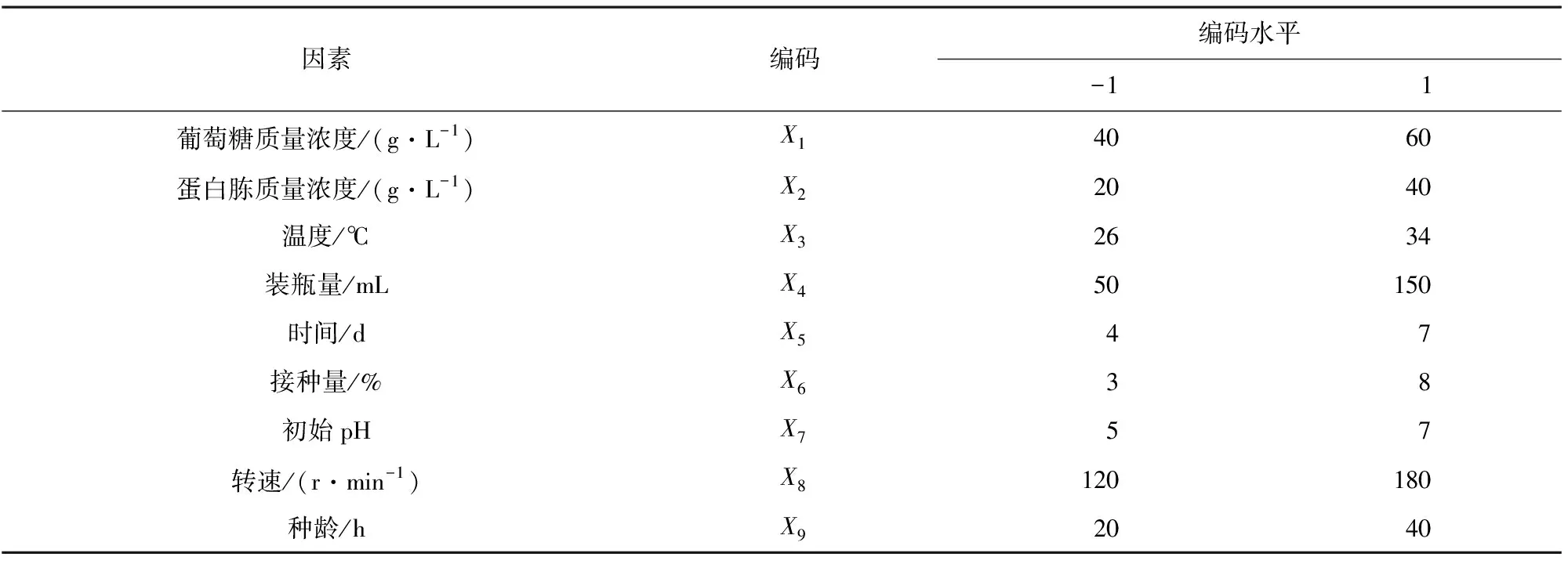
表1 Plackett-Burman设计的因素与水平
1.2.5 最陡爬坡试验
根据Plackett-Burman试验分析结果,将筛选出的影响发酵液色价的显著性因素进行最陡爬坡试验设计,得到关键因子的最佳水平范围。爬坡试验的方向通过回归方程关键因素系数的正负确定,爬坡试验的步长依据响应值的变化进行设计,旨在快速、经济地逼近最大响应区域。
1.2.6 Box-Behnken试验设计
以最陡爬坡试验设计得出的试验结果为依据进行3因素3水平Box-Behnken试验,利用Minitab 18软件将得到的数据构建二次多项式数学模型同时进行回归分析,最终确定蓝色刺孢霉QY229产天然蓝色素的最佳发酵参数,优化后各因素间的交互关系通过三维响应面图呈现。
1.2.7 试验验证
将Box-Behnken分析得到的蓝色刺孢霉最佳发酵参数进行3次重复试验,3次试验得到的结果取平均值,进而验证该试验模型及试验设计应用是否合理可行,并得出最终优化结果。
2 结果与分析
2.1 单因素试验结果
2.1.1 培养基碳源种类的影响
碳源的种类直接关系到微生物的生长和代谢物质的产生[12]。果糖、葡萄糖是常见碳源里能被微生物直接利用的单糖,尤其是葡萄糖,也是发酵培养基中最常被选择作为碳源和能源的糖类物质之一[13]。其他双糖或多糖类物质如蔗糖、麦芽糖和淀粉在水解后也可被微生物逐步利用[14]。本试验以初始发酵培养基为基础,更换不同种类的碳源测定其对发酵液色价的影响,试验结果见图1。
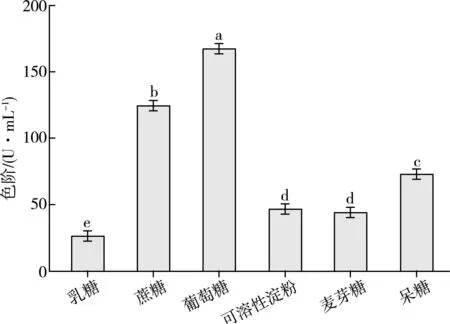
注:不同字母代表两组数据之间存在显著性差异(p<0.05);相同字母代表两组数据之间不存在显著性差异(p>0.05)。碳源质量浓度为60 g/L。
由图1可知,当碳源质量浓度均为60 g/L时,以葡萄糖为发酵培养基碳源,发酵液色价达到167.7 U/mL,显著(p<0.05)高于其它底物作为碳源时的色价。因此,本研究选择葡萄糖作为蓝色刺孢霉液态发酵生产蓝色素的最优碳源。
2.1.2 培养基氮源种类的影响
氮源参与各类微生物细胞重要成分的构建,应用于培养基中的无机氮源在发酵过程早期可以被微生物快速利用,同时能够促使培养基的pH发生变化[15]。而有机氮源如牛肉膏、酵母膏和蛋白胨等工业副产品,除提供氮源外,还可以提供大量的无机盐及生长因子[16]。该过程以葡萄糖为碳源(最佳碳源),结合初始发酵培养基其他条件,研究不同氮源对菌株发酵液色价的影响,依据发酵液色价值的高低选择出最佳氮源,实验结果见图2。
由图2可知,蛋白胨作为培养基的氮源色价达到164.4 U/mL,普遍高于其他物质作为氮源时发酵液的色价,其次是酵母膏。而硝酸钠、硫酸铵、硝酸铵作为氮源,色价均在60 U/mL以下,与有机氮源存在显著(p<0.05)差异性,这就说明与无机氮源相比,有机氮源更能促使该菌株代谢产生蓝色素。因此,本实验中蛋白胨可以作为蓝色刺孢霉液态发酵获取蓝色素的最优氮源。

注:氮源质量浓度为30 g/L。
2.2 Plackett-Burman试验设计
Plackett-Burman试验设计对菌株发酵关键影响因素的筛选结果如表2所示。采用Minitab 18软件对试验数据进行拟合分析,获得发酵液色价Y(响应值)对X1~X9(自变量的编码值)9个因素的一次回归方程:
Y=149.28+8.57X1+11.33X2+62.96X3-26.03X4-5.51X5+6.53X6+7.24X7+1.12X8+1.04X9。

表2 Plackett-Burman试验设计与结果
经分析,该回归方程显著(p=0.010 3),相关系数R2=0.997 7,这表明该回归模型的可信度较高,该方程可以对试验中99.77%的数据作出解释,模型试验误差合理可靠。
另外,根据表3中效应值的大小可知影响蓝色刺孢霉产天然蓝色素的关键因素依次为温度、蛋白胨质量浓度、装瓶量。其中温度和蛋白胨质量浓度对发酵液色价的影响达到了极显著水平(p<0.01),装瓶量对发酵液色价的影响达到了显著水平(p<0.05),其余因素的影响均不显著(p>0.05)。因此后续试验选取X2(蛋白胨质量浓度)和X3(温度)、X4(装瓶量)为关键因素。
2.3 最陡爬坡试验
由Plackett-Burman回归方程可知X2(蛋白胨质量浓度)和X3(温度)对Y(发酵液色价)具有正效应,X4(装瓶量)对Y(发酵液色价)具有负效应。梯度增加温度和蛋白胨质量浓度,同时梯度降低装瓶量,进行最陡爬坡试验,进而确定3个关键因素的最佳水平范围,试验设计及结果如表4所示。由表4可知,试验的最优点在试验4附近。因此,以试验4的条件设置作为后续响应面试验的中心点,实现以最少试验量快速逼近最大发酵液色价区域的目的。

表4 最陡爬坡试验设计及试验结果
2.4 Box-Behnken试验优化确定最佳因素水平
在最陡爬坡实验结果的基础上,以蛋白胨质量浓度(X2)、温度(X3)及装瓶量(X4)作为响应因素,发酵液色价(Y)作为响应值,共计进行15次试验,优化确定最佳因素水平,试验设计与结果见表5和表6。

表5 Box-Behnken设计的因素与水平
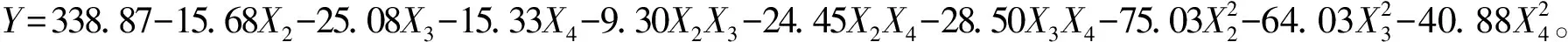
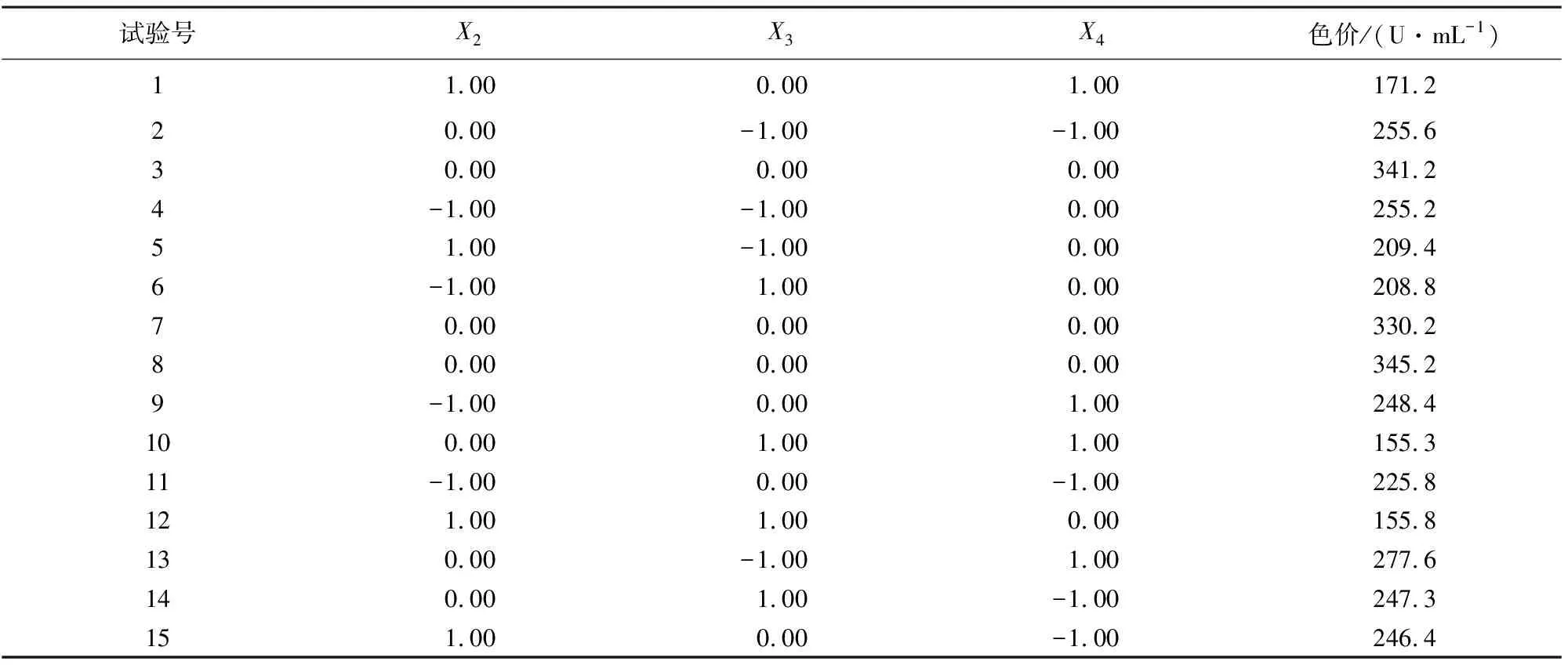
表6 Box-Behnken试验设计与结果
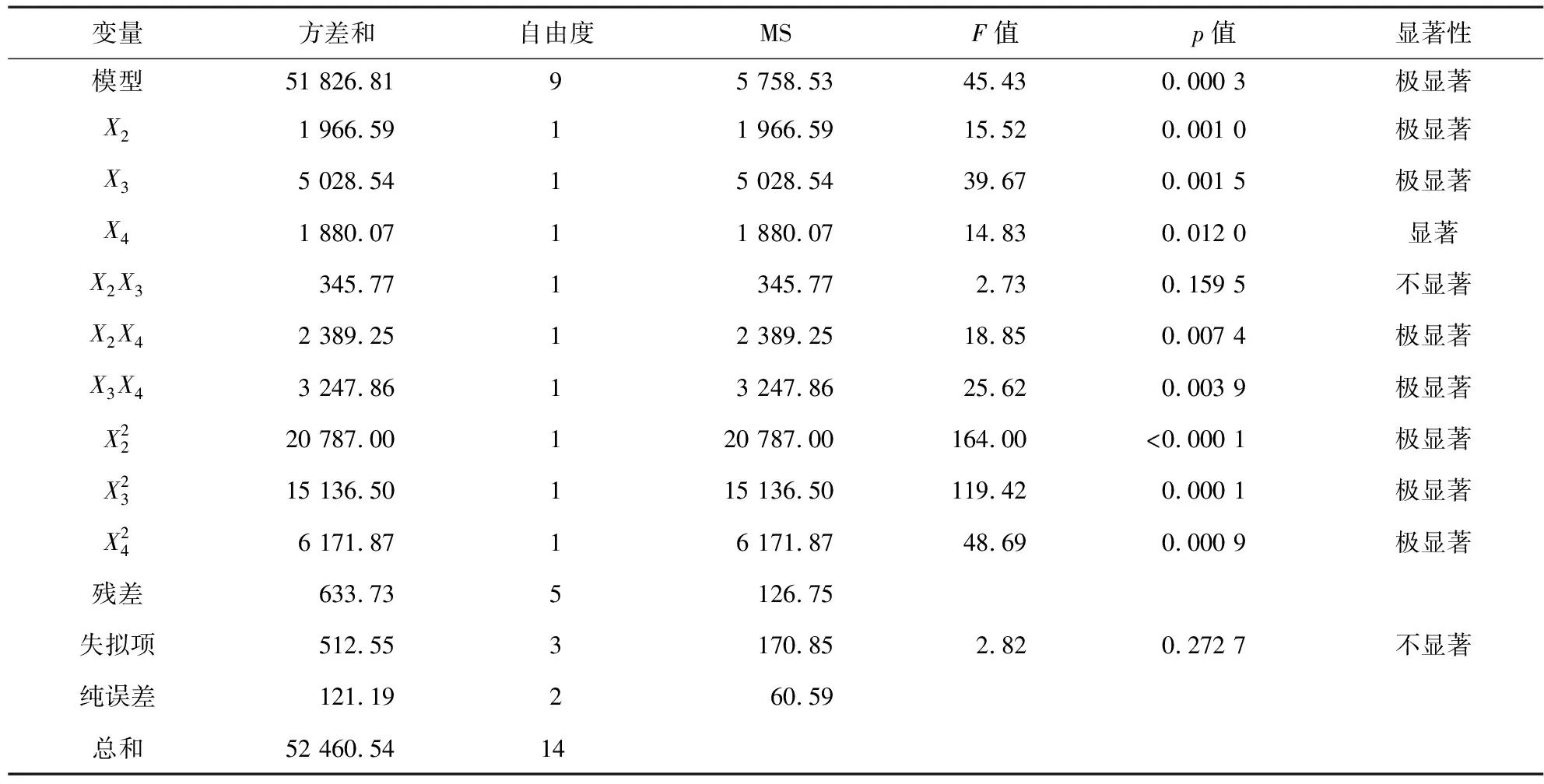
表7 Box-Behnken试验设计回归分析结果
采用Design-Expert 8.0软件,对Box-Behnken试验建立的回归模型中各因素交互作用结果进行响应曲面作图,结果见图3。从图3(a)可以看出,以蛋白胨质量浓度和温度二因素交互生成的三维响应面图中,随着蛋白胨质量浓度和温度的增加,发酵液色价先升高后降低。其中蛋白胨质量浓度的曲面坡度较缓慢于培养温度的曲面坡度,说明发酵液色价受培养温度的影响更大[18]。图3(b)为蛋白胨质量浓度与装瓶量交互生成的三维响应面图,图中等高线的形状为椭圆形,表明二因素交互作用明显,同时验证了方差分析交互项中分析结果的显著性[19]。图3(c)为温度和装瓶量交互生成的三维响应面图,温度和装瓶量交互作用显著,且温度的曲面坡度比装瓶量的曲面坡度陡峭,可知温度对发酵液色价的影响更大[20]。对模型最优点进行分析,得到上述关键因素的最佳水平:培养温度为31.67 ℃,蛋白胨质量浓度为34.61 g/L,装瓶量为72.33 mL,对应发酵液色价的预测值为350.4 U/mL。

(a)蛋白胨质量浓度与培养温度之间的相互作用

(b)装瓶量与蛋白胨质量浓度之间的相互作用
2.5 试验验证
为了验证Box-Behnken分析方法所建模型的预测值与实际值是否能够较好的拟合,将上述优化后的发酵培养基及发酵条件:蛋白胨质量浓度34.61 g/L,温度为31.67 ℃,装瓶量72.33 mL,进行3次试验,3次试验结果的平均值为348.2 U/mL,与理论预测值350.4 U/mL相接近,说明本试验设计的优化模型切实可靠,可应用于蓝色刺孢霉的发酵条件优化。经分析,优化后的发酵液色价是优化前色价的2.1倍,得出该方案可以明显提高蓝色刺孢霉QY229液态发酵条件下蓝色素的产量。
3 结 论
本研究对蓝色刺孢霉产天然蓝色素的液态发酵工艺进行系统优化。以单因素试验结果为基础,采用Plackett-Burman试验设计从9种考察因素中筛选出关键影响因素:氮源质量浓度(蛋白胨)、培养温度、装瓶量。利用最陡爬坡实验设计和Box-Behnken试验对筛选出的3个关键影响因素进行响应面分析,结果表明当蛋白胨质量浓度为34.61 g/L,温度为31.67 ℃,装瓶量为72.33 mL时,发酵液色价达348.2 U/mL,是优化前色价的2.1倍。试验验证显示,预测值与试验值之间没有显著差异,表明优化后的条件是合理可行的。由此可见,蓝色刺孢霉液态QY229发酵产蓝色素作为稀有天然蓝色素的又一新来源,具有广阔的发展潜力。

