运动相关基因纤维连接蛋白Ⅲ结构域蛋白5与乳腺癌的进展相关性研究
宋云蕾,罗 燕
(赣南医学院科研中心,江西 赣州 341000)
2020 年全球癌症统计显示,在女性癌症患者中,乳腺癌高居癌症发病率及死亡率榜首[1]。研究发现,乳腺癌发病与遗传易感性或家族史、怀孕相关因素、激素治疗、生活方式(如肥胖、缺乏运动、酒精摄入和吸烟)等有关[2-3]。尽管乳腺癌患者通过预防、早期发现和及时治疗,死亡率有所下降,但乳腺癌复发、转移仍是威胁女性健康的重要因素[4-5]。因此,寻找乳腺癌发生、发展相关的分子标志物,将有助于乳腺癌的诊断、靶向治疗及预后。
规律的体育锻炼对健康有诸多益处,能够降低患肺癌、前列腺癌和乳腺癌等多种癌症的风险[6-7]。研究发现,定期锻炼的女性患癌风险显著降低[8-9];此外,经常运动还能提高乳腺癌患者的生存率[10]。然而规律性体育锻炼的抗癌作用所涉及的确切机制尚不清楚。运动时肌肉释放一种叫肌动因子的蛋白质到血液中,并输送到身体不同组织发挥作用。由骨骼肌产生的主要肌动因子包括白细胞介素6和白细胞介素15、肿瘤生长抑素、脑源性神经营养因子和鸢尾素[11-12]。这些肌动因子可通过旁分泌、自分泌等方式作用于靶细胞[13]。鸢尾素是由BOSTRÖM P 等[14]发现的由运动后诱导产生的纤维连接蛋白Ⅲ结构域蛋白5(Fibronectin type Ⅲ domain-containing protein 5,FNDC5)经水解酶水解所产生。鸢尾素能将白色脂肪转化为棕色脂肪,通过产生热量释放能量,并对心脑血管、非酒精性脂肪肝及肿瘤等疾病有治疗作用[15]。研究表明,FNDC5在卵巢、睾丸、胰腺、肝脏、脾脏、胃、脂肪、心脏、肾脏、肺、前列腺、肠和胸腺组织中均有表达[16-17]。FNDC5 能够有效抑制乳腺癌细胞增殖和迁移且不影响非癌细胞生长[18],也能够抑制肺癌细胞、骨肉瘤细胞增殖和迁移[19-20]。综上所述,FNDC5 可能作为一种潜在的乳腺癌治疗靶点。然而,FNDC5 在乳腺癌中的研究仍有限,且FNDC5的表达与乳腺癌患者生存的关系尚不清楚,亟待进一步探究。
越来越多的证据表明,表观遗传变化可以改变肿瘤发生过程中的生理和病理过程,并可作为癌症诊断和预后新的生物标志物[21-22]。DNA 甲基化在肿瘤的发生中发挥重要作用[23]。DNA 甲基化是指甲基结合到胞嘧啶上的现象,且在该胞嘧啶核苷酸后面直接跟着鸟嘌呤(CpG 岛)[24]。CpG 岛的甲基化通常影响抑癌基因的表达,参与癌症的发生发展[25]。BRCA1 甲基化程度与乳腺癌较好的预后呈正相关[26],抑制MAGI2 甲基化则能抑制Wnt/β-catenin 信号通路,抑制乳腺癌细胞增殖和迁移[27]。除此以外,microRNA 是18~25 个核苷酸长的单链非编码RNA,调控多种癌症相关信号通路中基因的表达[28]。microRNA-21 高表达促进乳腺癌的增殖和转移[29],而microRNA-424(322)/503 低表达则与较差的预后、较低的生存率及恶性程度更高的肿瘤分型相关[30]。然而,截至目前,尚未有研究表明FNDC5在乳腺癌中的表达是否与其DNA 甲基化和microRNA的表观遗传改变相关。本研究将进一步探究表观遗传对FNDC5的调节作用。
1 资料与方法
1.1 数据来源FNDC5 在不同类型肿瘤中的表达数 据 来 源 于TCGA (https://tcga. xenahubs. net)和GTEx (http://commonfund. nih. gov/GTEx/),乳 腺 癌患者血清中mir-4323、mir-4692、mir-4514 表达数据来源于GEO 数据库中的GSE73002 数据集,FNDC5与mir-4323、mir-4692 表达的相关性分析数据来源于TCGA 数据库的RNA-seq 和miRNA-seq 数据集,乳腺癌GSEA数据来源于METABRIC数据集。
1.2 方法
1.2.1 表达分析使用Tumor Immune Estimation Resource (TIMER)[31]分析泛癌中FNDC5基因表达。使 用bc-GenExMiner v4.9[32](http://bcgenex. ico.unicancer.fr/BC-GEM/)分析乳腺癌中FNDC5 mRNA表达与特异性临床病理特征,包括年龄、雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)、表皮生长因子受体-2(Human epidermal growth factor receptor 2,HER2)、淋巴结状态、组织学类型、Scarff-Bloomm-Richardson(SBR)分级、基底样状态和三阴性状态的关系。通过cBioPortal(http://www. cbioportal. org/)检 测FNDC5 mRNA 表达与FNDC5 甲基化的相关性,并使用UALCAN[33](http://ualcan.path.uab.edu/index.html)检测正常乳腺组织和乳腺癌中FNDC5启动子甲基化水平以及microRNA表达。使用R软件(版本4.3.0)对GSE73002 数据集进行分析,用corrplot 包进行FNDC5与mir-4323、mir-4692表达的相关性分析。
1.2.2 生存分析使用Kaplan-Meier Plotter[34](http://kmplot. com/analysis/) 获得 FNDC5 及microRNA 的生存曲线。通过Survival Meth(http://bio-bigdata. hrbmu. edu. cn/ survival meth/)检测FNDC5甲基化生存曲线。
1.2.3 microRNA 预测通 过DIANA-micro T(http://diana. imis. athena-innovation. gr/DianaTools/)、miR Walk(http://mirwalk. umm. uni-heidelberg. de/)和miR TarBase(https://mirtarbase.cuhk.edu. cn/)预测靶向FNDC5的microRNA。
1.2.4 GSEA 分析用GSEA 4.3.2 进行分析,KEGG、HALLMARK 和GO 基因集从基因集富集分 析 网 站[35](https://www. gsea-msigdb. org/gsea/downloads.jsp)获得。
1.2.5 共表达分析FNDC5 共表达基因用cBioPortal 筛选(乳腺癌数据为TCGA,Firehose Legacy),Spearman 相关r≥0.3 或≤-0.3。通过STRING(https://cn.string-db.org/)进行共表达网络、共表达基因的GO 和KEGG 分析以及FNDC5 相互作用网络。采用TIMER 对PPARGC1A、LEP、UCP1、MENTRL等FNDC5相关基因进行散点图分析。
1.2.6 统计学处理FNDC5 表达数据经log2 变换归一化处理。正常乳腺组织和乳腺癌标本采用双尾t检验进行比较。采用Bc-Gen ExMiner 的Welch′s和Dunnett-Tukey-Kramer′s 试验进行差异基因表达分析和临床参数相关性分析。所有基因生存分析均采用Cox 比例风险回归分析、KM 分析和Log-rank检验。采用Spearman 检验和Pearson 检验分析两个变量之间的相关性。采用局部统计量、全局统计量、加权Kolmogorov-Smirnov-like 统计量和多元假设检验对GSEA进行分析。以α=0.05为检验水准。
2 结果
2.1 乳腺癌中FNDC5 表达FNDC5 在乳腺癌、膀胱尿路上皮癌、胆管癌、结肠腺癌等癌组织中的表达水平低于正常组织(图1A)。TCGA 和GTEx 数据库的mRNA阵列表达数据及bc-Gen ExMiner v4.9的RNA-seq 数据显示,FNDC5 mRNA 在乳腺癌组织中的表达低于正常乳腺组织(P<0.000 1,图1B、图1C)。FNDC5在三阴性乳腺癌(TNBC)中的表达低于正常乳腺组织(P<0.01)和癌旁组织(P<0.000 1)(图1D)。
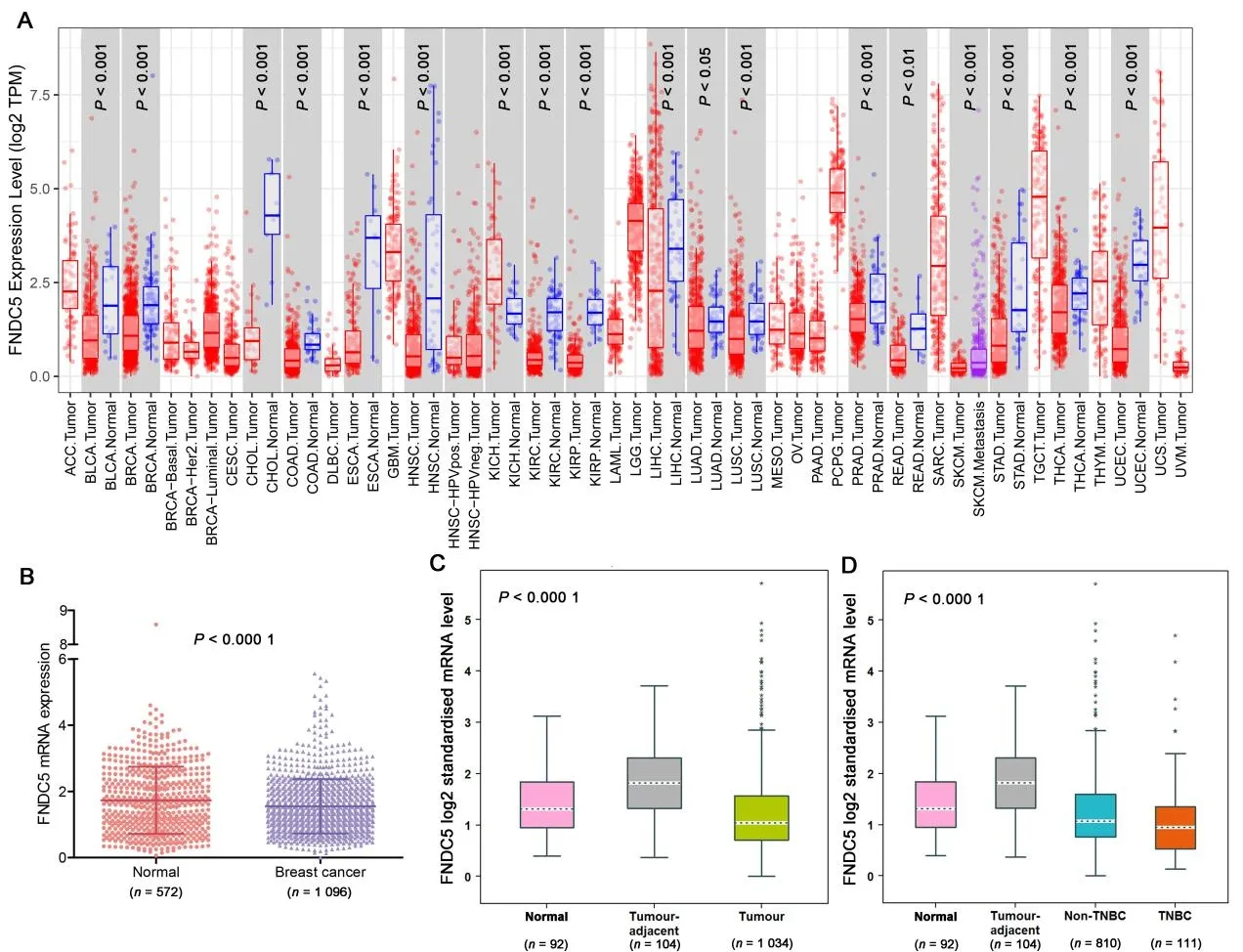
图1 FNDC5在乳腺癌中的表达
2.2 乳腺癌中FNDC5 表达与临床参数的相关性FNDC5表达在≤51岁组与>51岁组之间差异有统计学意义(P=0.000 2,图2A),且≤51 岁组的中位数低于>51 岁组。相比ER 阳性、PR 阳性、HER2 阴性、淋巴结阴性乳腺癌样本,ER 阴性、PR 阴性、HER2 阳性、淋巴结阳性乳腺癌样本FNDC5 表达均较低(P<0.000 1,图2B、图2C、图2D、图2E)。在不同组织学类型的乳腺癌样本中,微乳头状癌(Micropapillary)FNDC5 的表达低于浸润性导管癌(Invasive ductal carcinoma,IDC)、浸润性小叶癌(Invasive lobular carcinoma,ILC)和黏液癌(Mucinous)(P<0.000 1,图2F)。FNDC5 在SBR分级晚期乳腺癌样本中的表达降低(P<0.000 1,图2G),在基底样乳腺癌(BLBC)和三阴性乳腺癌(TNBC)样本中的表达低于非基底样乳腺癌(Non-BLBC)和非三阴性乳腺癌(Non-TNBC)(P<0.000 1,图2H、图2I)。
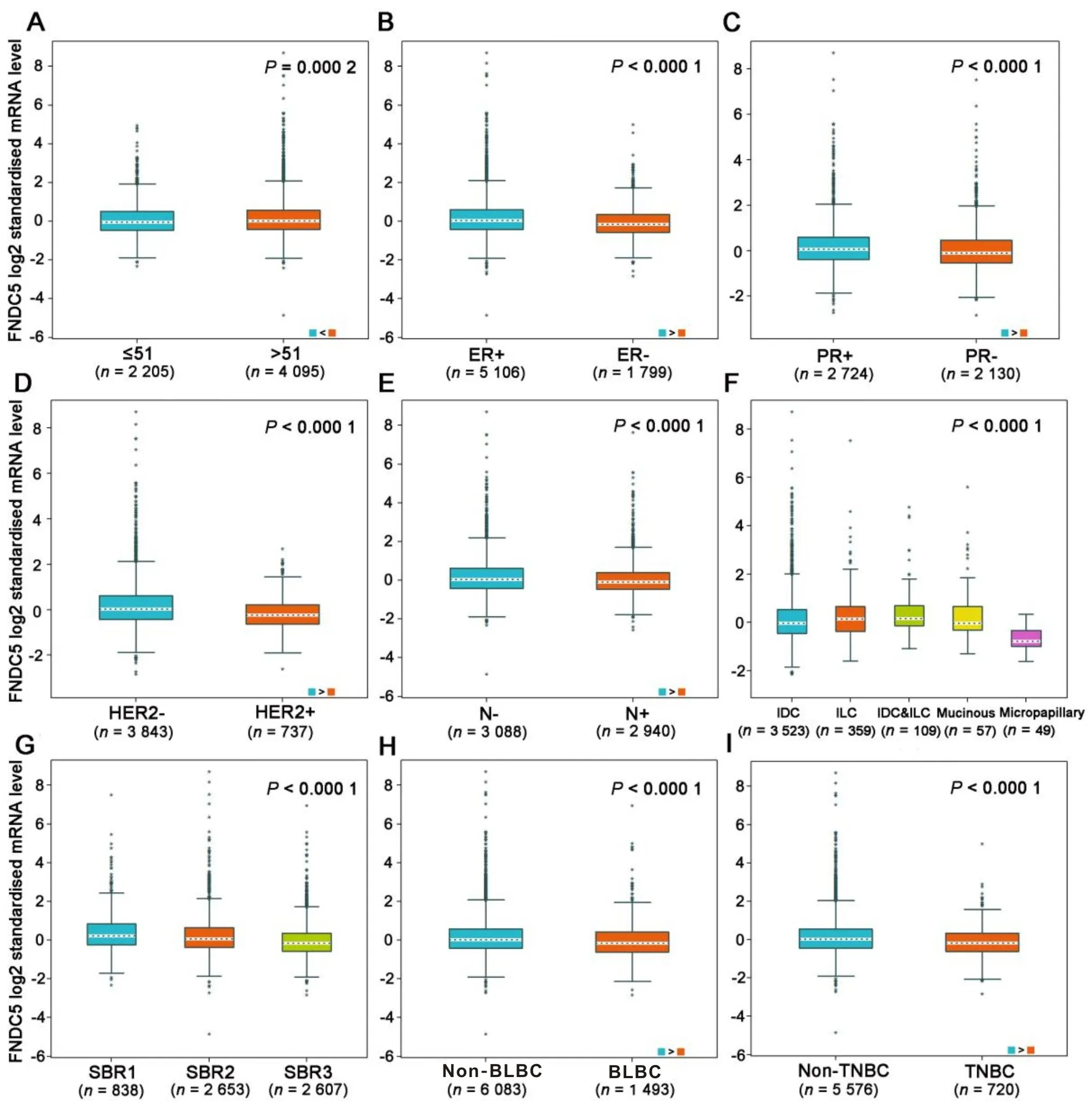
图2 乳腺癌中FNDC5的表达
2.3 乳腺癌中FNDC5 表达与患者预后相关性FNDC5 mRNA 高表达与乳腺癌患者的无远处转移生存期(P=0.006 1,图3A;P=0.007 9,图3B)、无复发生存期(P=0.000 8,图3C;P<0.000 1,图3D)、总生存期(P=0.003 8,图3E)和进展后生存期(P=0.043,图3F)的良好预后显著相关。

图3 Kaplan-Meier Plotter绘制的乳腺癌患者FNDC5表达生存曲线
2.4 乳腺癌中FNDC5 表达与启动子甲基化水平的相关性在TCGA 乳腺癌数据中,FNDC5 mRNA的低表达与FNDC5 甲基化之间具有相关性(P<0.05,图4A),而METABRIC 数据中显示,FNDC5 mRNA 的低表达与FNDC5 甲基化之间无相关性(P>0.05,图4B)。
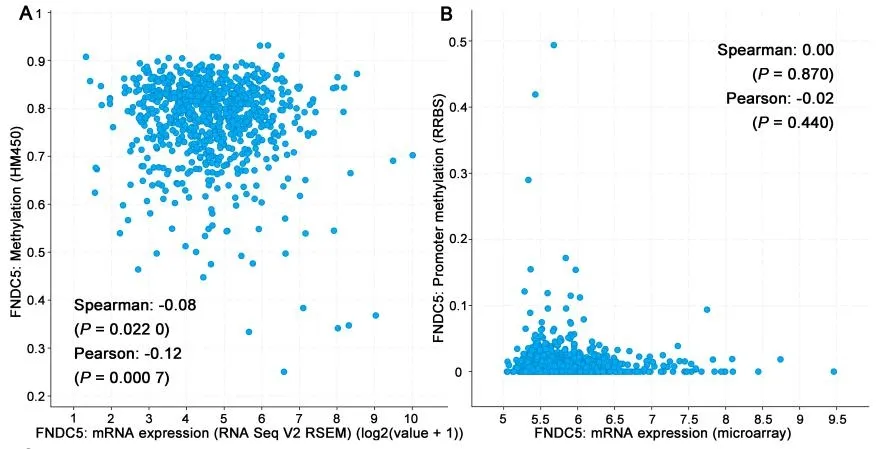
图4 乳腺癌中FNDC5 mRNA表达与甲基化相关性
2.5 乳腺癌中FNDC5 启动子甲基化水平与患者预后相关性与正常乳腺组织相比,乳腺癌中FNDC5 启动子甲基化水平较低(P<0.000 1,图5A),同时,乳腺癌患者生存率与FNDC5甲基化水平无相关性(图5B)。
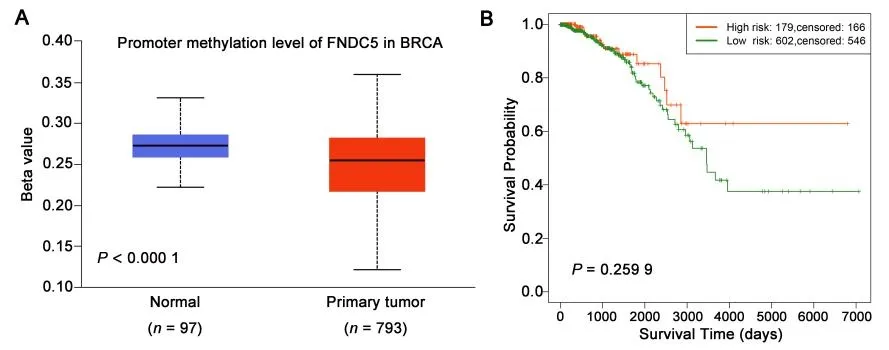
图5 乳腺癌中FNDC5甲基化表达与生存相关性
2.6 乳腺癌中FNDC5 的下调可能与乳腺癌中mir-4323 和mir-4692 相 关使用3 个microRNA 数据库分别预测有210 个microRNA(DIANA-microT)、2 034 个microRNA(miRWalk)和22 个microRNA(miRTarBase)靶向FNDC5。其中三者交集的3 个microRNA 是mir-4323、mir-4692 和mir-4514(图6A)。在GSE73002数据集中,3个microRNA 在乳腺癌患者中表达高于正常乳腺组织(P<0.000 1,图6B)。从TCGA 的泛癌数据集中发现,FNDC5 的表达与mir-4692的表达呈正相关(r=0.366,P<0.001,图6C),与mir-4323 的表达呈负相关(r=-0.111,P<0.001,图6C)。此外,mir-4323和mir-4692是乳腺癌预后不良标志物(P<0.000 1,图7A、图7B)。
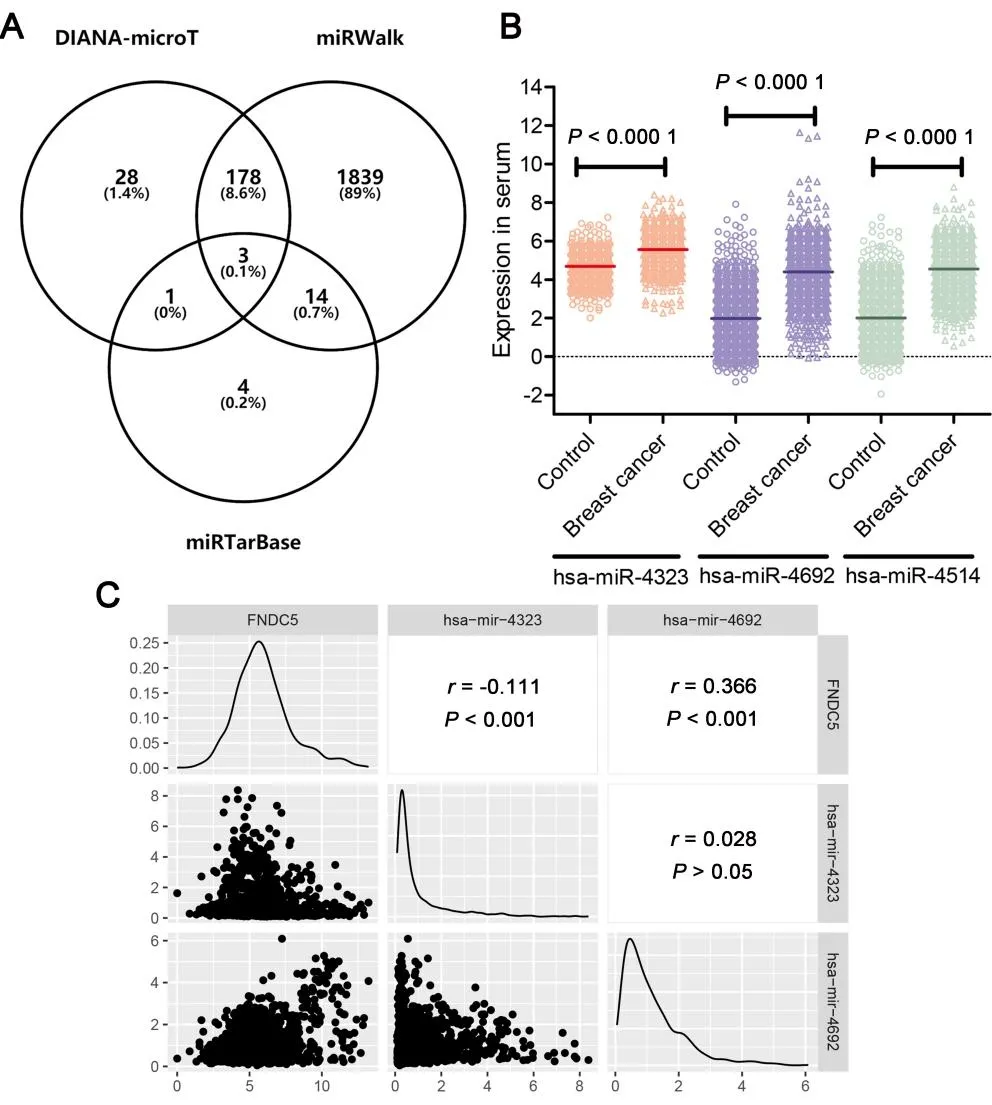
图6 乳腺癌中FNDC5相关microRNA的预测交集以及mir-4323、mir-4692的表达

图7 乳腺癌中mir-4323、mir-4692的生存曲线
2.7 FNDC5 与乳腺癌进展相关GSEA 分析发现,乳腺癌FNDC5 富集在与乳腺癌进展相关的通路,如Hedgehog信号通路、焦黏、钙信号通路、ECM受体相互作用、血管平滑肌收缩、基底细胞癌、TGF-β信号通路、NOTCH 信号、纤维细胞生长因子受体结合通路等(图8)。从TCGA 乳腺癌数据中发现,FNDC5 与222 个基因表达相关(图9A)。这些相关基因富集于细胞周期、细胞外基质、含胶原细胞外基质、细胞外基质组织通路等(图9B)。其中,在乳腺癌中,FNDC5 与PPARGC1A(r=0.172,P<0.000 1,图9C)、LEP(r=0.205,P<0.000 1,图9D)、UCP1(r=0.168,P<0.000 1,图9E)、METRNL(r=0.102,P=0.000 7,图9F)、FGF21(r=-0.074,P=0.013 8,图9G)、MSTN(r=0.198,P<0.000 1,图9H)、ADIPOQ(r=0.242,P<0.000 1,图9I)和PRDM16(r=0.276,P<0.000 1,图9J)等基因表达显著相关。
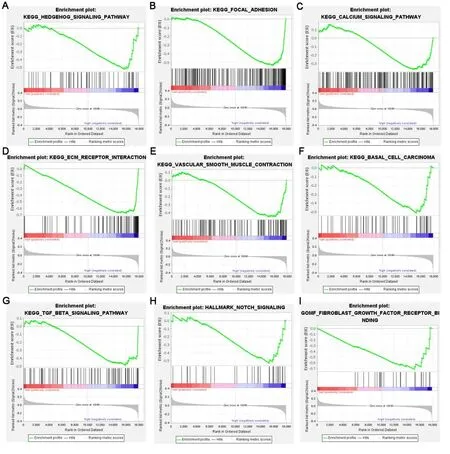
图8 乳腺癌中FNDC5基因富集分析(GSEA)结果
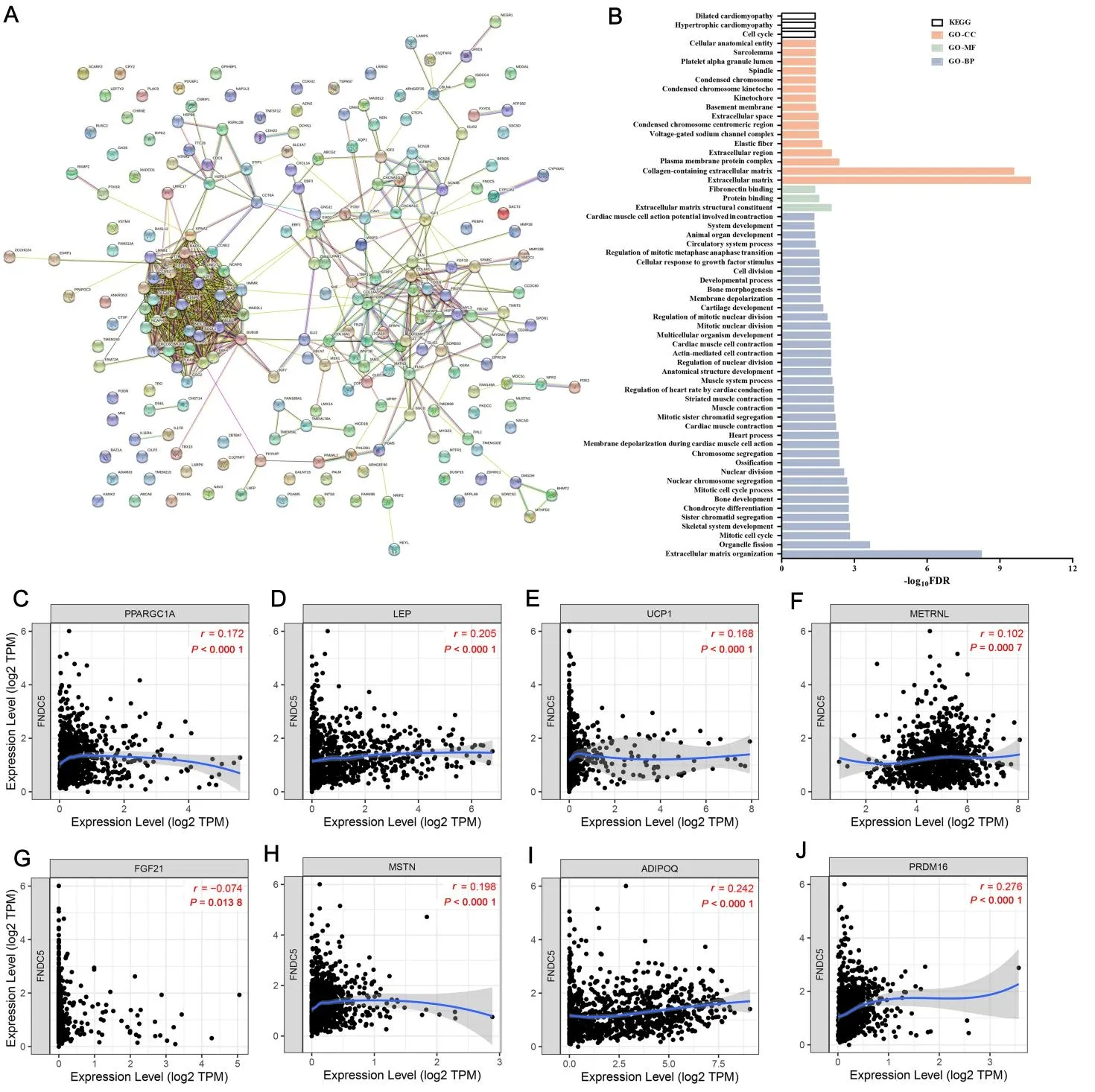
图9 乳腺癌中FNDC5表达相关基因及其富集结果
3 讨论
乳腺癌已成为2020 年全球癌症发病率的第一大原因和死亡率的第五大原因,给社会带来了巨大负担[1]。迫切需要对乳腺癌的治疗进行适当干预。研究表明,经常锻炼可以降低患乳腺癌的风险[6-9]。研究运动过程中产生的大量肌动因子[12]对乳腺癌的影响,可为乳腺癌的防治提供帮助。
鸢尾素最早被发现是一种由运动诱发产生的肌动因子,可将白色脂肪转化为棕色脂肪[14],是一种由FNDC5基因编码的分子量为12 kD 的蛋白,可被分泌到血液[14]、脑脊液[36]和支气管肺泡灌洗液[37]中。研究表明,鸢尾素具有抗肿瘤[20]、抗心血管疾病[38]和抗神经退行性疾病[39]的特性。鸢尾素的抗肿瘤特性已在体外研究中得到证实,该研究发现鸢尾素通过触发细胞凋亡和抑制NF-κB 活性抑制恶性乳腺癌细胞系迁移和增殖[18]。此外,有学者采集了101 例女性乳腺癌患者和51 例健康对照者血液样本,发现乳腺癌患者血清中鸢尾素浓度低于健康对照者,恶性程度高的乳腺癌患者血清中的鸢尾素含量明显低于恶性程度低的乳腺癌患者,这表明鸢尾素的浓度与肿瘤分期有关[40]。与此同时,研究发现有脊柱转移的乳腺癌患者血清中鸢尾素水平明显低于无脊柱转移的乳腺癌患者,在调整BMI 和年龄后,鸢尾素是乳腺癌的独立预后因素[41]。表明血清中高水平的鸢尾素可能是乳腺癌患者脊柱转移的保护因素。因此,推测FNDC5与乳腺癌的预后密切相关。本研究发现,乳腺癌组织中FNDC5 mRNA水平低于正常乳腺组织。FNDC5 mRNA 表达水平与乳腺癌的严重程度呈负相关。此外,本研究发现FNDC5低表达组复发风险较高,生存率较差。
DNA 甲基化对乳腺癌的预后有重要影响,并影响乳腺癌的进展[42-43];值得注意的是,血液中的DNA甲基化水平在浸润性乳腺癌被检测到前就已经开始发生变化[44]。DNA 甲基化是表观遗传变化,指在不改变DNA 序列的情况下改变基因的表达[45]。正常情况下,基因启动子区域的CpG 岛通常未被甲基化。然而,在病理条件下,CpG岛的甲基化水平可以被改变,进而调控靶基因的表达[46]。本研究发现,与正常乳腺组织相比,乳腺癌组织中FNDC5的甲基化水平较低,FNDC5 的低表达与其甲基化应该相关性不大,后续METABRIC 数据中证实了这点。而乳腺癌组织中FNDC5 mRNA 表达水平较低可能与mRNA表达调控机制的复杂性有关,考虑到microRNA可以调控基因表达水平。因此,本研究进一步探索可以调控FNDC5 mRNA 表达并影响乳腺癌进展的microRNA。已有研究[19,47-54]表明,在某些疾病中,FNDC5基因表达与特异性microRNA 有关。METWALLY M 等[52]发现,在严重的肝脂肪变性中,miR-135a-5p 下调FNDC5 mRNA 的表达。此外,miR-214-3p靶向FNDC5,可减轻FNDC5的抗肿瘤特性[19]。然而,迄今为止,已发表的与FNDC5 相关的特异性microRNA 是否干预乳腺癌中FNDC5 的表达尚未见报道。本研究利用3 个microRNA 数据库推测出mir-4323 和mir-4692 可能是乳腺癌患者FNDC5 mRNA 的调节因子,但仍需要进一步研究证明这一点。最近的研究表明,FNDC5 可能参与肿瘤微环境、肿瘤生长、免疫细胞和肿瘤细胞增殖[20]。通过GSEA分析发现,FNDC5可能通过调控Hedgehog信号通路、焦黏、钙信号通路、ECM 受体相互作用、血管平滑肌收缩、基底细胞癌、TGF-β 信号通路、NOTCH 信号通路和成纤维细胞生长因子受体结合通路,影响乳腺癌的进展和转移。提示FNDC5在乳腺癌的临床治疗上具有潜在的意义。
然而,本研究有一些局限性。首先,乳腺癌患者的生活方式并没有被考虑在内。由于FNDC5 的表达水平与运动密切相关,为了获得更精确的结果,未来有必要进行进一步的研究,包括不同生活方式的患者。其次,预测出mir-4323 和mir-4692 靶向FNDC5 mRNA 在乳腺癌中的作用还需要更多的实验证明。第三,生物信息学预测出的FNDC5调控乳腺癌进展的相关机制仍需进一步研究。

