黄酮类金属配合物抗肿瘤作用的研究进展
李 薇,黄 艳,王姿秀,邱敏华,叶轶霏,丁 萍,李 珊,雷 健
(赣南医学院药学院,江西 赣州 341000)
自20 世纪60 年代ROSENBORG 首次发现顺铂对肿瘤细胞具有良好的生长抑制作用以来,金属抗癌药物的研究受到了医药工作者的高度关注。其中,以顺铂、卡铂、奥沙利铂为代表的铂类药物是临床上使用最为广泛的一线化疗药物之一,但严重的毒副作用和高发的耐药性等缺点极大地限制了此类药物的实际治疗效果[1-3]。因此,开发高效、低毒、广谱、抗肿瘤耐药性的新型金属抗癌药物仍然是当今医药领域的一大研究热点。金属抗癌药物的本质是金属配合物,是一类由金属中心体与配体通过配位作用按一定组成、构型所构筑的化合物。针对铂类化疗药物的局限性,国内外学者提出了多种配合物设计理念,其中就包括了“中药配位化学学说”。该学说认为,中药有效化学成分不是单纯的有机成分,也不是单纯的微量元素,而是有机成分与微量元素组成的配位化合物,配位化合物才是真正整体意义上的中药有效成分,较纯有机成分和纯微量元素更能全面地反映中药的物质基础,代表中药的活性作用核心。因此,中药单体在与金属离子以配位键结合形成配合物后,不仅能提升原有的药理活性,还将有望产生新的生物学效应并降低毒副作用[4-6]。受此设计理念的启发,一些结构新颖、理化性质特异的中药金属配合物被相继合成,并在抗氧化、抗菌、抗癌等方面呈现出广阔的应用前景。
迄今为止,中药金属配合物在抗肿瘤方面的研究主要集中在黄酮类金属配合物上[7-10]。黄酮是一类由A、B 两个芳香环通过三碳链连接而形成的化合物,根据其C2-C3 键的氧化程度、B 环连接位置以及中央三碳链是否成环等特点,黄酮类化合物大致可分为黄酮类、黄酮醇类、二氢黄酮类、二氢黄酮醇类、异黄酮类、查耳酮类等。黄酮类化合物作为金属抗肿瘤药物的配体具有以下优点:⑴来源广泛,相对廉价,早已商品化;⑵富含羟基、羰基等官能团,兼具较高的超离域度和完整的大π键共轭体系,可以作为良好的螯合试剂与多种金属离子进行配位;⑶分子骨架中含有平面芳香环结构,可通过π-π堆积、氢键、范德华力等非共价相互作用与DNA、蛋白质等生物大分子结合;⑷分子结构相似,合成配合物后可系统研究配体结构与性质、性能之间的关系;⑸一些黄酮类化合物自身具备抗肿瘤潜能,能够在与金属离子配位后发挥协同作用。本文根据黄酮类化合物的母体结构特点(图1)对相关金属配合物的配位模式及其抗肿瘤作用进行简单梳理,以期为黄酮-金属配合物的研制提供参考依据,助力金属药物在癌症治疗领域中的应用。

图1 代表性黄酮类化合物的母体结构
1 黄酮类
黄芩苷是传统中药“三黄”之一黄芩的主要活性成分,兼具清热解毒、抑菌、降血糖、抗过敏等多种药理活性,并对前列腺癌、肺癌、肝癌等多种肿瘤具有抑制作用,其基本母核为2-苯基色原酮,是一种典型的黄酮类化合物。有文献[11-15]报道,黄芩苷-金属配合物多是以5 位羟基与4 位羰基作为结合位点与金属离子进行配位,结构简式如图2a 所示,其中n 为金属离子的价态,y 为黄芩苷配体的数目,X为金属盐前驱体的阴离子。有研究[11]合成了5种新型的黄芩苷稀土(钐、钆、钕、铈、镨)配合物(图2b),利用MTT 法评价了其对肝癌HepG2 细胞的生长抑制作用,发现配合物的抗肿瘤活性强弱顺序依次为黄芩苷-钐>黄芩苷-钆>黄芩苷-钕>黄芩苷-铈>黄芩苷-镨,并披露这些配合物的细胞毒性取决于其对DNA的嵌合能力。郭明课题组[12-13]利用黄芩苷与醋酸金属盐络合配位制备了6 种黄芩苷的铈(Ⅲ)、镧(Ⅲ)、钇(Ⅲ)、镍(Ⅱ)、钴(Ⅱ)、铜(Ⅱ)配合物(图2b),并利用紫外、红外、质谱、元素分析等技术手段对组成、结构进行分析表征。体外细胞毒性实验结果显示,6 种黄芩苷-金属配合物对肝癌SMMC-7721 细胞的抑制作用明显优于黄芩苷,并呈现时-效依赖性和量-效依赖性。细胞周期实验的结果表明,黄芩苷-金属配合物能够使细胞周期阻滞于G0/G1期(镍、钴、铜)或G2/M 期(铈、镧、钇)。荧光定量RT-PCR 和Western blot 的结果证实,这些金属配合物可以通过下调Bcl-2 和上调Bax 表达促进肿瘤细胞凋亡。有研究[14-15]考察了黄芩苷和黄芩苷-铜配合物(图2c)对HepG2 细胞裸鼠移植瘤的抑制作用,发现黄芩苷-铜配合物对HepG2 裸鼠移植瘤的抑制率(44.9%)明显强于黄芩苷(31.7%),并通过Western blot 法证实该配合物的作用机制不仅与Bcl-2 表达下调和Bax 表达上调有关,而且与PI3K/Akt/mTOR、Caspase、p38 等 信 号 通 路 下 调相关。

图2 抗肿瘤类黄芩苷-金属配合物的配位模式及其代表性化合物
近年来,其他类型黄酮类化合物如木犀草素、荭草苷、芹菜素、白杨素等的金属配合物也被相继合成,其配位模式与黄芩苷类似,多以5 位羟基与4位羰基作为配位位点与金属离子进行结合。然而,这些配合物的生理活性主要集中在抗氧化、抗菌、抗炎与降血糖等方面[16],有关其在抗癌方面的研究却鲜有报道。SPOERLEIN C 等[17]发现芹菜素、白杨素与醋酸铜所形成的铜(Ⅱ)配合物能有效抑制黑色素瘤518A2、结肠癌HCT-116、宫颈癌KB-V1/Vbl与乳腺癌MCF-7/Topo 等细胞增殖,其半抑制浓度(IC50)为(4.6±0.5)~(15.8±2.5) µM,远优于未发生配位作用的前驱体,并且该类型配合物对正常的包皮成纤维细胞无明显的杀伤作用,具有一定的肿瘤选择性。HALEVAS E等[18]发现在白杨素-镓(Ⅲ)配合物中引入不同的螯合剂(如1,10-菲咯啉、2,2′-联吡啶和咪唑等)将显著提升配合物的稳定性并增强其对肿瘤细胞生长抑制作用。
2 黄酮醇类
黄酮醇类化合物是指以2-苯基-3-羟基色原酮为骨架的一类化合物,是目前黄酮类金属配合物中研究最为广泛的一类化合物,代表性化合物主要有槲皮素和芦丁。槲皮素是葛根、沙棘、槐米等中药材的主要活性成分,因其具有抗氧化、抗微生物感染及抗肿瘤等多种药理活性而备受关注。槲皮素与金属离子的配位模式主要有3 种[19-22]:⑴5 位羟基与4 位羰基(图3a);⑵3 位羟基与4 位羰基,这是槲皮素-金属配合物最常见的配位模式(图3b);⑶B环上的邻苯二酚羟基(图3c)。
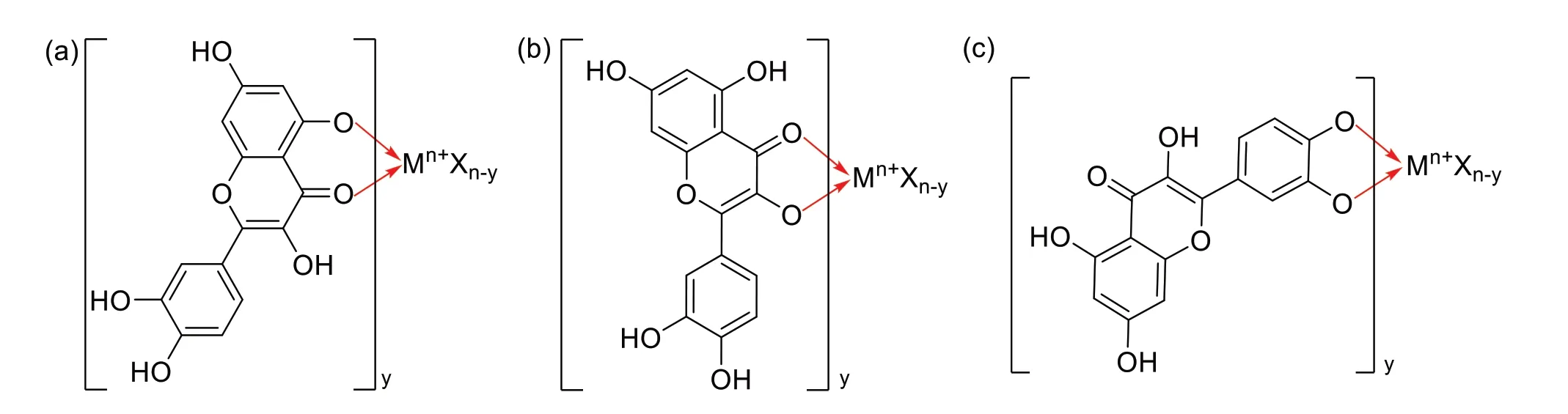
图3 槲皮素与金属离子的配位模式
LEE Y H 等[23]利用槲皮素和氯化锌以1∶1 投料比在乙醇中反应制备了相应的槲皮素-锌(Ⅱ)配合物,发现其对膀胱癌BFTC-905细胞的生长抑制作用明显高于槲皮素,并借助流式细胞术和Western blot等技术证实了该配合物可以通过调节p-Akt/Akt和MT1-MMP信号通路诱导BFTC-905细胞凋亡。方新华[24]揭示了槲皮素-锌(Ⅱ)配合物能使细胞周期阻滞于G0/G1期促进宫颈癌HeLa 细胞和肝癌HepG2细胞发生凋亡。TAN J 等[25]与MUTLU GENCKAL H等[26]分别评价了槲皮素-金属配合物(锰、钴、镍、铜、锌)对肝癌HepG2、SMMC-7721 细胞和肺癌细胞A549 的细胞毒性,其半抑制浓度可低至10.67 µM,Western blot 检测发现肿瘤细胞的凋亡与survivin 和Bcl-2 表达水平降低以及p53 水平显著升高有关,并证实该类型配合物能以嵌插结合的方式与DNA 相互作用。NASO L 等[27]在酸性条件(pH 4.0)下将槲皮素与二氯化氧钒配位络合制备了槲皮素-钒(Ⅳ)配合物,该配合物对4 种乳腺癌细胞T47D、SKBR3、MDA-MB-231以及MDA-MB-468 均具有良好的生长抑制作用,且并不影响正常乳腺上皮细胞增殖,具有特异性杀伤能力。ROY S等[28]从细胞水平和动物水平系统评价了槲皮素-钒(Ⅴ)配合物的抗肿瘤性能,发现其能够通过上调p53和Caspase 3/9的表达以及下调Akt、mTOR 和VEGF 的表达并呈浓度依赖性地诱导凋亡与DNA 碎片化。陈小平[29]将槲皮素与临床抗癌药物顺铂络合后所得的配合物不但具有更高的抗肿瘤活性和更低的毒副作用,而且不与顺铂产生交叉耐药性。在动物实验中,槲皮素-铂配合物对小鼠肉瘤S-180的抑制率是顺铂的2倍,进一步证实了将黄酮类化合物与金属离子进行配合,发挥两者的协同作用,是提高黄酮类化合物活性的有效途径。
芦丁是槲皮素的糖苷衍生物,其配位位点主要是5 位羟基与4 位羰基,能够与铜(Ⅱ)、钙(Ⅱ)、锌(Ⅱ)、锰(Ⅱ)、铁(Ⅲ)、铕(Ⅲ)、钒(Ⅳ)等金属离子进行络合形成稳定的芦丁-金属配合物(图4a),这些配合物能抑制多种肿瘤细胞增殖[30-33]。IKEDA N E等[34]报道了1 种具有双金属中心的芦丁-锌(Ⅱ)配合物(图4b),该配合物对多发性骨髓瘤RPMI8226细 胞(196.6 µM)、小鼠黑 色 素瘤B16F10 细 胞(160.7 µM)、皮肤恶性黑色素瘤SK-MEL-28 细胞(194.0 µM)、白血病KG1(91.4 µM)及K562(173.2 µM)细胞具有一定的抗增殖作用,但对正常的静脉内皮细胞和成纤维细胞未显示出细胞毒性。机制研究证实,上述芦丁-锌(Ⅱ)配合物的抗肿瘤作用机制与细胞周期阻滞、线粒体膜电位变化、抑制肿瘤血管生成以及调节凋亡相关基因表达有关。有研究[35-36]报道了一种芦丁与氧化钒(Ⅳ)离子的全新配位模式,即仅利用芦丁B 环上的邻苯二酚羟基与中心金属离子进行配位(图4c)。体外实验结果显示,单纯的芦丁与氧化钒对A549细胞没有细胞毒性,而二者配位后形成的配合物具有显著的抗肿瘤作用(95 µM),且不会影响人胚肺成纤维细胞MRC-5的活力。进一步研究表明,该配合物的药理活性主要源于肿瘤细胞内活性氧的产生和还原型谷胱甘肽的消耗,并能够像芦丁一样被蛋白质存储和转运。
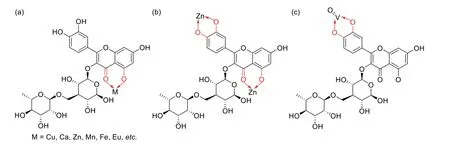
图4 抗肿瘤类芦丁-金属配合物示例
此外,一些由山柰酚、桑色素等黄酮醇类化合物所构筑的金属配合物的抗肿瘤作用也被陆续报道[37-38]。例如,硝酸镧与山柰酚和二亚乙基三胺衍生的Schiff 碱配体所形成的镧(Ⅲ)配合物可以通过与DNA 嵌插结合的方式杀伤急性早幼粒白血病HL60[(22.37±0.93) µM]和肝癌HepG2[(17.12±1.06) µM]细胞,其活性与临床抗癌药物5-氟尿嘧啶(5-FU)接近[37];桑色素-锌(Ⅱ)配合物可选择性地抑制肺癌A549 和H520 细胞生长,但对MRC-5 肺成纤维细胞无显著杀伤作用[38]。
3 二氢黄酮类与二氢黄酮醇类
二氢黄酮(醇)类化合物的母体结构是黄酮(醇)类中央三碳链的双键氢化后的衍生物,分子中主要的配位结合位点为5 位羟基与4 位羰基,其代表性化合物是橙皮苷、柚皮素和水飞蓟宾。橙皮苷是一种广泛存在于柑橘属植物果皮中的化合物,具有防止动脉硬化、消炎镇痛、抗氧化及抗肿瘤等药理活性,这也是赣南地区的优势资源之一。夏侯国论等[39]利用橙皮苷与氯化镨或氯化钇在碱性环境(pH8.5)下于甲醇溶液中制备了相应的橙皮苷-稀土配合物(图5a)。体外细胞毒性实验结果显示,配位前驱体氯化镨、氯化钇对高转移肺癌95-D 细胞均有一定程度的抑制作用,未配位的橙皮苷抑制作用不明显,发生配位作用后,橙皮苷-镨(Ⅲ)配合物的抗肿瘤活性显著高于氯化镨,而橙皮苷-钇(Ⅲ)配合物的活性与氯化钇接近,说明黄酮类金属配合物的药理活性并非黄酮类化合物和金属离子各自活性的简单相加,还需要考察二者之间的匹配程度。这一观点在ALPER P 等[40]研究中得到了验证,他们发现在相同的培养条件下,柚皮素-铜(Ⅱ)配合物对三阴性乳腺癌细胞MDA-MB-231的抑制作用是具有相同结构的镍(Ⅱ)配合物的3倍。
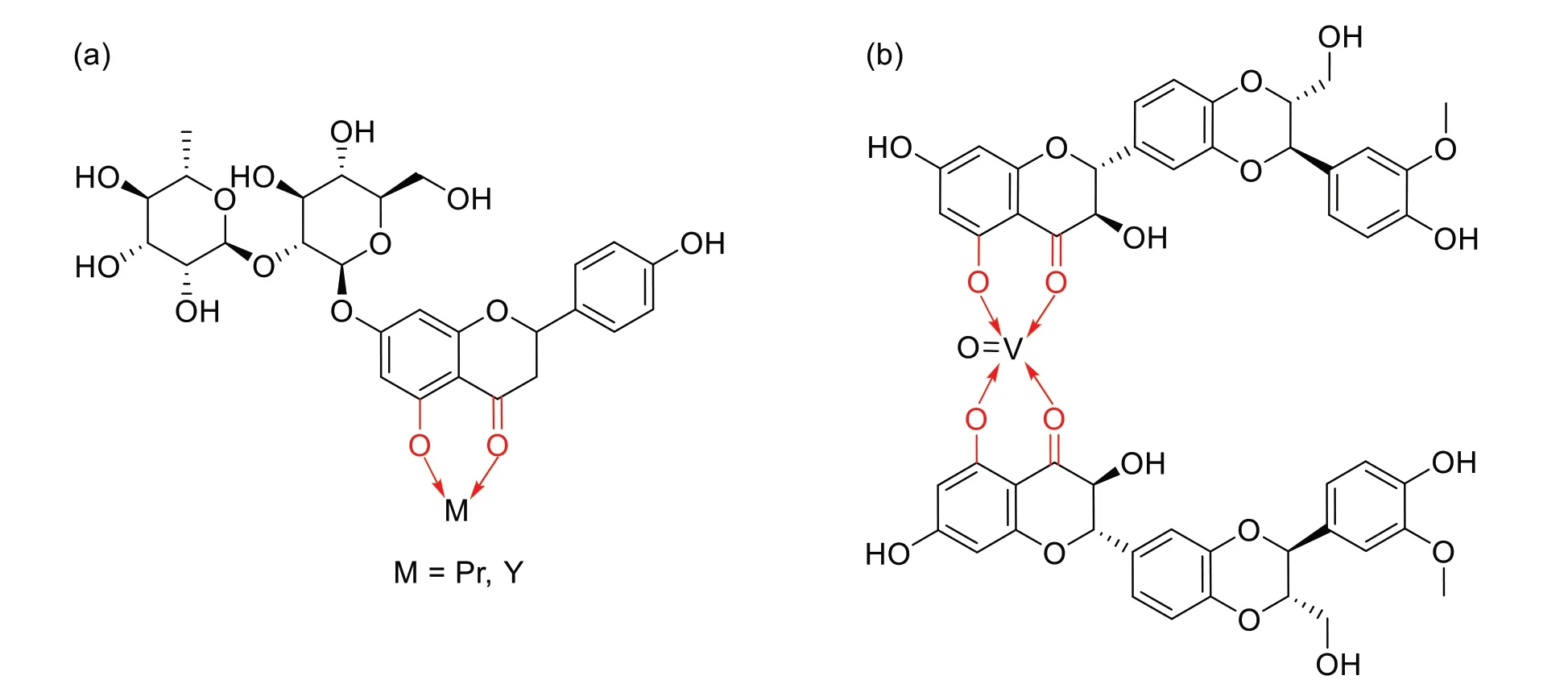
图5 抗肿瘤类二氢黄酮(醇)-金属配合物示例
水飞蓟宾是从水飞蓟种子中提取的一种二氢黄酮醇类化合物,主要的作用是稳定肝细胞膜,保护肝细胞的酶系统,清除肝细胞内活性氧自由基等。LEON I E 等[41]设计、合成了1 种水飞蓟宾-钒(Ⅳ)配合物(图5b),并利用白杨素-钒(Ⅳ)类似物作为对照考察其体外抗肿瘤作用。研究结果显示,2 种钒(Ⅳ)配合物对结肠腺癌HT-29 细胞的抑制作用均高于游离的黄酮配体和钒(Ⅳ)离子,且水飞蓟宾-钒(Ⅳ)配合物要优于白杨素-钒(Ⅳ)配合物,二者的细胞毒性取决于肿瘤细胞内活性氧含量。机制研究证实,白杨素-钒(Ⅳ)配合物是通过阻滞细胞周期于G2/M 期来诱导肿瘤细胞凋亡,而水飞蓟宾-钒(Ⅳ)配合物是通过激活Caspase 3 和抑制NFκB 的活化来促进凋亡。此外,水飞蓟宾-钒(Ⅳ)配合物具有特异性抑制拓扑异构酶IB 活性,这预示着水飞蓟宾-钒(Ⅳ)配合物有望发展为抗肿瘤靶向药物。
4 异黄酮类
异黄酮的基本骨架为3-苯基色原酮,其配位模式与黄酮类化合物类似,多以5 位羟基与4 位羰基作为结合位点与金属离子进行配位,但由于B 环的位阻效应,异黄酮类金属配合物水氧稳定性往往较差。SPOERLEIN C 等[17]设计、合成了1 种耐水抗氧的染料木素-铜(Ⅱ)配合物(图6),发现其对黑色素瘤518A2[(10.9±1.4) µM]、结 肠 癌HCT-116[(10.4±1.6) µM]以及耐药的宫颈癌KB-V1/Vbl[(6.7±0.5) µM]与乳腺癌MCF-7/Topo[(8.5±1.4) µM]的细胞毒性是染料木素的3~5 倍,并能够有效抑制肿瘤细胞转移。该配合物的抗肿瘤作用不仅与细胞周期阻滞有关,而且与F-肌动蛋白细胞骨架的重塑、E-钙黏蛋白/β-连环蛋白复合体形成增加以及基质金属蛋白酶MMP-2和MMP-9表达减少密切相关,是一种多靶点的抗肿瘤药物。

图6 抗肿瘤类染料木素-金属配合物示例
5 查耳酮类
查耳酮能够与多种主族金属(铍、镁)和过渡金属(钛、钒、铬、钨、锰、铁、钴、镍、铜、锌、钌、钯、镉、汞)络合形成配合物[42-45],其配位模式大致可分为两类:⑴直接利用查耳酮分子中的羰基(图7a)或羰基及A 环邻位羟基(图7b)与金属离子络合,这种类型的配合物通常需要额外使用联吡啶、1,10-菲啰啉等配体来增加结构稳定性;⑵通过与有机胺试剂缩合形成Schiff 碱后再与金属离子进行配位(图7c)。近年来,查耳酮金属配合物在抗肿瘤领域中的应用也呈现了较好的发展趋势。SHIHAB O H[46]利用3-(2-羟基苯基)-1-苯基丙烯酮的1 位羰基与铁(Ⅲ)、铬(Ⅲ)、铜(Ⅱ)、钴(Ⅱ)络合后获得的系列疗效接近顺铂的配合物。KŘIKAVOVÁ R 等[47]将硝酸铜、1,10-菲啰啉以及查耳酮以1∶1∶1 投料比在碱性条件下成功制备了8种查耳酮-铜(Ⅱ)配合物,发现这些铜(Ⅱ)配合物对A2780、G361、HeLa、MCF-7、HOS、A549、HepG2、PC3、22RV1 等肿瘤细胞具有显著的细胞毒性,其IC50值可低至1.1 µM,并且不与顺铂产生交叉耐药性。该类型金属配合物的抗肿瘤作用不仅与拓扑异构酶Ⅰ的抑制有关,而且与入胞方式密切相关。这些铜(Ⅱ)配合物是通过主动运输的方式进入肿瘤细胞而并非如顺铂一般自由扩散,因此能够克服顺铂诱导的交叉耐药性。也有研究[48]显示,查耳酮缩氨基硫脲Schiff 碱的铜(Ⅱ)配合物可通过与DNA 相互作用来诱导HL60、MDAMB-231、HCT-116 等肿瘤细胞凋亡,这也为黄酮类金属抗肿瘤药物的设计提供了新思路。

图7 查耳酮与金属离子的配位模式
6 总结与展望
铂类化疗药物在癌症治疗中的作用举足轻重,但其临床表现却不尽如人意。针对此现状,一些富有创造性的新理念被用于金属抗肿瘤药物的研发,其中就包括了“中药配位化学学说”。与金属离子配位是一种对黄酮进行结构修饰并增强或赋予其抗肿瘤活性的有效途径。本文根据黄酮类化合物的母体结构特点,简单梳理了黄酮类、黄酮醇类、二氢黄酮(醇)类、异黄酮类、查耳酮类金属配合物的配位模式、抗肿瘤活性及其相关作用机制,旨在为黄酮类金属配合物的研制提供参考依据,推动金属药物在癌症治疗领域中的应用。值得注意的是,尽管黄酮-金属配合物的抗癌潜力已初见端倪,但距离临床应用还存在一些亟待解决的关键问题,如黄酮-金属配合物的活性和选择性难以兼得,通常抗肿瘤活性高的配合物对正常细胞的毒性也大;目前这类化合物的抗肿瘤活性研究多是体外实验的结果,有关其在动物水平的药效学、药代动力学及安全性等方面的研究鲜有报道。因此,今后的研究可以从以下两方面进行:其一,结合基因组学、蛋白质组学、生物信息学等方面的技术手段,深入探究黄酮-金属配合物的抗肿瘤作用靶点,完善分子机制,并将其反馈于配合物的研制,以期获得具有肿瘤靶向性的金属抗癌药物;其二,在动物水平对黄酮-金属配合物进行药效学、药代动力学特性与安全性进行评价,并根据相关研究结果进一步改良配合物的稳定性、生物利用度、内化效率等关键技术指标。总之,对黄酮类金属抗肿瘤药物的研究需要超越传统药物化学范畴的视野以及更深入的跨学科合作。

