mRNA 疫苗工程设计要点分析
黄瑛,宋杨
(信息产业电子第十一设计研究院科技工程股份有限公司,成都 610021)
阻止和限制大规模的爆发流行病的关键是针对病原体开发预防性的疫苗[1]。在许多疾病的预防上,传统疫苗(如重组蛋白疫苗、灭活苗、减毒苗)起到了十分重要的作用,但是这些传统疫苗的研发旷日持久,单批生产时间漫长,面对像2019 年末爆发的新型冠状病毒疫情这种急性传染病,难以满足控制疫情的需要,因此需要更加快速、通用性强的疫苗开发平台。
信使核糖核酸(messenger RNA,mRNA)疫苗具有很多得天独厚的优势。制备简洁是mRNA 疫苗脱颖而出的主要原因之一,其活性成分RNA 形式简单,通常以线性DNA 为模板通过体外转录获得,在这个过程中可通过密码子优化、核苷修饰、以及辅助递送系统等方式来提高mRNA 的稳定性及翻译效率,从而形成特异性高、稳定性强的核酸疫苗。mRNA疫苗具有安全性高、均衡免疫性好、研发周期短、生产成本低等优势[2],在应对急性传染疾病方面展现出优异的应用前景,尤其在刚刚过去的新冠疫情期间,mRNA 疫苗以前所未有的速度完成研发并成功上市,市场普遍对该产品应对急性突发传染病持积极态度,mRNA 疫苗已经成为疫苗研究的热点[3],但是目前鲜有关于mRNA 疫苗工程设计的报道。
本文以mRNA 疫苗的产品工艺及生产特性为主线,以我国现行的《药品生产质量管理规范》(2010年修订版)为依据,阐述mRNA 疫苗生产场所的设计要点,供mRNA 疫苗生产企业和设计同行参考。
1 生产工艺简介
mRNA 疫苗的生产工艺包括线性化质粒DNA 原液、mRNA 原液、LNP(Lipid nanoparticle)、分装四个部分。
线性化质粒DNA 原液:从工作菌种库中取菌种,复苏、扩大培养后进行质粒提取,经超滤浓缩、层析等纯化工艺后得到高浓度环形质粒[4],再加入限制性内切酶将环形质粒DNA 线性化,再经过超滤换液等纯化及除菌过滤后得到高浓度无菌线性化质粒DNA原液,最后将线性化质粒DNA 原液分装冻存。
mRNA 原液:将线性化质粒DNA 体外转录为mRNA,然后进行化学修饰、分离纯化后得到高浓度mRNA 原液,再经过超滤换液等纯化及除菌过滤后得到高浓度无菌mRNA 原液,最后将mRNA 原液分装冻存。其中,体外转录(IVT)的本质是酶促多聚反应,这种反应是无细胞体系的生物合成,是一个相对简单的过程[5],同时IVT 相比于传统微生物或细胞培养表达,具有反应时间短、生产成本低等优势。
LNP:将mRNA 原液进行包封/装载、超滤纯化后得到高纯的mRNA 复合物,其中递送系统是LNP 的过程的关键步骤,递送系统目前主要是使用脂质纳米颗粒(LNP)载体,控制mRNA 与脂质成分形成均一、稳定、收率高的mRNA-LNP 复合物的制备方法是均质(高压&微射流)工艺。
分装:将得到的LNP 在制剂车间进行最终除菌过滤,无菌灌装后得到mRNA 制剂成品,贴签包装后入库冻存。
2 产业化设计要点分析
在mRNA 疫苗生产场所的生产质量风险评估过程中,合规高效的厂房设施是避免生产质量风险的最基本也是最重要的前提条件。《药品生产质量管理规范》的核心是最大限度地避免污染、交叉污染以及差错的风险[6]。这就要求:医药工业洁净厂房进出生产区域的人员和物料的出入口需要分别设置;物料传递路线在满足工艺生产流程需要的前提下,尽可能做到顺畅和短捷。合理的空调分区可以有效地控制mRNA 疫苗生产环境的温度、湿度、浮游菌、沉降菌、悬浮粒子等指标,可以有效地避免空气中的气溶胶引发的污染和交叉污染,是确保洁净室的参数符合药品生产质量要求的关键,也可为生产人员提供舒适的工作环境[4]。
本文从工艺布局设计和空调系统设计介绍mRNA 疫苗生产厂房的设计要点,供mRNA 疫苗生产企业和设计同行参考。
2.1 工艺布局设计要点分析
mRNA 疫苗的生产按其产品阶段,可以分为线性化质粒DNA 原液制备单元(质粒发酵区和质粒纯化及线性化区)、mRNA 原液制备单元(IVT 及纯化区、LNP 制备及纯化区)、质粒单元,因为分装车间与常用制剂车间的区别很小,本文重点讨论原液的制备工艺布局,并选取其中一种适用性最广的布局平面进行讨论。图1 是mRNA 疫苗原液的工艺流程图,根据生产的目的产品的不同,可以将IVT 及纯化区和LNP 及纯化区合并成为一个生产区。
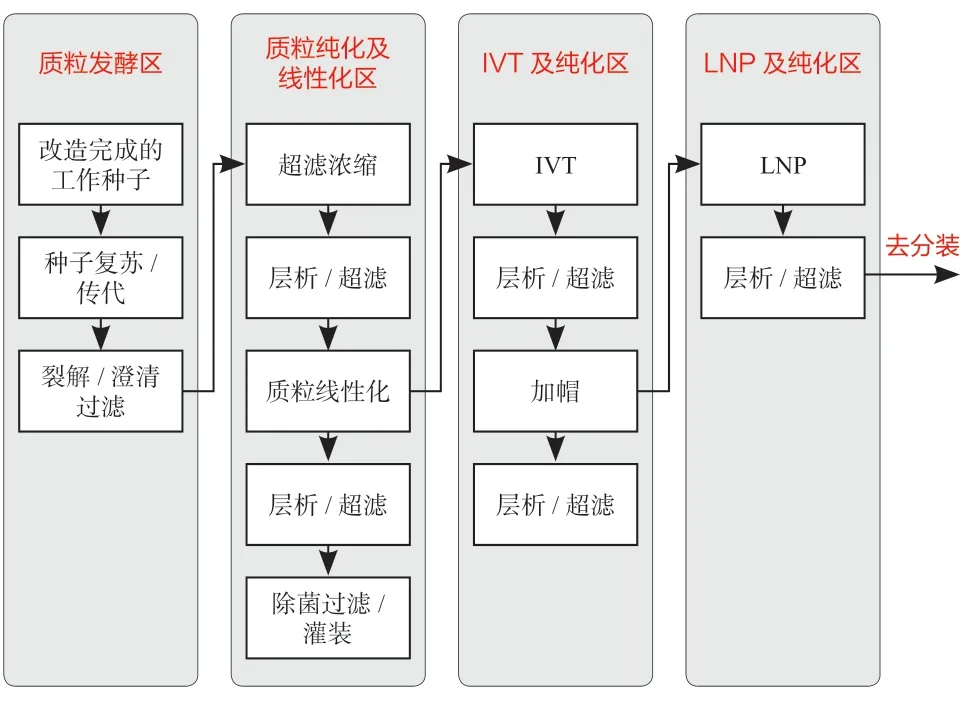
图1 mRNA 疫苗原液工艺流程图Fig.1 Process flow diagram of mrna vaccine concentrate
从生物安全的角度考虑,质粒DNA 原液制备单元的发酵区需要使用大肠杆菌,大肠杆菌是一种非致病性的工程菌株,无法在健康人的消化道中持续克隆,对环境和动植物以及人体的危害是很低的,所以大肠杆菌可以在一级生物安全水平下进行[7]。线性化质粒pDNA 原液制备单元以大肠杆菌的去除为界分为上游发酵区和下游纯化区。mRNA 原液制备单元无细胞体系的生物合成,LNP 制备也不涉及活体微生物,因此这两个单元不需要生物安全防护。
整个mRNA 疫苗的原液工艺布局示意图如图2所示。原液的生产分为质粒发酵、质粒纯化及线性化、IVT 及纯化、LNP 及纯化四个独立的区域,各自独立的人物流,各个区域的人员进出设施独立设置,不建议套更,避免人员串岗;废弃物设施独立设置,质粒发酵区的废弃物需要通过高压灭菌柜消毒后方可离开,这样的设计主要是避免质粒发酵区的活菌污染其他生产区域。
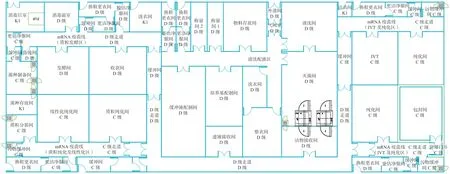
图2 mRNA 疫苗原液工艺布局示意图Fig.2 mRNA vaccine concentrate process layout schematic
质粒发酵和IVT 均为常规细菌发酵和无细胞体系的生物合成车间,是比较传统的生物培养体系,生产质量安全可控,因此工艺布局可采用单走道的设计方式。但是需要注意以下两点:
(1)在LNP 的制备过程中需要使用乙醇,所以这个工艺过程需要设计土建和机电的防爆,同时防爆房间的面积需要控制在整个防火分区或本层面积的5%以内,避免改变建筑的火灾危险性分类[8],降低固定资产投入强度。
(2)整个生产工艺过程中涉及多次纯化,因此在工艺平面设计的过程中需要将缓冲液的配制和暂存尽量靠近使用点,降低工人非生产性劳动强度;同时纯化的工艺房间要充分考虑层析柱和缓冲液袋子的暂存空间,有利于生产的顺利开展。
2.2 空调系统设计要点分析
线性化质粒DNA 原液、mRNA 原液的生产区域,密闭发酵生产部分可以在D 级环境下进行,由于线性化质粒DNA 和mRNA 原液均可除菌过滤,那么纯化部分可在C 级环境下进行,除菌过滤后的原液分装属于无菌操作范畴,需要在C+ISOLATOR 或者B+A 的环境下进行。
优秀的气流组织设计是洁净区保证洁净度的重要条件。各个生产区的气流组织均采用顶送风、对角或四角下侧回的方式。送风通过高效过滤器将洁净风送入房间,回风采用回风管从回风夹道下伸直接与回风口连接,避免回风的二次污染。
mRNA 制备区典型净化空调系统和防爆净化空调系统原理图如图3 和图4 所示。
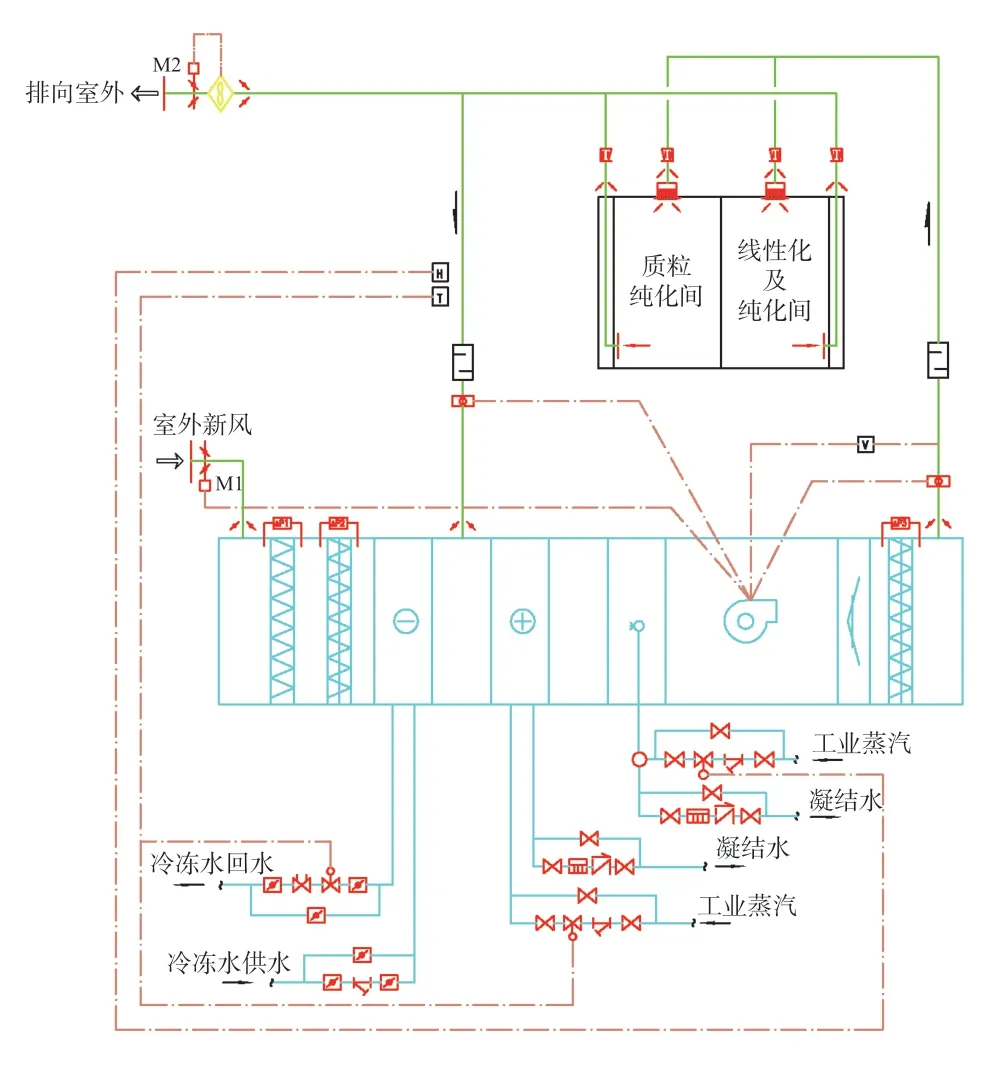
图3 mRNA 制备区典型空调系统原理图Fig.3 mRNA preparation unit clean air-conditioning system schematic
mRNA 制备区净化空调系统温湿度控制:夏季:调节表冷器上的冷盘管的电动二通阀的开启度,调节洁净区内的温度和湿度,其中以湿度为优先级。当出现控制湿度导致洁净室内的温度过低时,调节加热盘管上的电动二通阀的开启度,恢复洁净区内的温度。冬季:调节加热盘管上的电动二通阀的开度,调节洁净区内的温度;同时通过控制加湿器的开度以调节室内湿度。
mRNA 制备区净化空调系统压力控制:在空调系统的各个送风支管上设置定风量阀,回风支管上设置变风量阀,用来控制房间压力。在各级过滤器上设压差报警器,报警极限阻力为:初效过滤器:ΔP=120 Pa;中效过滤器:ΔP=200 Pa;高效过滤器:ΔP=500 Pa。
mRNA 制备区净化空调系统消毒控制:消毒时关闭送排风支管上的电动密闭风阀及送、排风机,在房间里置入消毒剂发生器进行消毒,消毒完毕后打开电动密闭风阀及送、排风机,恢复正常运行。
3 结论及展望
3.1 结论
mRNA 疫苗原液的生产分为质粒发酵、质粒纯化及线性化、IVT 及纯化、LNP 及纯化四个独立的区域,各自独立的人物流,各个区域的人员进出设施独立设置,最大限度地避免污染、交叉污染以及差错的风险。在LNP 的制备过程中需要使用乙醇,防爆房间的面积需要控制在整个防火分区或本层面积的5%以内,降低固定资产投入强度。工艺平面设计的过程中需要将缓冲液的配制和暂存尽量靠近使用点,降低工人非生产性劳动强度。
根据工艺分区,不同的生产阶段设置独立的空调系统。LNP 制备区需设置防爆净化空调系统,空调系统具备正常生产模式和快速消毒模式。
3.2 展望
尽管mRNA 新冠疫苗仍是当前唯一上市的mRNA 产品,但是mRNA 技术可以作为药品生产平台,通过mRNA 编码出所有需要的蛋白,生产人类需要的疫苗和治疗性药物。
国家《“十四五”医药工业发展规划》明确提出加快建立核酸疫苗技术平台,推动相关产品的开发和产业化,可见mRNA 技术平台的突破是大势所趋。
整个mRNA 的生产工艺中,mRNA 的递送技术仍处于不断的摸索中,今后该技术的提升空间很大,相信随着不断的研究和应用,递送技术将逐步完善稳定。另一方面,mRNA-LNP 配方体系仍需要不断地优化以降低mRNA 药品对储存和运输温度的要求,有利于mRNA 药品的流通和应用。

