血清外泌体LncRNA PCAT1 在早期非小细胞肺癌诊断中的潜在价值研究
柳秋霞,蔡云祥,李勇,万诚诚,嵇龙飞,胡燕勤
肺癌是全球癌症相关死亡的主要原因之一,在所有的肺癌患者中,非小细胞肺癌(NSCLC)超过80%[1]。由于缺乏敏感和特异的生物标志物,大多数患者确诊时已处于晚期,复发率高,5 年总生存率低于15%[2]。因此,迫切需要开发新的、有效的早期诊断标志物。外泌体是一种细胞外膜囊泡,直径为30~150 nm。DNA、RNA 和蛋白质等生物活性因子可被包裹到外泌体中,进入细胞外环境[3]。据报道,RNA 是肿瘤细胞衍生的外泌体的主要成分,可以反映肿瘤进展和肿瘤细胞的动态过程[4]。而且外泌体膜可以保护各种类型的RNA 免受循环中的RNase酶降解。近年来,外泌体作为一种新的递送系统和治疗靶点,在医学领域得到了广泛的研究。其被认为是一种非侵入性液体活检技术,有助于恶性肿瘤的诊断[5]。长链非编码RNA(LncRNA)是一类大小超过200 个核苷酸的异质转录物,没有编码潜力[5]。其在血清外泌体中含量丰富,并被认为是肿瘤发生和发展的关键因素,包括NSCLC[6]。本研究探索外泌体lncRNA在NSCLC早期诊断中的值,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2017 年1 月至2020 年3 月湖州市第一人民医院收治的206 例NSCLC 患者临床资料。纳入标准:符合2015 年世界卫生组织肺肿瘤分类[7],并经组织病理学诊断为NSCLC,且为首次确诊患者。排除标准:(1)入院前接受化疗或放疗的患者;(2)合并其他恶性肿瘤、传染性疾病者;(3)合并严重心、肝、肾等重要脏器功能障碍者。另选性别和年龄与NSCLC 患者相匹配的健康体检者200 例。将所有样本按3 ∶1 比例随机分为训练集(50 例NSCLC 和50 例健康对照)和验证集(156 例NSCLC 和150 例健康对照),具体特征见表1。另外,为了鉴定NSCLC 中失调的外泌体LncRNA,选择3 例NSCLC 患者[男2 例,女1 例;年龄(59.0±5.57)岁]和3 例健康对照个体[男2 例,女1例;年龄(60.0±7.0)岁]的血清样本。本研究获得了湖州市第一人民医院医学研究与临床试验伦理委员会批准,患者知情同意。

表1 训练集和验证集参与者人口统计学特征和病理特征比较
1.2 方法
1.2.1 血清外泌体分离和鉴定 通过两步离心方案将研究对象的5 ml 静脉血分离为血清和细胞沉淀(3 800 r/min,4 ℃离心5 min;15 000 r/min,4 ℃离心5 min)。将血清上清液转移到不含RNase 的管中以供进一步检测。使用100l 总外泌体分离试剂(美国Invitrogen)从500l 血清中分离外泌体,混合物以15 000 r/min 离心10 min 后,将含有外泌体的颗粒重悬于200l 磷酸盐缓冲液(PBS)中。(1)通过透射电子显微镜(TEM)观察外泌体的形态,TEM型号:H-7600 型(日本Hitachi)。(2)通过纳米粒子跟踪分析(NTA)评估分离的外泌体的大小分布和浓度,纳米颗粒追踪分析仪型号:ZetaView PMX 110(德国Particle Metrix)。(3)通过蛋白印迹分析检测外泌体标记蛋白肿瘤易感基因101 蛋白(TSG101)、热休克蛋白70(HSP70)和溶酶体颗粒糖蛋白63(CD63)抗体(1 ∶1 000,美国Santa Cruz Technologies)。
1.2.2 血清外泌体RNA 提取 使用HiPure 外泌体RNA试剂盒(德国Qiagen)分离总外泌体核糖核酸,使用miRNeasy Mini 试剂盒(Qiagen)纯化外泌体RNA,使用(美国Thermo Fischer Scientific)对RNA 纯度和浓度进行定量。
1.2.3 高通量测序(RNA-Seq)及LncRNA筛选 外泌体RNA 测序委托RiboBio 生物技术公司(中国广州)完成。首先根据NEBNext 超定向RNA 文库制备试剂盒的标准方案,将外泌体RNA逆转录并扩增为双链cDNA,然后进行衔接子连接和富集。通过Agilent 2200 Tape 工作站(美国安捷伦)和荧光计(美国Life Technologies)验证文库产品,在HiSeq3000 配对末端流动槽上稀释,然后测序(HiSeq3000 系统,2×150 bp)。用TopHat 软件2.1.1 版将测序数据与内参基因进行比较,表达水平以每千个碱基长度中所包含的测序片断数(FPKM)计算。采用Cufflinks 法量化基因表达值,筛选差异基因。本研究中差异基因的筛选标准为错误发现率<0.05,基因表达值计算为log2(FPKM)。
1.2.4 实时荧光定量聚合酶链式反应(qRT-PCR)检测血清外泌体lncRNA PCAT1(exoPCAT1) 使用MMLV 转录酶(美国Promega)从500 ng 血清外泌体RNA 中产生第一链cDNA,在CFX96 qRT-PCR 检测系统(美国Bio-Rad)上进行qRT-PCR,使用(Ct是阈值周期)公式测量lncRNA PCAT1 表达水平。PCR 反应条件:95 ℃预变性30 s,1 次循环;95 ℃变性10 s,59.5 ℃退火30 s 和72 ℃延伸90 s,42 次循环。引物序列:LncRNA 前列腺癌症相关ncRNA 转录物1(PCAT1):5’-TTTGAGGATGCGGGTGAA-3’(前向)和5’-ATGAGGAAGTGGACGAGATG-3’(后向);内参甘油醛-3-磷酸脱氢酶(GAPDH):5’-GACTCATGACCACAGTCCATGC-3’(前向)和5’-AGAGGCAGGGATGATGTTCTG-3’(后向)。
1.2.5 血清肿瘤生物标志物检测 使用Elecsys 电化学免疫测定法(美国Roche),在Cobas 8000 模块化分析仪(美国Roche)中检测血清癌胚抗原(CEA)水平,其正常值范围为0 ~5 ng/ml。
1.3 统计方法 使用SPSS 25.0 统计软件进行数据分析。正态分布计量资料以均数±标准差表示,采用独立样本t 检验;偏态分布计量资料以M(P25,P25)表示,组间比较采用Mann-Whitney 秩和检验;计数资料以百分比表示,组间比较采用检验;绘制受试者工作(ROC)曲线分析exoPCAT1 对NSCLC 的诊断效能。P <0.05 表示差异有统计学意义。
2 结果
2.1 血清外泌体鉴定 从NSCLC 患者和健康对照者的血清外泌体表现出相似的典型脂质双层膜形态(图1a),囊泡颗粒的直径主要在30 ~200 nm,NSCLC患者提取的外泌体的总浓度为26.38×106/ml,健康对照组为18.41×106/ml(图1b);此外,蛋白印迹分析表明,在富含外泌体的沉淀中存在特异性外泌体标记蛋白(TSG101、HSP70 和CD63)(图1c)。两组均成功从血清中分离出了外泌体。

图1 两组血清外泌体特征鉴定
2.2 RNA-seq 及LncRNA 筛选 对3 例NSCLC 患者和3 例健康对照者的血清样本表达谱进行标准化后,箱式图证明了该微阵列的良好质量(图2a)。两组样本间的热图,共发现433 781 个外泌体LncRNA在NSCLC和健康对照组血清样本之间差异表达(变化倍数>1.5,P <0.05,图2b)。其中,与健康对照组血清样本相比,NSCLC血清样本中405 个外泌体LncRNA 上调,376 个外泌体LncRNA 下调(图2c)。
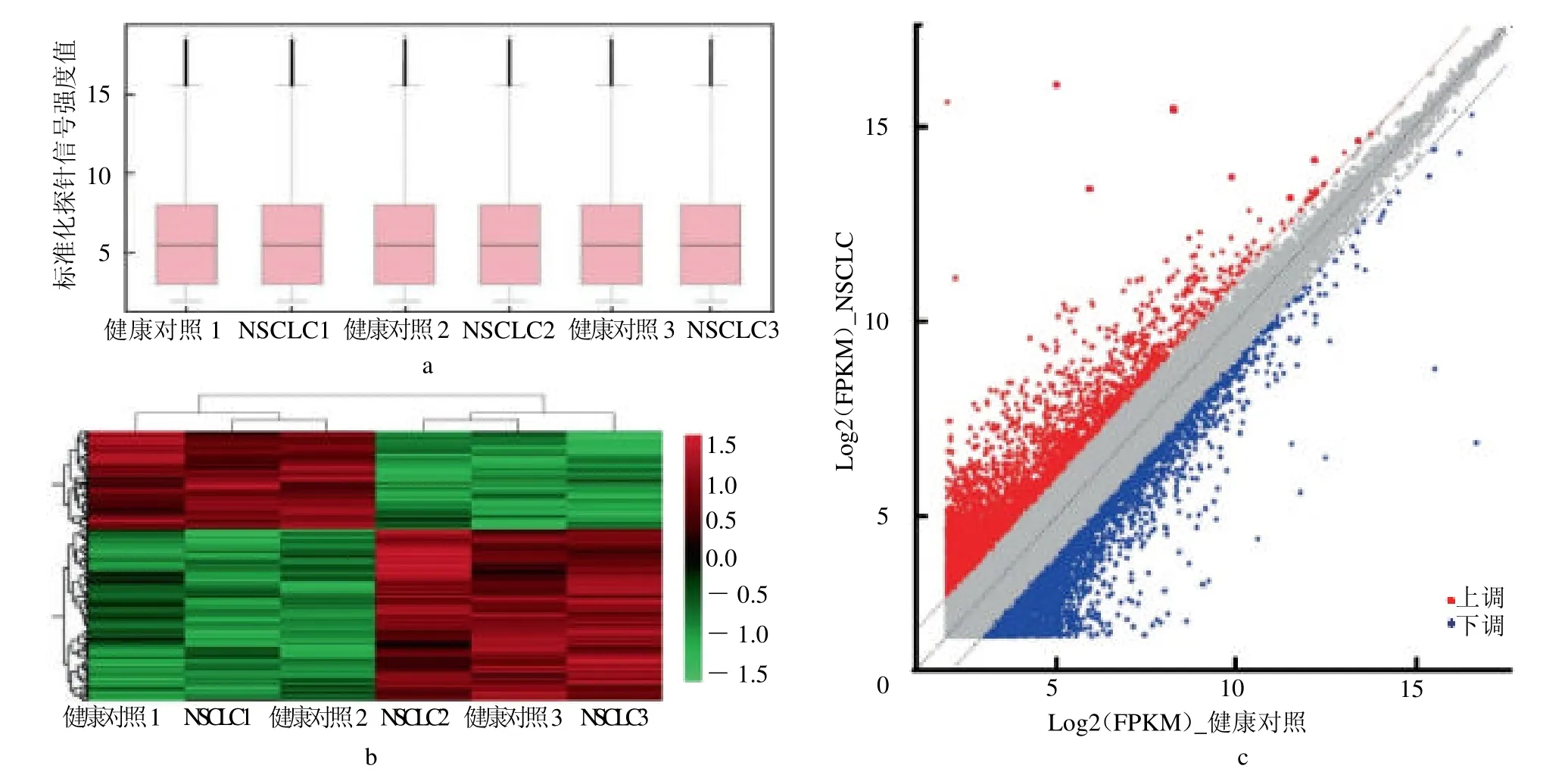
图2 血清样本中外泌体LncRNA 微阵列的质量控制和基因scatter 图
2.3 训练集中外泌体LncRNA 临床验证及血清exoPCAT1 表达分析 在训练集中,利用qRT-PCR 法对差异性表达最显著的前20 个外泌体LncRNA(10个上调和10 个下调外泌体LncRNA)进行检测,结果与RNA-seq 数据一致(P >0.05,图3a)。其中exoPCAT1 在NSCLC 血清样本中较健康对照组过表达[2.24(1.45,3.44)vs 0.92(0.57,1.30),Z=5.667,P<0.05,图3b],其他外泌体LncRNA 仅显示出微弱的差异性表达。
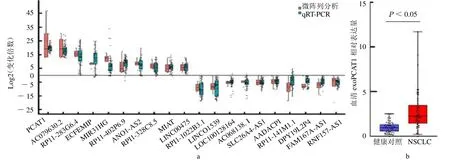
图3 qRT-PCR 法验证训练集血清样本中外泌体LncRNA 表达量
2.4 验证集中血清exoPCAT1 表达分析 验证集NSCLC 组exoPCAT1 相对表达量亦高于健康对照组[2.09(1.32,3.18)vs 0.84(0.56,1.41),Z=10.112,P<0.05,图4a]。exoPCAT1 诊断NSCLC 的AUC 为0.838(95%CI 0.795 ~0.880,图4b)。对于早期(I ~II期)和血清CEA正常(<5 ng/ml)的NSCLC患者,exoPCAT1 也有较高的诊断价值,AUC分别为0.789(95%CI 0.737 ~0.841,图4c)和0.728(95%CI 0.661~0.795,图4d)。
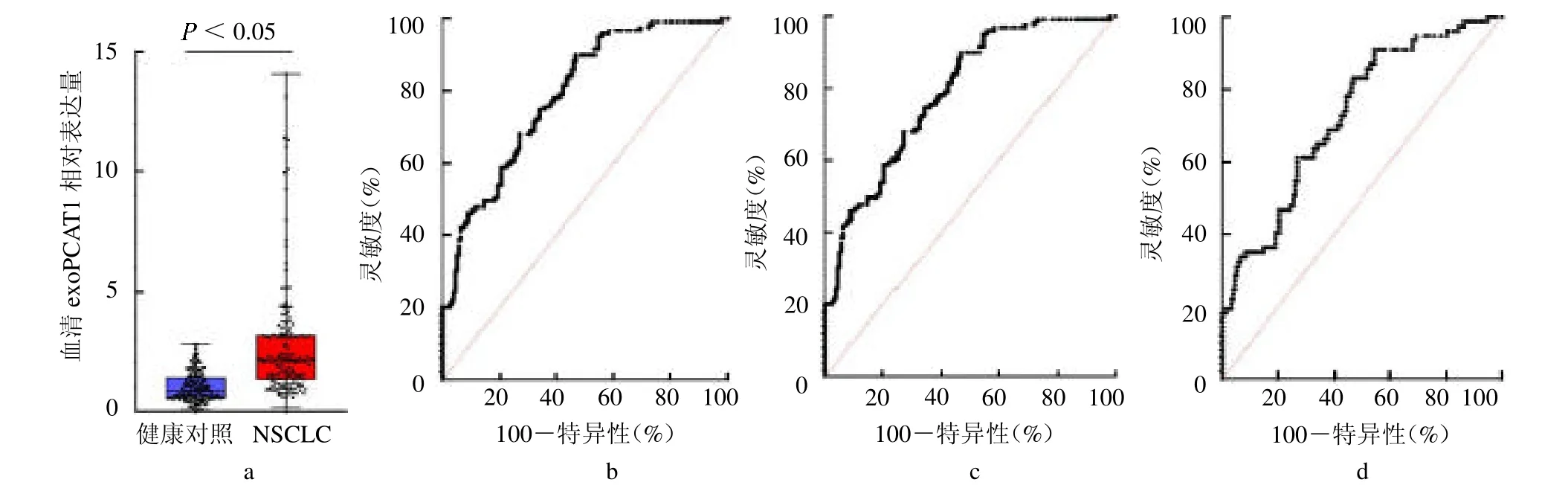
图4 验证集血清样本中exoPCAT1 对NSCLC 的诊断价值
2.5 验证集中血清exoPCAT1 表达与临床病理特征的关系 根据验证集中exoPCAT1 表达中位值,将患者分为高表达组(>2.09)或低表达组(≤2.09)。在验证集中,血清exoPCAT1 表达与疾病进展有关,exoPCAT1 高表达的NSCLC 患者TNM III ~IV 期、T1 ~T2 分期及淋巴结转移的比例更高(均P <0.05),见表2。

表2 验证集中血清exoPCAT1 表达与临床病理特征的关系 例(%)
3 讨论
外泌体是一种内源性的纳米级细胞外脂质双层囊泡,人体中几乎所有类型的细胞均能产生外泌体,其包含丰富的生物活性成分,可作为疾病的候选生物标志物[3]。有研究表明,LncRNAs 在血液外泌体中是稳定的,对NSCLC 有诊断潜力。本研究RNASeq 和qRT-PCR 数据均表明,血清exoPCAT1 在NSCLC 中表达上调[8]。ROC 曲线数据支持exoPCAT1 可以区分早期(I~II期)及CEA水平正常(<5 ng/ml)的NSCLC 患者。
外泌体具有独特的稳定性,并且可动态检测,特别是非编码RNAs已成为有希望的肿瘤生物标志物。本研究发现LncRNA PCAT1 存在于血清外泌体中,并通过RNA-Seq 显示在NSCLC 中表现高水平。LncRNA PCAT1 被发现是一种高度保守的LncRNA,位于20 号染色体上,含有两个外显子。有研究发现,PCAT1 在许多人类癌症中失调,与致癌作用、临床病理特征和预后有关[9]。PCAT1 被证实在NSCLC 中上调,并促进细胞增殖和转移。有研究发现,LncRNA PCAT1 可通过调节SOX2 启动子区来诱导SOX2 的表达,进而抑制下游cGAS/STING 途径调节NSCLC 中的细胞毒性T 细胞浸润,从而产生免疫抑制性肿瘤微环境[10]。另外,生物信息学和表达相关性分析显示[11],PCAT1 和dyskerin 伪尿苷合成酶1(DKC1)蛋白(一种RNA 结合蛋白)之间存在潜在的相互作用。此外,PCAT1 可激活NSCLC细胞中的血管内皮生长因子/蛋白激酶B/Bcl-2/caspase9 通路,进而影响细胞生物学过程,包括增值、侵袭、迁移等[11]。抑制LncRNA PCAT1 可能是NSCLC一种潜在的治疗策略,对抗肿瘤和癌症靶向治疗有重要意义。这也从机制方面解释了NSCLC 患者血清exoPCAT1 水平普遍升高的原因,且exoPCAT1 高表达与疾病进展有关,高表达者TNM III ~IV 期、T1~T2 分期及淋巴结转移的比例更高(均P <0.05)。
手术是早期NSCLC 最有效的治疗方法,然而,多数NSCLC 患者诊断时已是晚期,只有不到30%的患者有明确的手术指征[12]。早期筛查和早诊早治对降低NSCLC 死亡率有重要作用[13]。临床中常规的检查手段如MRI 或CT 成本过高,且与高假阳性率相关;而肿瘤标志物为临床决策提供了补充的风险评估[14-15]。NSCLC 患者显示出高水平的肿瘤标志物CEA,而它们在早期没有特异性过表达[16]。本研究发现exoPCAT1 在早期NSCLC患者血清中已经过表达,在区分早期NSCLC患者与健康对照人群方面具有可靠的临床效能,显示出令人满意的诊断标志物潜力。
综上所述,血清exoPCAT1 有望成为NSCLC的非侵入性生物标志物,为NSCLC的早期诊断和药物治疗靶点提供了新的视角。本研究也存在一些局限性。首先,样本量较少,需增加样本量以获得更可靠的结果;其次,进一步进行LncRNA PCAT1 的lncRNA 验证,证实LncRNA PCAT1 在NSCLC 显著差异表达的准确性;最后LncRNA PCAT1 参与NSCLC 进展的作用机制以及与临床治疗的关系也值得探索。
利益冲突 所有作者声明无利益冲突
作者贡献声明 柳秋霞:实验操作、论文撰写、整理数据、统计学分析;蔡云祥、李勇:收集数据、整理数据、统计学分析;万诚诚、嵇龙飞:语言润色、格式修改;胡燕勤:研究指导、论文修改、经费支持

