基于临床-影像组学列线图模型对局部晚期宫颈癌同步放化疗后复发和无病生存率的预测价值
季中,王高波,项万青
局部晚期宫颈癌(LACC)是预后相对较差的类型,接受同步放化疗(CCRT)后仍有约1/3 的患者出现局部复发和远处转移,无病生存率(DFS)明显下降[1]。因此,探索早期预测LACC 患者CCRT 后复发和DFS 的标志物已成为临床研究热点。体素内非相干运动扩散加权成像(IVIM-DWI)是一种具有多b 值DWI 的双指数模型磁共振成像技术,可准确反映肿瘤组织的细胞密度和微循环灌注情况,已成功应用于多种类型肿瘤的良恶性鉴别、术前分期、盆腔淋巴结转移评估和预后评价[2]。放射组学是一种图像后处理技术,可通过图像纹理分析(TA)提取大量与肿瘤内在异质性、侵袭性和不可见性相关的放射组学特征,进而揭示肿瘤的时空异质性,识别与肿瘤复发和预后相关的放射特征[3]。目前两种技术在结肠癌的复发转移和预后评估中有了较好的应用[4],但在LACC 中的应用研究少见。本研究旨在探讨临床因素、IVIM-DWI 参数和MRI 衍生的放射组学用于预测LACC 患者CCRT 后的局部复发和DFS,建立可视化的列线图以指导临床实践,现报道如下。
1 对象与方法
1.1 研究对象 回顾性收集2020 年1 月至2022 年1 月丽水市人民医院确诊LACC 患者并接受CCRT共152 例为研究对象。纳入标准:(1)年龄>18 岁;(2)符合LACC 的影像学和病理学诊断标准[5],国际妇产科联合会(FIGO)分期为IB ~IVA;(3)符合CCRT 应用指征,均康复出院;(4)顺利完成IVIMDWI 和放射组学分析,图像清晰可保存;(5)临床和随访资料完整。排除标准:(1)既往已接受手术切除、新辅助放化疗;(2)合并其他部位原发恶性肿瘤;(3)中途自行更改用药方案或剂量;(4)合并严重基础疾病,如肝肾功能障碍。本研究经丽水市人民医院科研伦理委员会审批通过。
1.2 方法
1.2.1 分组方法 将152 例患者以2∶1 随机分为建模集108 例与验证集44 例,随访截止时间为2023年3 月,中位随访时间27.0 个月。以局部复发和DF S 作为终点事件。局部复发定义为CCRT 后6 个月内肿瘤完全缓解,6 个月后CT、MRI或病理诊断为局部复发或远处转移。DFS 定义为从肿瘤完全缓解到首次局部复发、远处转移、死亡或最后一次随访时间。
1.2.2 磁共振检查 CCRT 前采用IVIM-DWI 测量ADC、D 和f 值,轴位T2WI 图像进行影像组学分析,得出R 评分。采用3.0T MRI扫描仪(GE Signa HDXT型,GE Healthcare,USA),配套相控阵8 通道灵敏度编码腹部线圈。患者取仰卧位,控制呼吸节奏,扫描覆盖整个骨盆,从髂嵴上边缘到联合下边缘。常规完成轴向T1、轴向T2、轴向T2脂肪抑制、矢状T2和轴向IVIM-DWI 扫描,各序列扫描参数见表1。其中IVIM-DWI具有10 个b值(分别为0、10、20、50、100、200、400、800、1 200、2 000 s/mm2)。对比剂为钆二胺(GE Healthcar),剂量为0.1 mmol/kg,流速为2 ml/s。

表1 MRI 各序列扫描参数
后处理:IVIM-DVI序列选取肿瘤直径在横截面最大的切片层面,b 值为800 s/mm2,在GEAW4.5 工作站上自动勾勒感兴趣区域(ROI),必要时候进行人工校准,参考轴向T2WI,尽量避免坏死、出血和变性区域。参数测量3 次取平均值。由本院经验丰富的放射科医师独立完成。
放射组学纹理分析:将轴位T2WI 图像以DICOM 格式从PACS 系统导入ITK-SNAP 软件,由高级放射科医师逐层描绘肿瘤的ROI,并将其融合到感兴趣体积(VOI)中提取三维放射组学特征。将原始图像和VOI 导入AK 软件自动生成放射组学参数。最后评估IVIM-DWI 参数和纹理分析中ROI 在观察者间和观察者内的重复性,以组内相关系数(ICC)表示,ICC≥0.8 提示重复性良好[6]。
1.2.3 临床治疗和随访 治疗方案采用体外放射治疗(EBRT)+腔内近距离放射治疗(ICBT)+同时进行含铂化疗。EBRT 分割剂量1.8 ~2.0 Gy,靶区剂量45.0 ~50.4 Gy/25 ~28 次。当EBRT 剂量达到40.0 Gy 时,开始ICBT,总剂量为30 Gy,每天为6 Gy。化疗在放射治疗第1 天开始,采用30 ~40 mg/m2顺铂/奈达铂方案,每周1 次,共5 次。
随访:所有患者通过门诊、住院复查或电话联系进行长期随访。CCRT 后2 年内每3 ~6 个月进行一次随访,第3 年至第5 年每6 ~12 个月随访一次,5 年后每年随访一次。随访检查包括病史采集、妇科检查、液体薄层细胞学检查、尿液和粪便常规、肿瘤标志物、胸部CT、腹盆超声、CT 或MRI 以及其他必要的检查。对所有患者进行随访,直到出现复发、死亡或达到随访截止时间。
1.3 观察指标 比较患者临床资料、IVIM-DWI 参数和放射组学评分,多因素Cox 回归分析筛选局部复发和DFS 的危险因素,并构建列线图模型。临床资料包括患者年龄、FIGO 分期、血清鳞状细胞癌抗原(SCC-Ag)、肿瘤最大直径、局部淋巴结转移(LNM)、EBRT 剂量、ICBT 剂量、2 Gy 等效剂量(EQD2)、化疗剂量、放疗时间,根据线性二次型形式,使用10 Gy 肿瘤组织的- 计算EQD2。上述资料均来源于患者的电子病历系统。
1.4 统计方法 采用SPSS20.0 统计软件进行分析,计量资料以均数±标准差表示,采用独立样本t检验,计数资料采用检验;多因素Cox 回归分析筛选危险因素,采用逐步后退法;采用R软件建立列线图模型,受试者工作曲线(ROC)计算曲线下面积(AUC),Hosmer-Lemeshow 检验评估模型的拟合效果。P <0.05 表示差异有统计学意义。
2 结果
2.1 建模集与验证集临床资料比较 建模集共记录37 例复发(34.3%,37/108)和43 例DFS(39.8%,43/108),验证集记录17 例复发(38.6%,17/44)和21例DFS(47.7%,21/44),建模集与验证集临床资料差异均无统计学意义(均P >0.05),见表2。

表2 建模集与验证集临床资料比较
2.2 建模集中复发组间与DFS 组间临床资料比较建模集复发组肿瘤FIGO 分期III ~IVA、D 和f值以及R1 评分均升高,而EBRT剂量和EQD2 均减少(均P <0.05)。DFS 组III ~IVA、LNM、ADC、D和f 值以及R2 评分均升高,而EBRT 剂量减少(均P <0.05),见表3。
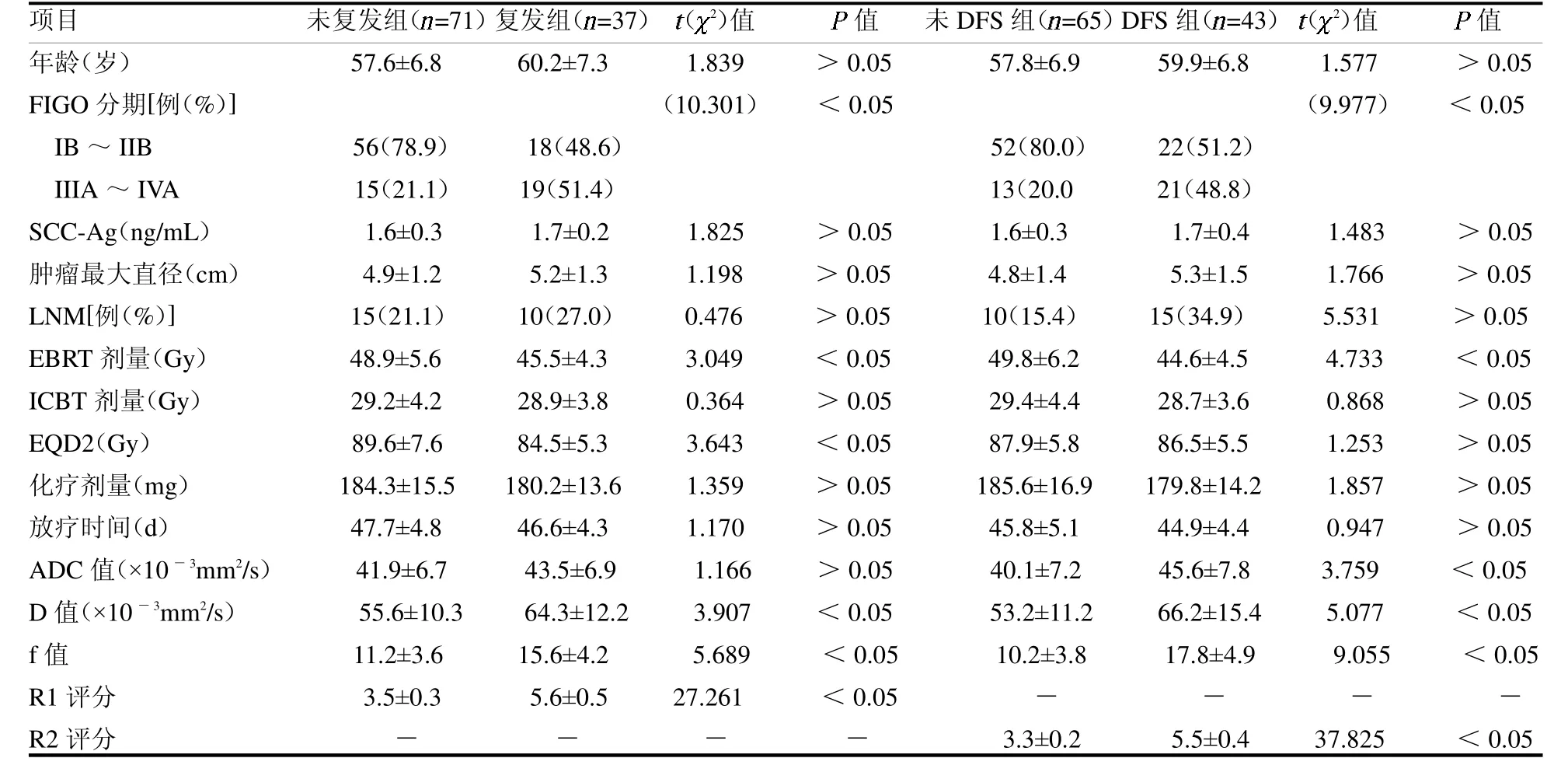
表3 建模集中复发组间与DFS 组间临床资料比较
2.3 LACC 患者CCRT 后复发和DFS 的危险因素分析 Cox 回归分析显示,EBRT 剂量、f 值和R1 评分是影响局部复发的独立危险因素(均P <0.05),EBRT 剂量、f 值和R2 评分是影响DFS 的独立危险因素(均P <0.05),见表4。

表4 LACC 患者CCRT 后复发和DFS 的危险因素分析
2.4 建立预测局部复发和DFS 的列线图模型 R软件分别建立预测复发和DFS 的列线图模型,总分均为220 分,见图1。以局部复发列线图举例说明,假如一位患者EBRT 剂量为44 Gy,对应分值为48分;f 值为16,对应分值为70 分;R1 评分为6,对应分值为88 分;各项相加得到总分为206 分,对应风险远大于0.999,提示局部复发的概率极高。

图1 预测LACC 患者CCRT 后局部复发和DFS 的列线图模型
2.5 列线图预测复发和DFS 的效能验证 ROC 曲线显示,列线图预测建模集与验证集局部复发的AUC 分别为0.902(95%CI 为0.846 ~0.953,P <0.05)和0.865(95%CI 为0.802 ~0.911,P <0.05),见图2。列线图预测建模集与验证集DFS 的AUC分别为0.876(95%CI为0.821 ~0.903,P<0.05)和0.813(95%CI 为0.775 ~0.876,P <0.05),均提示有较好的预测准确性,见图3。Hosmer-Lemeshow 检验提示列线图预测建模集与验证集局部复发的概率与实际发生率有较好的吻合度(=6.354、5.967,均P>0.05)。预测DFS 的概率与实际发生率也有较好的吻合度(=8.365、7.269,均P >0.05)。

图2 列线图预测LACC 患者CCRT 后局部复发的ROC 曲线
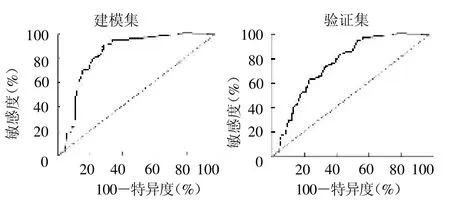
图3 列线图预测LACC 患者CCRT 后DFS 的ROC 曲线
3 讨论
局部复发和DFS 是影响患者生存预后的重要因素,以往研究发现,临床分期、LNM 和SCC-Ag 等与宫颈癌的复发密切相关[7]。本研究综合分析了常规临床因素、IVIM-DWI 参数和放射组学评分对预测复发和DFS 的作用,发现EBRT 剂量显著减少与复发和DFS 均密切相关,且是其重要的预测指标。有研究显示,当EBRT 剂量高于45.5 Gy 时,LACC的DFS 更长[8]。然而,更高剂量的EBRT 并不意味着更好的临床疗效,可能会产生相反的效果。IVIMDWI和放射组学在揭示肿瘤的微观特征方面是互补的。IVIM-DWI 可以揭示肿瘤内在的生物学变化,这先于常规MRI 的形态学变化,而放射组学可以揭示肿瘤的侵袭潜能[9]。
IVIM-DWI参数中的D 值主要反映肿瘤细胞的密度,f 值则主要反映肿瘤微循环灌注的比例,两者越高提示肿瘤细胞增殖越活跃,分化越差,因此更容易复发[10]。目前已在急性髓系白血病和鼻咽癌复发患者中发现D 值和f 值升高的现象[11-12]。本研究发现,接受CCRT 后复发的LACC 患者IVIM-DWI 参数中D 值和f 值明显升高。笔者推测一方面是微循环丰富的肿瘤组织往往恶性程度更高,分化程度更低,复发的可能性更大,预后更差。另一方面,丰富的血液供应使肿瘤细胞对放化疗更敏感,更有可能出现隐匿性完全缓解,以后更容易复发。Li 等[13]发现,f值与缺氧诱导因子-1(HIF-1 )表达呈正相关,HIF-1 能够促进组织损伤修复、肿瘤增殖和代谢以及上皮-间质转化,导致肿瘤复发和DFS 缩短。这提示IVIM-DWI 参数对CCRT 后宫颈癌复发和DFS具有较高的预测价值。
肿瘤复发不仅与肿瘤微环境有关,还受到异质性的影响,不仅包括基因表达和生长环境差异产生的空间异质性,还包括治疗、营养、激素状态等因素影响的时间异质性[14]。因此,为了充分揭示宫颈癌的时空异质性,本研究同时提取了CCRT 前后T2WI上肿瘤的三维放射组学特征,在预测宫颈癌分期和病理分级、淋巴结转移、治疗反应以及生存预后等方面具有潜在的应用前景。三维纹理分析作为一种“虚拟活检”技术,可以对整个肿瘤的空间异质性进行无创评估,而不受病理采样的限制,并且具有更高的重复性。
本研究通过Cox 回归分析筛选出EBRT 剂量、f 值和放射组学评分均是影响LACC 患者CCRT 后复发和DFS 的独立危险因素。综合上述指标进一步构建列线图模型,经多维度验证具有较好的区分度和校准度。列线图的应用将临床因素、IVIM-DWI参数和放射组学相互补充,在预测宫颈癌复发和DFS 方面具有良好的应用价值。
本研究也有存在一些局限性:(1)人工设定ROI时,测量误差不可避免,容易将坏死、变性、出血区域划定在内,从而影响测量。(2)随访时间较短,无法评估IVIM-DWI及放射组学参数对宫颈癌CCRT 远期预后及生存的预测价值。(3)本研究为单中心回顾性分析,未来的前瞻性研究需要扩大样本量,进一步验证模型的准确性。
利益冲突 所有作者声明无利益冲突
作者贡献声明 季中:实验操作、论文撰写;王高波、项万青:数据整理、统计学分析

