结核性脑膜炎患者外周血及脑脊液中miRNA-155、miRNA-125b、sCD163 表达的临床意义
王霞 张利利 李晓阳 牛文一 李明瑛 韩伟
结核性脑膜炎(tuberculous meningitis,TBM)是由结核分枝杆菌(mycobacterium tuberculosis,MTB)侵入蛛网膜下腔引起的中枢神经系统(central nervous system,CNS)感染性疾病,致残率、死亡率均较高[1]。由于TBM 患者的临床表现缺乏特异性,因此临床误诊率较高。既往临床多根据患者的临床表现、脑脊液(cerebrospinal fluid,CSF)抗酸染色、结核分枝杆菌培养等对TBM 进行诊断,但CSF 抗酸染色、结核分枝杆菌培养结果诊断MTB的敏感性不佳,培养所需时间长,故二者在诊断该病上具有一定的局限性[2]。随着第二代测序技术的推广应用,TBM 病原体的检测效率大大提高,但仍难以鉴别TBM 和病毒性脑膜炎(viral meningitis,VM)。近年来,微小RNA(microRNA,miRNA)作为一种新型的疾病诊断标志物在临床中颇受关注。miRNA-155、miRNA-125b均为miRNA家族成员,在细菌、病毒等感染性疾病的进程中发挥着 重要作用[3]。可溶性CD163(soluble CD163,sCD163)为CD163 的可溶形式,可参与机体炎症、免疫反应。对此,本研究检测TBM 患者外周血及CSF 中miRNA-125b、miRNA-155、sCD163 的表达,分析其与病情严重程度的关系,以期为临床诊治TBM 提供参考,报道如下。
1 对象与方法
1.1 对象
选取2018 年1 月至2023 年1 月于新乡医学院第一附属医院183 例TBM 患者作为研究对象(TBM 组),其中男性111 例,女性72 例;年龄36~59 岁,平均(47.35±5.34)岁;体质指数(body mass index,BMI)20~25 kg/m2,平均(22.51±1.22)kg/m2;临床表现:发热146 例(79.78%)、头痛150 例(81.97%)、呕吐119 例(65.03%)、厌食与体重减轻108 例(59.02%)、颈抵抗100 例(54.64%)、神志改变56 例(30.60%)、颅神经损害43 例(23.50%)。纳入标准:①符合《2019 中国中枢神经系统结核病诊疗指南》[4]中TBM 有关诊断:患者伴一项或多项TBM 典型的症状或体征,影像学检查脑组织疑似灶或肺部有结核病变,CSF TBM 培养阳性;②成年患者,年龄18~78 岁。排除标准:①非TBM 患者;②发病时间>2 周,入院前曾接受过抗结核、抗病毒、糖皮质激素等治疗;③入院前接受过抗结核治疗;④无法排除其他原因的神经系统疾病者;⑤妊娠或哺乳女性;⑥合并恶性肿瘤;⑦心肺肝肾严重障碍者;⑧精神疾病史。另选取60 例原发性头痛患者作为对照组,其中男性31 例,女性29 例;年龄33~58 岁,平均(45.88±6.01)岁;BMI 18.5~26.0 kg/m2,平均(22.32±1.67)kg/m2。纳入标准:①性别、年龄与TBM 组相匹配;②体格检查未发现脑膜刺激征阳性体征,CSF 及相关辅助检查各项指标均为正常值。排除标准同TBM 组。两组患者在性别(χ2=1.503)、年龄(t=1.789)、BMI(t=0.947)上比较差异无统计学意义(P>0.05),具有可比性。本研究经院伦理委员会批准,所有入选对象均签订知情同意书。
1.2 方法
1.2.1 TBM 组分组
参考英国医学研究委员会分级标准[5]和格拉斯哥昏迷评分(glasgow coma scale,GCS)[6]对TBM 组患者进行病情评估和临床分期:Ⅰ期:无局灶神经系统症状,且GCS 评分15 分;Ⅱ期:有或无局灶神经系统症状,GCS 评分为10~14 分;Ⅲ期:GCS 评分<10 分。
1.2.2 标本采集
取两组患者入院次日空腹静脉血5 mL,不抗凝,以3 000 rpm 的转速,15 cm 的离心半径离心10 min 后取血浆,另外行无菌腰椎穿刺取CSF 3 mL,以1 000 rpm 的转速、8 cm 的离心半径离心5 min 后取上清,分别用于外周血及CSF 中miRNA-125b、miRNA-155、sCD163 测定。
1.2.3miRNA-155、miRNA-125b检测
采用逆转录聚合酶链反应(RT-PCR)测定外周血及CSFmiRNA-155、miRNA-125b表达水平。采用苯酚法提取总RNA(miRNA-155、miRNA-125b提取试剂:miRNAprep Pure FFPE Kit 离心柱型,目录号:DP502,北京万特生物公司产品),用序列检测系统(ABI 公司产品)合成cDNA(miRNA-155、miRNA-125b逆转录试剂:miRcute Plus miRNA First-Strand cDNA Synthesis Kit,目录号:KR211,北京万特生物公司产品),采用荧光定量PCR 仪(美国Bio-Rad 公司)进行RT-PCR 反应(miRNA-155、miRNA-125bPCR 1剂盒:miRcute Plus miRNA qPCR Detection Kit SYBR Green,目录号:FP411,北京万特生物公司产品),以U6为内参,每个样本检测3 次,采用2-△△ct计算miRNA-155、miRNA-125b的相对表达量,miRNA-155、miRNA-125b及U6引物均为北京万特生物公司设计并合成。
1.2.4 sCD163 检测
采用酶联免疫吸附法测定外周血及CSF中sCD163 表达(人sCDl63 ELISA 试剂盒:美国Raybio 公司产品)。
1.3 统计学处理
采用SPSS 22.0 统计软件分析数据,符合正态分布的计量资料用()表示,两组间比较行独立t检验,多组间比较行单因素方差检验,SNK-q 比较三组内两两组间差异;绘制受试者工作特征(ROC)曲线分析各指标对TBM 的诊断价值;采用Spearman 法分析各指标与TBM 病情程度的相关性。以P<0.05 为差异有统计学意义。
2 结果
2.1 TBM 组与对照组miRNA-155、miRNA-125b、sCD163 表达水平比较
TBM 组患者外周血及CSF 中miRNA-155、miRNA-125b、sCD163 表达水平均显著高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 TBM 组与对照组miRNA-155、miRNA-125b、sCD163 表达比较()Table 1 Comparison of miRNA-155,miRNA-125b and sCD163 expression between TBM group and control group()
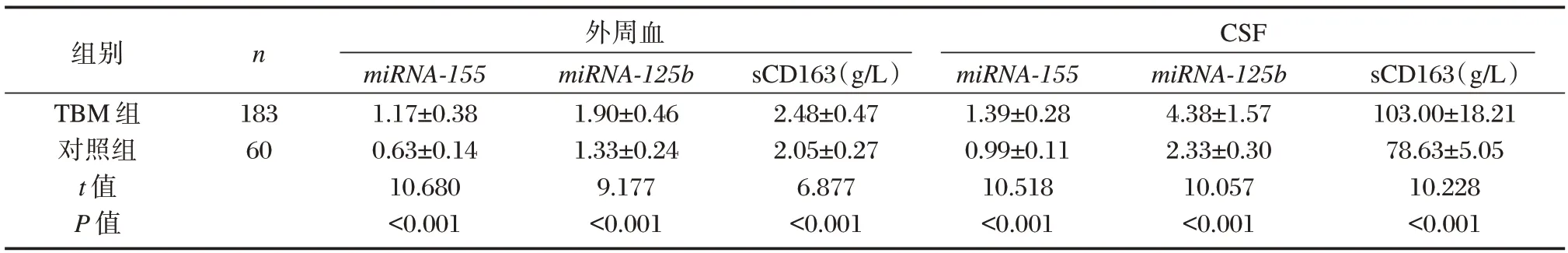
表1 TBM 组与对照组miRNA-155、miRNA-125b、sCD163 表达比较()Table 1 Comparison of miRNA-155,miRNA-125b and sCD163 expression between TBM group and control group()
2.2 miRNA-155、miRNA-125b、sCD163 表达水平对TBM 的诊断价值
外周血中miRNA-155、miRNA-125b、sCD163 诊断TBM 的ROC 曲线下面积(area under the curve,AUC)依次为0.886、0.865、0.782(P<0.05);CSF 中miRNA-155、miRNA-125b、sCD163 诊 断TBM 的AUC依次为0.925、0.905、0.915(P<0.05)。见图1、2、表2。
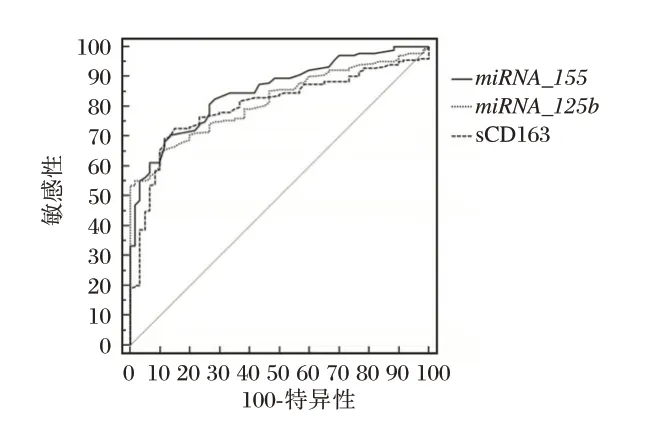
图1 血浆miRNA-155、miRNA-125b、sCD163 诊断TBM 的ROC 图Figure 1 ROC diagram of plasma miRNA-155,miRNA-125b and sCD163 in diagnosis of TBM

图2 CSF miRNA-155、miRNA-125b、sCD163 诊断TBM 的ROC 图Figure 2 ROC diagram of CSF miRNA-155,miRNA-125b and sCD163 in diagnosis of TBM

表2 miRNA-155、miRNA-125b、sCD163 表达水平对TBM患者的诊断价值Table 2 Diagnostic value of miRNA-155,miRNA-125b and sCD163 expression levels in TBM patients
2.3 不同病情TBM 患者miRNA-155、miRNA-125b、sCD163 表达水平比较
根据标准将TBM 患者分为Ⅰ期57 例,Ⅱ期73 例,Ⅲ期53 例。TBM 1者外 1血和CSF 中miRNA-155、miRNA-125b、sCD163 表达水平比较:Ⅲ期>Ⅱ期>Ⅰ期,差异有统计学意义(P<0.05)。见表3。
表3 不同病情TBM 患者miRNA-155、miRNA-125b、sCD163 表达水平比较()Table 3 Comparison of expression levels of miRNA-155,miRNA-125b and sCD163 in TBM patients with different conditions()
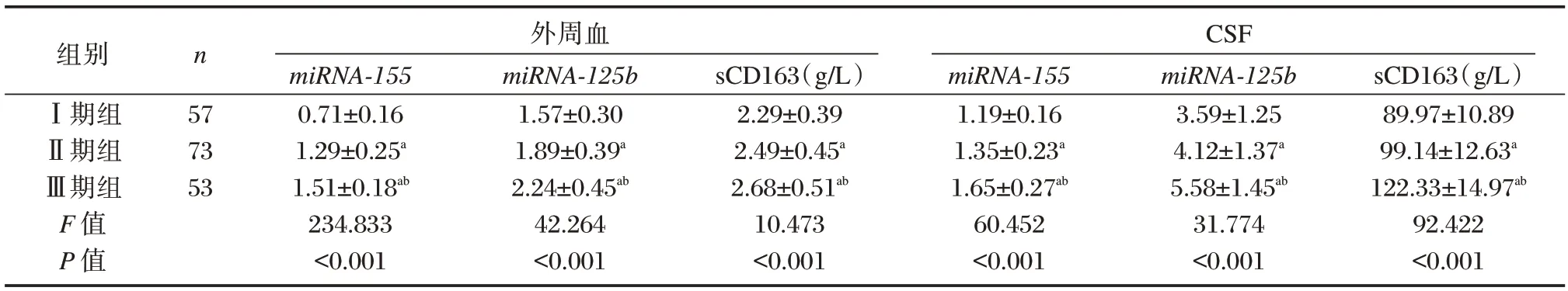
表3 不同病情TBM 患者miRNA-155、miRNA-125b、sCD163 表达水平比较()Table 3 Comparison of expression levels of miRNA-155,miRNA-125b and sCD163 in TBM patients with different conditions()
注:与Ⅰ期组比较,aP<0.05;与Ⅱ期组比较,bP<0.05。
2.4 TBM 患者miRNA-155、miRNA-125b、sCD163表达水平与病情程度的关系
TBM 患者外周血及CSF 中miRNA-155、miRNA-125b、sCD163 表达水平与其病情程度分别呈正相关关系(r=0.810、0.562、0.325、0.611、0.472、0.682,P<0.05)。
3 讨论
TBM 多见于儿童以及获得性免疫缺陷者。近几年随着卡介苗疫苗的推广和结核病防治工作的开展,我国TBM 患病率较过去明显降低,患者预后得以改善,但该病死亡率仍较高,并且有超过半数的幸存者遗留永久性的神经系统后遗症[7]。因此,早期诊断和合理治疗是改善TBM 患者预后的关键。
目前,关于一些miRNAs可参与某些感染性疾病、免疫性疾病表达谱的观点已得到证实。大多数研究认为,当机体处于疾病状态时,其miRNAs表达谱可发生特征性改变[8]。miRNA-155由免疫炎症相关细胞产生,其表达水平受B 细胞整合簇(B cell integration cluster,BIC)基因的转录水平和其他miRNA调控。Wu 等[9]的研究结果显示,活动性结核病(active tuberculosis,ATB)患者外周血单核细胞中mi-155表达水平较健康对照人群高出3.7 倍,提示miRNA-155可能参与结核病的发生。miRNA-125b可调控靶蛋白表达水平,在众多疾病中均有表达。sCD163 是仅存于单核-巨噬细胞系统细胞膜上的跨膜分子,正常情况下,其在外周血中表达水平较低,当机体发生炎性反应时,其水平可迅速升高。Kumar 等[10]的研究表明,结核病患者血浆sCD163 表达中位为241.4 pg/mL,较健康人群的132.7 pg/mL 高,提示sCD163 可能与结核病发生、发展有关。袁秀丽等[11]研究miRNA-125b、miRNA-155在TBM 患者血浆及CSF 中的表达,发现TBM 患者血浆及CSF 中miRNA-125b、miRNA-155含量均高于原发性头痛患者。本研究结果显示,与对照组相比,TBM 组外周血及CSF 中miRNA-155、miRNA-125b、sCD163 表达均显著升高,与上述报道基本一致。提示miRNA-155、miRNA-125b、sCD163 在TBM 的发生、发展中可能发挥一定作用,检测外周血及CSF 中miRNA-155、miRNA-125b、sCD163 的表达水平或许有助于预防或治疗TBM。考虑原因可能是:MTB 感染后,机体面临来自巨噬细胞的固有免疫抵抗,同时MTB 可诱导巨噬细胞的吞噬、炎症反应,使B 淋巴细胞过度激活,产生致病性自身抗体,导致外周血及CSF 中miRNA-155、miRNA-125b表达上调[12];而sCD163表达上调则可能是因MTB 感染后,与结核杆菌直接接触的外周血单核细胞和脑膜中巨噬细胞的激活所致[13]。本研究ROC 曲线分析显示,当外周血miRNA-155、miRNA-125b、sCD163 表达分别高于0.78、1.52、2.36 g/L 以及CSF 中miRNA-155、miRNA-125b、sCD163 表达分别高于1.15、3.03、86.01 g/L时,其AUC 均>0.75,提示外周血及CSF 中miRNA-155、miRNA-125b、sCD163 表达水平对TBM 患者具有较好的诊断价值,或许可为TBM 的早期诊断提供参考依据。另外,本研究还观察到,不同临床分期TBM 患者外周血及CSF 中miRNA-155、miRNA-125b、sCD163 表达差异显著,相关性分析也显示外周血及CSF 中miRNA-155、miRNA-125b、sCD163 表达水平分别与患者病情程度正相关,可见外周血及CSF 中miRNA-155、miRNA-125b、sCD163 表达水平可一定程度反映TBM 患者病情严重程度,表现为临床分期越高,外周血及CSF 中miRNA-155、miRNA-125b、sCD163 表达越高,患者病情越严重,提示此三项指标能够反映TBM 患者的临床状况,有助于医师把握患者病情,为后续治疗提供参考。
综上所述,外周血和CSF 中miRNA-155、miRNA-125b、sCD163 表达在TBM 患者中异常升高,且与临床分期呈正相关,可能参与TBM 的发生、发展。三指标可作为潜在的生物学标志,为临床医师诊断TBM 及病情评估提供参考。