尿毒素硫酸吲哚酚通过OAT-3诱发HK-2细胞纤维化的作用*
阿孜古力·克热木 艾克拜尔·吾曼尔 麦伍拉尼·马木提 买买提·依斯热依力 王晨宇 李九智
(1.新疆维吾尔自治区人民医院临床检验中心,新疆 乌鲁木齐 830001;2.新疆维吾尔自治区人民医院泌尿中心,新疆 乌鲁木齐 830001;3.新疆医科大学第七附属医院泌尿外科,新疆 乌鲁木齐 830028;4.新疆维吾尔自治区人民医院医学研究与转化中心,新疆 乌鲁木齐 830001)
尿毒症毒素是慢性肾脏病(Chronic kidney disease, CKD)患者尤其是终末期肾病患者因肾功能减退、肾清除率下降导致在血液中不断蓄积的有毒物质。硫酸吲哚酚(Indoxyl Sulfate,IS)是近年来发现的蛋白结合性尿毒素,不容易被透析方式排出,在尿毒症期其血液浓度持续增高,给肾脏及血管系统带来了毒性作用[1]。有机阴离子转运蛋白-3(Organic anion transporter-3,OAT-3)是体内主要的IS转运因子[2],对其进行研究不仅可进一步了解CKD患者IS高水平的发生机制,并且可以为新型药物研制提供一定的实验依据。NADPH氧化酶-4(Nox-4)被认为是机体内重要的氧化应激指标,也是IS促进CKD发生发展的分子机制之一,能激活细胞内多种信号传导通路,其异常活化能促进肾功能衰退和肾纤维化病变[3]。肾纤维化是CKD进行性发展至终末期肾功能衰竭的病理标志,其相关的分子机制仍未探明,尤其CKD中IS诱发肾纤维化的分子机制有待进一步探究。因此,本文通过体外培养人正常肾小管上皮(HK-2)细胞实验,探讨IS能否通过OAT-3以及氧化应激,促进肾纤维化的发生。利用siRNA沉默OAT-3和抗氧化剂N-乙酰半胱氨酸(NAC)预处理的HK-2细胞中分析氧化应激(Nox-4)及纤维化因子(Collagen I、TGF-β1、Smad-3、α-SMA)的mRNA和蛋白表达情况,进一步明确OAT-3敲低和NAC预处理对上述指标的作用,以期为今后进一步探索提供理论依据。
1 材料与方法
1.1 主要材料及试剂 人正常肾小管上皮细胞系HK-2购自武汉普诺赛生命科技有限公司,DMEM培养基、胎牛血清均购自美国Gibco公司,青链霉素、RIPA细胞裂解液及N-乙酰半胱氨酸(NAC)购自北京索莱宝科技有限公司,LipofectamineTM3000购自美国Invitrogen公司,siRNA购于上海吉玛公司,TRIzol试剂、引物及蛋白裂解液等试剂购于天根生化科技(北京)有限公司,Nox-4、Collagen I、TGF-β1、α-SMA、Smad-3等抗体均购自美国abcam公司,OAT-3、山羊抗鼠二抗和山羊抗兔二抗均购自美国Cell Signaling Technology 公司。
1.2 方法
1.2.1 细胞培养 参考我们前期研究[4],大体步骤:将复苏的HK-2细胞接种于10 cm2培养皿,用含10%胎牛血清、100 U/mL青霉素以及100 μg/mL链霉素的RPMI-1640高糖DMEM培养基放在37 ℃、5% CO2培养箱中培养,24 h后首次换液,以后48 h换液1次;待细胞生长达到80%~90%汇合时,进行传代;第2~8代细胞用于后续的实验。
1.2.2 实验分组 HK-2细胞用0.25%胰酶消化,传代后随机分为两组:①空白对照组(Control组):加入培养液中正常培养不予干预。②IS处理组(IS组):加入含250 μmoL IS培养。HK-2细胞贴壁生长,排列紧密,见图1。两组均培养24 h后,用PBS清洗细胞2次,加入TRIzol裂解液,取总RNA,采用RT-PCR方法检测氧化应激(Nox-4)及纤维化因子指标的mRNA相对表达水平。
图1 Control组和IS组HK-2细胞镜下观察(200×)
1.2.3 细胞转染 HK-2细胞培养于含10%胎牛血清、100 U/mL青霉素以及100 μg/mL链霉素的RPMI-1640高糖DMEM培养液进行培养,以5×106/孔的密度接种于6孔板中,待细胞密度达到70%~90%时准备转染;将LipofectamineTM3000与siRNA(OAT-3基因序列为5′-CACCTTTGTGCCCTTGGAUdTdT-3′,OAT-3 siRNA终浓度为10 nmol/L)稀释于基础培养基中,混匀后静置5 min,再将两者混合并室温静置20 min,使之充分混匀;最后将上述混合液加入6孔板,置于37 ℃、5%CO2培养箱中培养48 h进行后续实验,进一步分为Control组、IS组、阴性对照组(si-OAT-3组)、si-OAT-3+IS组(si-OAT-3+IS组)均培养24 h后,用PBS清洗细胞2次,加入TRIzol裂解液,取总RNA,采用RT-PCR方法做后续检测。
1.2.4 抗氧化剂预处理实验 HK-2细胞进一步分为Control组、IS组以及NAC+IS组。NAC+IS组需要加入1 mmol/L抗氧化剂N-乙酰半胱氨酸(NAC)并孵育4 h后,加入IS刺激HK-2细胞孵育24 h。3组弃去培养液,用PBS清洗细胞2次,加入TRIzol裂解液,取总RNA,采用RT-PCR方法检测氧化应激(Nox-4)及纤维化因子指标的mRNA相对表达水平。
1.2.5 实时定量RT-PCR检测OAT-3、Nox-4、Collagen I等mRNA表达水平 参考我们前期研究[5],采用实时定量(Reverse transcription-polymerase chain reaction,RT-PCR)测定空白对照组、IS组、siOAT-3组以及NAC与处理组HK-2细胞中OAT-3、Nox-4、Collagen I、TGF-β1、α-SMA、Smad-3的mRNA表达。目的基因和GAPDH管家基因引物序列见表1。RT-PCR反应严格按照试剂盒操作说明进行,应用2-△△CT计算出目标基因的相对表达水平。
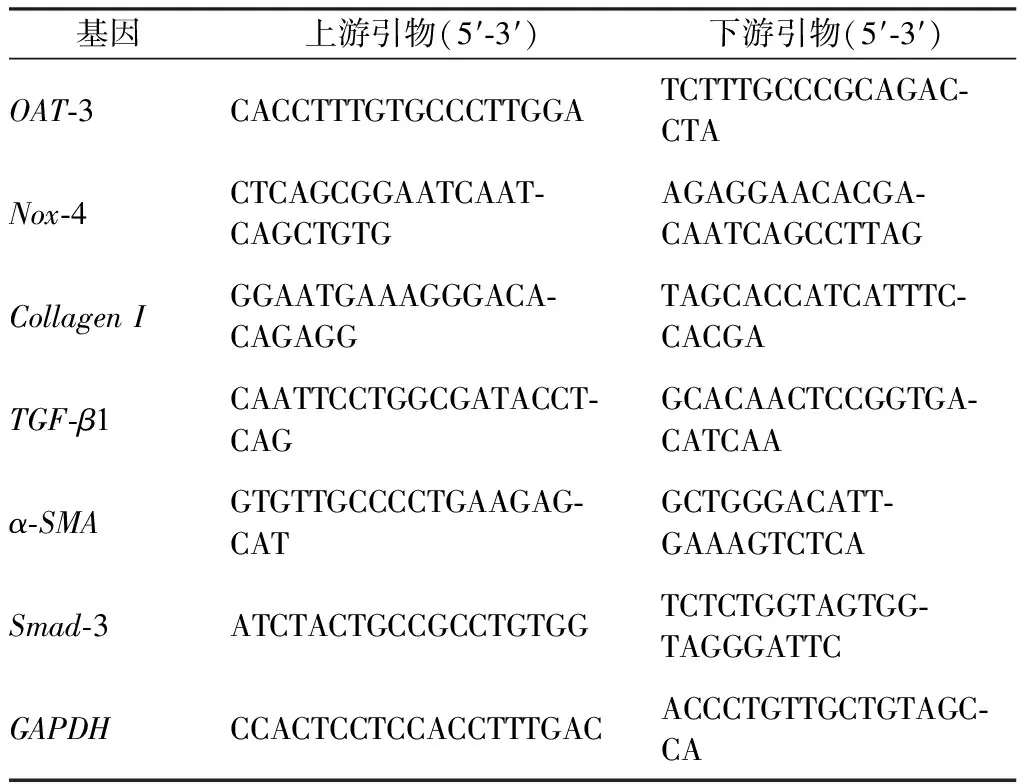
表1 基因引物序列
1.2.6 Western blot检测OAT-3、Nox-4、Collagen I等蛋白表达水平 参考我们前期研究[4],各组HK-2细胞培养皿中加入蛋白裂解液(50 mmol/L PIPA)裂解细胞,提取蛋白质,其浓度测定使用采用BCA试剂盒。上样每孔加入20 μg蛋白,聚丙烯酰胺凝胶电泳后,转移至聚偏二佛乙烯(PVDF)膜上,封闭,洗膜后加一抗(1∶1000)4 ℃过夜,然后用1×TBST洗膜3次 5 min,再与二抗(1∶10000)室温孵育1 h,在用1×TBST洗膜3次 5 min,β-actin作为内参照。置于凝胶成像仪中照相并应用Image J软件对目的蛋白质条带灰度进行分析。

2 结果
2.1 IS诱导HK-2细胞氧化应激及纤维化因子的高表达 与Control组比较,IS显著增加氧化应激(Nox-4)及纤维化因子(Collagen I、TGF-β1、Smad-3、α-SMA)的mRNA表达水平(t分别为3.778、4.649、7.677、7.677、3.929,均P<0.05),见图2。提示IS显著诱导HK-2细胞氧化应激及纤维化指标的高表达。
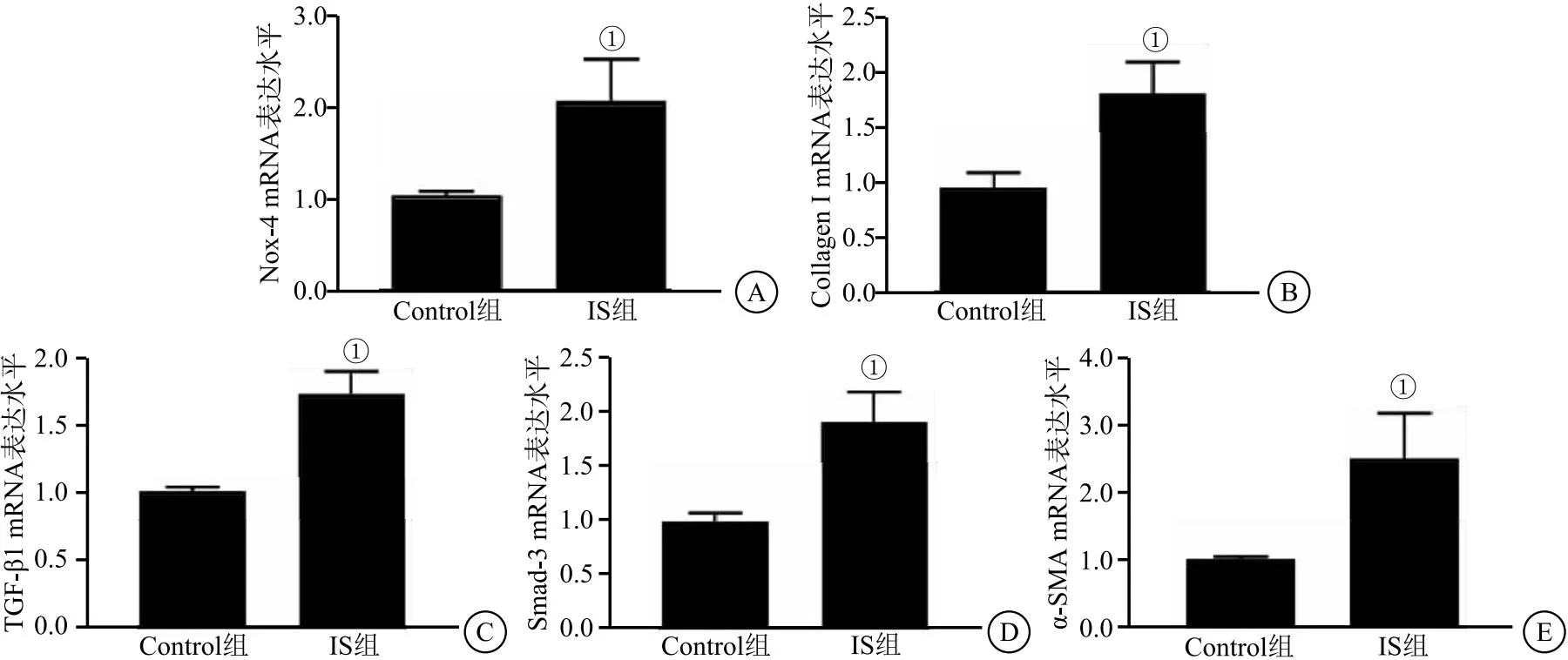
图2 IS诱导氧化应激及纤维化因子指标mRNA水平的高表达
2.2 敲低OAT-3阻断IS诱导HK-2细胞氧化应激及纤维化因子的高表达 为了检测OAT-3转染效率,我们将si-RNA阴性对照和si-OAT-3转染到HK-2细胞,培养48 h后,加入IS刺激24 h后分别提取总RNA进行分析。结果显示,HK-2细胞中敲低OAT-3抑制其mRNA表达(F=112.6,P<0.05),见图3;si-OAT-3组和si-OAT-3+IS组均显著降低氧化应激(Nox-4)及纤维化因子(Collagen I、TGF-β1、Smad-3、α-SMA)的mRNA以及蛋白表达水平显著低于IS组(F分别为61.21、75.02、93.99、65.04、126.20,均P<0.05),见图4。提示敲低OAT-3阻断IS诱导氧化应激及纤维化因子的高表达。
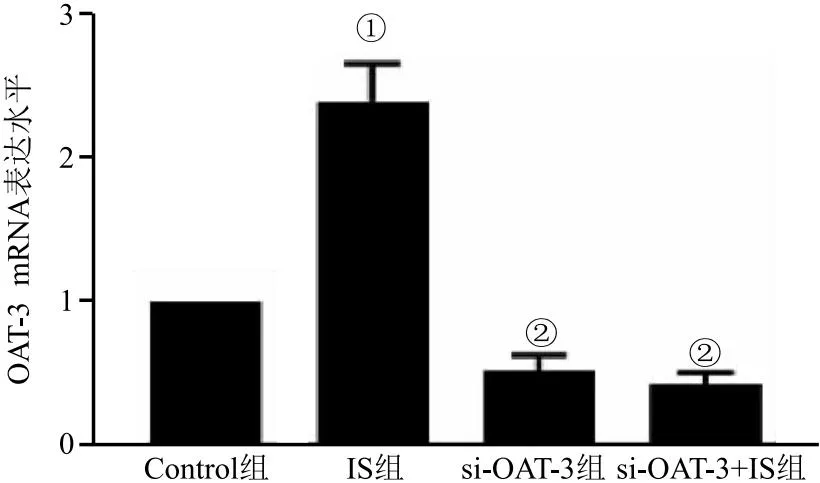
图3 敲低OAT-3抑制其mRNA及蛋白表达水平
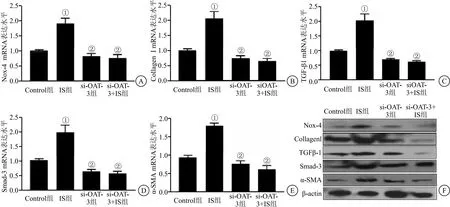
图4 敲低OAT-3阻断IS诱导HK-2细胞氧化应激及纤维化因子的高表达
2.3 抗氧化剂NAC抑制HK-2细胞氧化应激及纤维化因子的高表达 最终HK-2细胞以抗氧化剂N-乙酰半胱氨酸(NAC)预处理后,加入250 μmoL浓度的IS刺激24 h后,分别采用RT-PCR及Western blot方法检测上述指标的mRNA和蛋白表达水平。结果显示,NAC显著抑制IS诱导氧化应激(Nox-4)及纤维化因子(Collagen I、TGF-β1、Smad-3、α-SMA)的mRNA及蛋白的表达水平(F分别为16.83、171.40、49.61、62.12、45.25,均P<0.05),见图5。提示NAC有效抑制IS诱导氧化应激及纤维化因子的高表达。
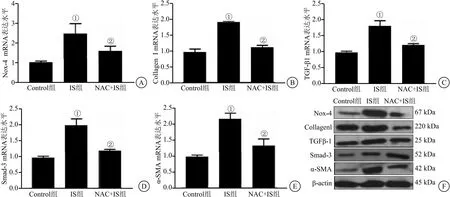
图5 NAC抑制HK-2细胞氧化应激及纤维化因子的mRNA及蛋白水平的高表达
3 讨论
尿毒症期患者体内各种尿毒素的蓄积可加速肾衰并引起肾和心血管系统的并发症。依据尿毒素与蛋白质结合的能力,尿毒素可分为蛋白质结合型毒素和非蛋白质结合型毒素。现有的透析方法能除去大部分非蛋白质结合型毒素,却对蛋白质结合型毒素无能为力[6-7]。近些年来在尿毒症领域被广泛关注的IS是一种由色氨酸衍生物代谢生成的蛋白结合型毒素,由吃下的食物分解出的色氨酸在肠道中被肠内菌如大肠杆菌的色氨酸酶分解为吲哚,再被肠黏膜吸收,经门静脉系统进入肝脏,在肝细胞中经羥化作用和硫酸盐化形成IS[8]。正常人体中IS主要通过尿液排出体外,肾脏肾小管细胞上高表达的有机阴离子转运体(OATs)能介导IS的摄取。当肾实质性损伤时,功能性肾小管细胞急剧减少,于是IS大量蓄积于人体血液中;随着CKD进展,患者血液中IS的含量持续增加[9-10]。不管是血液透析还是腹膜透析都无法有效地去除IS,原因在于大部分IS都以蛋白结合形式存在于血液中,而结合后的化合物直径大于透析膜孔径,从而难以清除。
研究发现,在5/6切除的小鼠肾衰模型中IS是诱导肾功能衰竭及肾纤维化加重的尿毒素,而肾衰的同时使得IS在体内进一步蓄积,其水平上升,两者相互促进形成恶性循环[11-12]。OAT-3主要分布于肾脏、心血管及脑组织,但在肾脏中的分布量最多[12]。IS在肾脏中的排泄与肾近端小管上皮细胞中OAT-3密切有关。IS经OAT-3进入细胞内并引起细胞内氧化和抗氧化平衡的失衡,使得氧化应激过量产生在肾小管和肾小球的基质细胞中升高转化生长因子β1以及胶原蛋白等的表达,加速肾小球硬化从而加速肾衰竭[13-15]。在大鼠肾衰竭模型中IS通过OAT-3摄取进入平滑肌细胞内并引导氧化应激的产生,激活芳香烃受体和NF-κB等细胞信号传导系统,从而诱导血管平滑肌细胞的增殖以及血管钙化等病变[16]。本研究中,IS刺激体外培养HK-2细胞中氧化应激及纤维化因子的高表达;敲低OAT-3能够阻断IS诱导氧化应激及纤维化因子的高表达,提示阻断IS经OAT-3摄取入肾小管上皮细胞能够抑制纤维化的发生。
纤维化作为许多慢性炎症性疾病最终的病理变化,其主要的改变为纤维结缔组织过度积累于炎症或损伤的组织内或周围,引起永久性瘢痕、器官结构破坏及功能不全,乃至死亡[17-20]。纤维化的发生与炎症反应、氧化应激、TGF-β/Smad信号通路、Wnt/β-catenin信号通路及脂代谢相关,其中与TGF-β/Smad信号通路之间的关系较为密切[21]。IS在细胞和组织内通过不同途径影响机体氧化/抗氧化系统,并导致该系统的紊乱,从而引起氧化应激的产生[22]。NADPH为细胞内一组具有氧化活性的酶复合体,并由六种不同的亚基构成,其中Nox-4是与活性氧关系最密切的氧化酶[23-25]。氧化应激与TGF-β在促进组织纤维化中的相互作用亦得到证实,即TGF-β的活化引起细胞内氧化应激产生;同时,氧化应激同样刺激潜在的TGF-β形成纤维化[26-27]。本研究结果显示,NAC有效抑制IS诱导氧化应激及纤维化因子的高表达,提示IS经OAT-3摄取到HK-2细胞内,进而增加氧化应激,最终促进纤维化因子的高表达。
IS是蛋白质结合型的尿毒素,透析治疗使其排出体外十分困难,因此加深对IS的认识及其作用机制至关重要。本研究探讨了IS在HK-2细胞中通过OAT-3和氧化应激促进纤维化发生的分子机制,然而其更深入机制以及相关的阻断IS的毒性作用和寻找有效的抑制剂方面(如OAT-3抑制剂或抗氧化剂)的研究有待进一步探索。
4 结论
IS经OAT-3摄取到HK-2细胞内,进而增加氧化应激,促进纤维化因子的高表达;敲低OAT-3和抗氧化剂NAC的使用能有效阻断IS诱导肾小管上皮纤维化的发生。

