鼠源M2型巨噬细胞对KYSE30细胞克隆、侵袭、迁移及EMT相关蛋白表达的影响
崔萌菲,王 柯,何晓彤,尹 圆,钟 影,张宝华,岳娅乐,范天黎
郑州大学基础医学院药理学教研室 郑州 450001
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是一种常见的侵袭性强的恶性肿瘤,具有高复发、易转移的特点,患者术后5 a生存率不足20%[1]。研究[2]表明,肿瘤的高复发、易转移等特点与肿瘤微环境(tumor microenviroment,TME)中的肿瘤相关巨噬细胞(tumor associated macrophage,TAM)密切相关。TAM主要分为M1型和M2型,前者发挥抗肿瘤作用,后者发挥促肿瘤作用。RAW264.7是一种小鼠单核巨噬细胞白血病细胞,常被作为诱导极化巨噬细胞的模型[3]。研究[4-5]表明,RAW264.7极化成的M2型巨噬细胞能够促进乳腺癌细胞的增殖和侵袭转移,促进非小细胞肺癌的增殖及淋巴结转移。本研究通过平板克隆实验、划痕实验、Transwell实验及Western blot实验探究鼠源M2型巨噬细胞对ESCC细胞KYSE30克隆、侵袭、迁移能力及上皮间质转化(epithelial-mesenchymal transition,EMT)的影响,以期为靶向M2型巨噬细胞治疗ESCC提供理论基础。
1 材料与方法
1.1 主要试剂与仪器DMEM培养基、RPMI 1640培养基、细胞裂解液购自北京索莱宝公司;胎牛血清购自以色列Biological Industries公司;2.5 g/L胰蛋白酶购自上海碧云天生物技术有限公司;鼠源IL-4及IL-13购自美国Peprotech公司;APC-F4/80、PE-CD206流式抗体购自美国Biolegend公司;鼠抗CD206、GAPDH抗体及兔抗E-cadherin、N-cadherin、MMP-9抗体购自武汉三鹰生物技术有限公司;鼠抗Vimentin抗体购自英国Abcam公司;基质胶购自美国BD公司;0.4 μm共培养小室购自北京赛伯乐仪器有限公司;Transwell小室购自美国Corning公司;反转录试剂盒、PCR试剂盒购自南京诺维赞生物科技股份有限公司。
1.2 细胞来源和培养KYSE30及鼠源RAW264.7细胞均由郑州大学基础医学院药理学教研室保存。RAW264.7用含体积分数10%胎牛血清的DMEM培养基,KYSE30细胞用含体积分数10%胎牛血清的RPMI 1640培养基,于37 ℃、体积分数5%CO2培养箱中培养,待细胞达到80%~90%融合时,用2.5 g/L胰蛋白酶消化并传代。
1.3 鼠源M2型巨噬细胞的诱导及鉴定将RAW264.7细胞分成空白对照组和诱导组。诱导组细胞以含有0.02 mg/L IL-4和IL-13的DMEM培养基培养;空白对照组以DMEM培养基培养。细胞培养48 h后,鉴定是否成功诱导鼠源M2型巨噬细胞。
1.3.1CD206和F4/80的流式细胞术检测 收集两组细胞,4 ℃预冷的流式缓冲液洗涤1次,350×g离心5 min,弃上清,加入10 μL APC-F4/80抗体重悬,4 ℃避光染色30 min;加入适量流式缓冲液,350×g离心5 min,弃上清;结束后加入4 ℃预冷的固定液固定25 min,350×g离心去上清;加入5 mL 1×破膜剂,350×g离心去上清;加入10 μL PE-CD206抗体重悬,4 ℃避光染色30 min。加入适量缓冲液重悬细胞,立即采用流式细胞仪避光检测各组中CD206+F4/80+细胞百分比。实验重复3次。
1.3.2CD206、Mgl-2、Clec10a mRNA表达的qRT-PCR检测 收集两组细胞,使用Trizol试剂裂解后提取总RNA,应用反转录试剂盒反转成cDNA,然后采用QuantStudio 6实时荧光定量PCR仪进行扩增。以β-actin为内参,所有引物均由河南尚亚生物技术有限公司合成,引物序列见表1。反应体系:7.2 μL ddH2O、0.8 μL引物、10 μL SYBR和2 μL cDNA。扩增条件:95 ℃预变性5 min;95 ℃ 10 s,60 ℃ 30 s,循环50次。采用2-ΔΔCt方法分析CD206、Mgl-2、Clec10a mRNA的相对表达量。实验重复3次。

表1 引物序列
1.3.3CD206蛋白表达的Western blot检测 收集两组细胞,采用RIPA细胞裂解液提取总蛋白。根据BCA法测量蛋白总浓度。取30 μg总蛋白上样,电泳,100 V电压电转1.5 h。50 g/L脱脂奶粉37 ℃封闭2 h。分别加入鼠抗CD206抗体(1∶1 000稀释)和GAPDH抗体(1∶20 000稀释)4 ℃过夜孵育。次日回收抗体,1×TBST洗膜3次。加入辣根过氧化物酶标记山羊抗鼠二抗(1∶5 000稀释)孵育2 h,1×TBST洗膜3次。按说明书配制发光液,并将其滴加于目的条带上,在化学发光成像分析仪中显影。采用Image J 分析,以目的蛋白与内参GAPDH条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.4 实验分组将KYSE30分为对照组(仅培养)和共培养组。共培养组:将3.0×104个RAW264.7细胞接种在共培养小室的上室,1.0×104个KYSE30细胞接种于下室。上室加入终浓度为0.02 mg/L的IL-4和IL-13诱导48 h后,吸弃原培养基,加入新鲜的完全培养基并将共培养小室移入接种有KYSE30细胞的小孔中,置37 ℃、体积分数5%CO2培养箱中共培养48 h,收集细胞进行后续实验。
1.5 细胞形态观察收集按1.4分组处理后的两组细胞,调整细胞密度为1.0×105个/mL,分别接种于6孔板中,于37 ℃、体积分数5%CO2培养箱中培养24 h。取出6孔板,吸弃旧培养基,加入新鲜培养基,倒置光学显微镜下(×40)观察细胞形态并拍照。
1.6 细胞克隆形成能力的平板克隆实验将两组细胞以2.0×103个/孔接种于6孔板中,于37 ℃、体积分数5%CO2培养箱中培养7 d。1×PBS洗板3次,40 g/L多聚甲醛固定25 min,结晶紫染色30 min。1×PBS洗涤3次后于EVOS M7000显微镜下观察并拍照,采用Image J计数克隆数目。实验重复3次。
1.7 细胞迁移速率的划痕实验在6孔板背面每隔0.5 cm均匀画一道横线,每孔中加入5.0×105个KYSE30细胞,24 h后待细胞长满,200 μL移液枪枪头沿直尺垂直于6孔板背面的横线划线,1×PBS洗涤去除细胞碎片。加入无血清培养基培养,分别在0、24、48 h于倒置光学显微镜下观察划痕状况并拍照,Image J 软件分析。细胞迁移速率=(迁移前划痕总面积-迁移后划痕面积)/迁移前划痕总面积×100%。实验重复3次。
1.8 细胞侵袭和迁移能力的Transwell实验侵袭:在Transwell小室上室中加入100 μL稀释过的基质胶,于37 ℃培养箱放置1 h。收集两组细胞,调整细胞密度为1.5×105个/mL,吸取细胞悬液200 μL加入到Transwell小室下室。下室中加入600 μL RPMI 1640培养基。小室于37 ℃、体积分数5%CO2培养箱中培养48 h,取出上室,1×PBS清洗,40 g/L多聚甲醛中固定25 min,结晶紫染色30 min,1×PBS洗涤3次,棉签擦拭小室去除残留的细胞,倒置光学显微镜观察并拍照,采用Image J计数侵袭细胞数目。实验重复3次。迁移:除小室内无基质胶外,其余步骤均同侵袭实验。
1.9 细胞中E-cadherin、N-cadherin、Vimentin、MMP-9蛋白表达的Western blot检测具体操作同1.3.3。兔抗E-cadherin抗体(1∶20 000稀释)、N-cadherin抗体(1∶1 000稀释)、Vimentin抗体(1∶1 000稀释)、MMP-9抗体(1∶20 000稀释)和鼠抗GAPDH抗体(1∶20 000稀释)。
1.10 统计学处理采用SPSS 21.0分析,空白对照组和诱导组RAW264.7细胞的CD206+F4/80+细胞百分比,CD206、Mgl-2、Clec10a mRNA及CD206蛋白表达水平的比较,对照组和共培养组KYSE30细胞克隆、侵袭、迁移情况及E-cadherin、N-cadherin、Vimentin、MMP-9蛋白表达水平的比较,均采用两独立样本t检验。检验水准α=0.05。

表2 两组细胞中CD206+F4/80+细胞百分比和CD206蛋白表达的比较

表3 两组细胞中CD206、Mgl-2、Clec10a mRNA表达的比较
2 结果
2.1 鼠源M2型巨噬细胞的鉴定诱导组中CD206+F4/80+细胞百分比高于空白对照组:与空白对照组相比,诱导组中M2型巨噬细胞标志物CD206蛋白,CD206、Mgl-2和Clec10a mRNA表达均上调(表2、3)。
2.2 对照组和共培养组KYSE30细胞形态变化与对照组相比,共培养组细胞48 h后明显开始变长、变大,边缘模糊,并生出细长伪足,见图1。
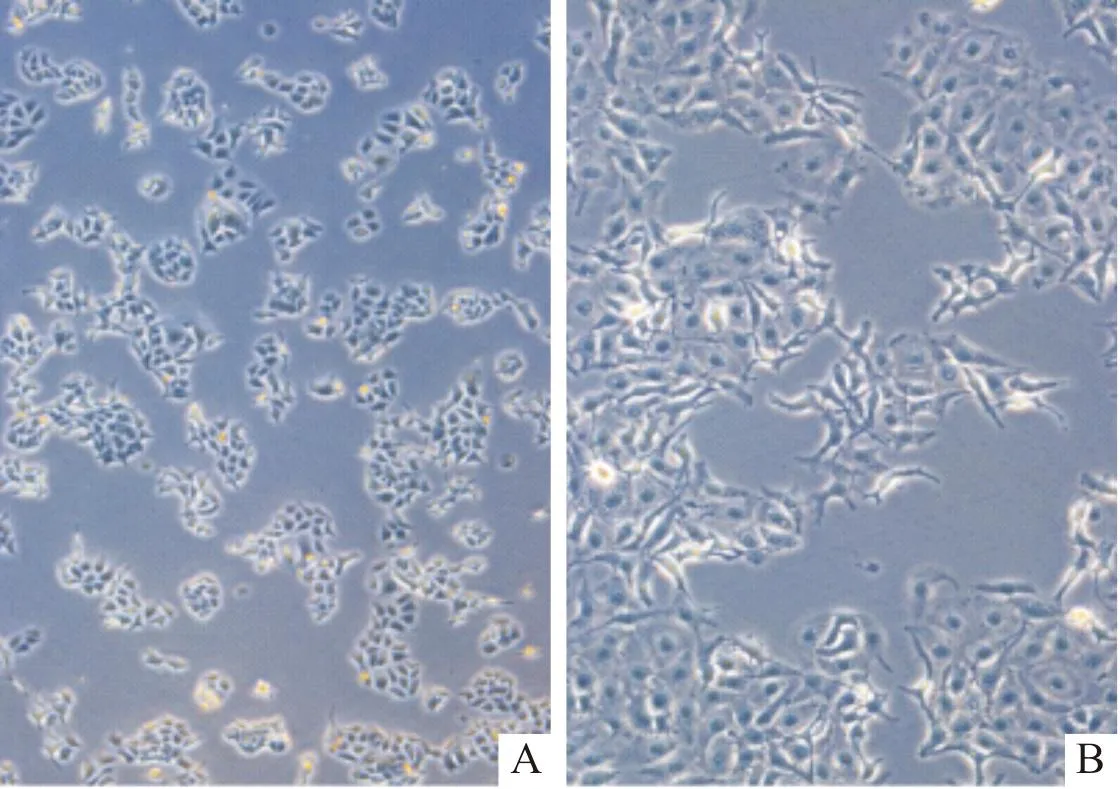
A:对照组;B:共培养组
2.3 对照组和共培养组KYSE30细胞克隆形成比较与对照组相比,共培养组细胞克隆形成数目明显增多,见图2和表4。
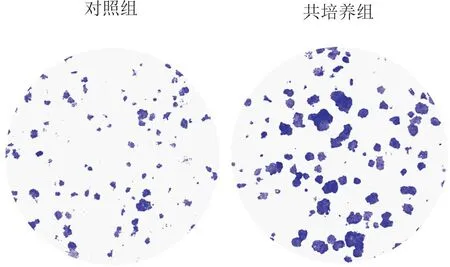
图2 两组细胞的克隆形成实验结果

表4 两组细胞克隆形成数、侵袭细胞数和迁移细胞数比较
2.4 对照组和共培养组侵袭和迁移能力的比较Transwell实验结果见图3、表4,与对照组相比,共培养组细胞的侵袭和迁移细胞数增多;与对照组相比,共培养组细胞24和48 h的迁移速率均增加,见表5。

A:对照组;B:共培养组
2.5 对照组和共培养组细胞E-cadherin、N-cadherin、MMP-9及Vimentin蛋白表达比较与对照组相比,共培养组上皮表型蛋白E-cadherin表达下调,间质表型蛋白N-cadherin、MMP-9及Vimentin表达均上调,见表6。

表6 两组细胞E-cadherin、N-cadherin、MMP-9及Vimentin蛋白表达比较
3 讨论
随着免疫检查点如PD-1/PD-L1的发现,免疫疗法逐渐成为癌症治疗的研究热点[6]。免疫治疗主要着手于增强人体免疫细胞的监察能力或者调整TME中免疫抑制细胞的功能。TME作为肿瘤细胞生存不可分割的部分,支持肿瘤细胞生长和转移,同时减弱免疫监测,是一个复杂的生态系统,其中最具代表性的细胞便是M2型巨噬细胞[7-8]。研究[9]表明,Mgl-2、Clec10a及CD206在鼠源M2型巨噬细胞中表达上调,但在M1型巨噬细胞中表达下调。有研究[10]认为有些M1、M2型标志物在人源诱导的巨噬细胞与鼠源诱导的巨噬细胞中表达趋势具有高度的相似性,且鼠源巨噬细胞与人源巨噬细胞差别并不显著[11]。RAW264.7细胞自身可进行增殖,且经体外诱导极化后仍可进行增殖,保持了良好的细胞状态。本实验通过检测CD206、Mgl-2、Clec10a表达情况来鉴定鼠源巨噬细胞RAW264.7的极化,结果发现在诱导组细胞以上标志物的表达升高,说明鼠源M2型巨噬细胞诱导成功。
有研究[12]表明,鼠源M2型巨噬细胞可以通过激活NF-κB信号通路来促进乳腺癌细胞产生耐药性。M2型巨噬细胞可以分泌趋化因子CXCL1[13]和CCL18[14],促进乳腺癌细胞恶性表型的发生。在胃癌和前列腺癌的研究[15-16]中发现M2型巨噬细胞通过分泌CCL5来促进肿瘤细胞恶性表型的发生。本研究结果表明,鼠源M2型巨噬细胞与ESCC细胞KYSE30共培养后,EMT相关蛋白表达增加,细胞形态变细长,长出伪足,且其克隆、侵袭和迁移能力均增强。
总之,本研究为靶向巨噬细胞治疗ESCC提供了一定的理论基础。但对于M2型TAM促进ESCC发生发展的靶分子及作用机制有待于进一步研究。考虑到种属差异性,后续将进一步采用THP1与KYSE30共培养,以再次验证M2型TAM对ESCC的作用。

