N6-腺苷酸甲基化结合蛋白的遗传变异与胃癌风险关联分析
陆欣苑 冯延璐 李洁 许思易 李成云 刘桐 王新华 梁戈玉
1东南大学公共卫生学院,环境医学工程教育部重点实验室(南京 210009);2兰州大学公共卫生学院(兰州 730000);3甘肃省武威肿瘤医院(甘肃武威 733000)
胃癌因其进展迅速,易向淋巴结转移和远端转移,已经成为对人类健康最具威胁的恶性肿瘤之一。2020年全球癌症报告数据指出,胃癌在癌症中发病率和病死率高居第五和第四位[1],严重危害人类健康。胃癌的发病复杂且多变,幽门螺旋杆菌感染、吸烟、饮酒、高盐饮食等环境因素已经被报道与胃癌的发病相关[2]。此外,对胃癌病因深入研究发现,其发生发展与个体间存在的遗传易感性差异相关[3]。因此,探索与胃癌发生发展相关的遗传易感基因,能为胃癌的防治提供分子水平依据。
N6-腺苷酸甲基化(m6A)修饰是RNA转录后最广泛的修饰类型,受甲基转移酶(writers)、去甲基化酶(erasers)和甲基化结合蛋白(readers)调控[4],广泛参与调控各种生命进程[5]。YTH结构域家族蛋白1(YTHDF1)是一种m6A结合蛋白,能结合mRNA中终止密码子区域周围的m6A结合位点,并可招募多种翻译起始复合物,提高目标RNA的翻译的效率,是最重要的m6A结合蛋白之一[6-7]。异质核核糖核蛋白A2B1(HNRNPA2B1)是另一种m6A结合蛋白,能识别初级microRNA转录子集上的m6A修饰,从而介导m6A修饰对初级microRNA加工和替代拼接[8]。YTHDF1和HNRNPA2B1已被报道与包括胃癌在内的多种人类癌症的发生发展密切相关,在多种恶性肿瘤中发挥癌基因或抑癌基因的作用[9]。
单核苷酸多态性(single nucleotide polymorphisms,SNPs)是每100~300个碱基就可能发生一次的、人类最常见、最广泛的可遗传变异,分布于整个基因组,能揭示人种、人群及个体之间的遗传差异[10]。全基因组关联研究为探索胃癌病因提供了重要思路,并为胃癌病例确定了各种常见变异,其中大多数为SNPs[11]。
YTHDF1的功能性SNPs已经被报道与肝母细胞瘤、肾母细胞瘤和神经母细胞瘤等恶性肿瘤的发病风险和临床进展相关[12-14],可能成为肿瘤遗传易感性的生物标志物。但目前鲜见研究探究YTHDF1 SNPs与胃癌发病风险和临床进展的关联。此外,尚未有研究发现HNRNPA2B1的功能性SNPs。因此,本研究在中国胃癌高发区——甘肃省武威市人群中,结合研究对象生活方式和临床信息和,探索YTHDF1和HNRNPA2B1的SNPs与胃癌发生发展的关联,为胃癌的预防和诊断提供参考。
1 资料与方法
1.1 研究对象收集2016-2019年甘肃省武威肿瘤医院的胃癌患者457例为病例组,纳入标准:经组织学病理诊断确诊患胃癌者。排除标准:(1)经诊断患其他恶性肿瘤;(2)经诊断患严重的消化道疾病者;(3)经诊断患包括严重心脑血管疾病在内的慢性疾病者。收集同期在该院进行健康体检且年龄和性别匹配的健康人525 例为对照组。采集研究对象2 mL外周静脉血于EDTA抗凝管,负80 ℃冰箱保存。收集研究对象的一般人口统计学资料、生活方式(吸烟、饮酒、饮茶、吃腌制食物和吃油炸食物)、肿瘤家族史以及临床信息。其中生活方式各因素定义如下:吸烟为每天吸烟1支以上,累计6个月;饮酒为平均每周至少饮酒1次,累计6个月;饮茶为平均每周至少饮茶3次,累计6个月;吃腌制食品为平均每周至少吃腌制食品2次;吃油炸食品为平均每周至少吃油炸食品2次。本研究通过医学伦理委员会批准(编号:2019ZDKYSB137)。
1.2 主要试剂与仪器TIANamp Blood DNA Kit提取试剂盒(中国天根生化科技有限公司),dNTP试剂盒(中国有渔生物科技有限公司),PCR引物由上海百力格生物技术有限公司设计合成。A-100 PCR仪(中国朗基科学仪器有限公司),Gene Amp PCR system 9600 PCR仪(美国Perkin Elmer公司),JY600+电泳仪(中国君意东方电泳设备有限公司),FR-200A全自动紫外与可见分析装置(中国复日科技有限公司)。
1.3 研究方法
1.3.1 SNPs的筛选使用NCBI db数据库(https://www.ncbi.nlm.nih.gov/snp/)筛选本研究纳入的SNPs,筛选标准如下:(1)在中国汉族人群中最小等位基因频率>0.1,P(Hardy-Weinberg)>0.05,基因呼叫率>0.95,连锁不平衡值r2>0.8的SNPs位点;(2)使用GTEx(https://www.gtexportal.org/)、HaploReg(http://compbio.mit.edu/HaploReg)和RegulomeDB(https://regulomedb.org/)等在线工具功能性SNPs分析软件预测可能与胃癌发生发展相关的SNPs。最终,YTHDF1rs6011668、HNRNPA2B1 rs2070601和rs76558212这3个SNPs纳入了本次研究。
1.3.2 全血基因组DNA提取应用TIANamp Blood DNA Kit试剂盒提取外周血基因组DNA,琼脂糖凝胶电泳实验鉴定DNA质量,负80 ℃冰箱保存。
1.3.3 基因分型本研究的SNPs基因分型应用了结合多重PCR 技术和高通量测序技术的Hi-SNP高通量基因分型法:针对检测位点设计特异性引物,在单管内进行多重 PCR 扩增,不同的样本以不同的 Barcode引物区分。建库产物混合样本后,在Illumina测序平台上,对扩增子进行高通量测序。测序结果使用生物信息学方法区分不同的样本,获得所有候选SNPs的基因分型。使用Primer 3在线软件(0.4.0版http://frodo.wi.mit.edu/)设计多重 PCR的rs6011668的正向引物序列为5'-CTAAAGGAGAAAGACCTGGAATGG-3',反向引物序列为5'-CAGTTTCCACCTCCTC CTG-3';rs2070601的正向引物序列为5'-TTAAAAGTACATCAAGCCCAAGAC-3',反向引物序列为5'-GGGGGTGTTCAGTAGTTTAATTTC-3';rs76558212的正向引物序列为5'-CTATCCTTGGTAAACATTTGGTGG-3',反向引物序列为5'-AAACTTTATCTTTTGGGCCAGTAG-3'。SNPs的基因分型由上海翼和应用生物技术有限公司完成。
1.4 统计学方法数据分析使用SPSS 22.0统计软件。应用χ2检验分析对照组中YTHDF1rs6011668、HNRNPA2B1 rs2070601和rs76558212的基因型分布是否符合Hardy-Weinberg平衡定律;应用两独立样本t检验和χ2检验分别分析两组之间定量和定性资料的分布差异;应用logistic回归计算95%置信区间(confidence interval,CI)和比值比(odds ratio,OR),估计3个候选 SNPs与胃癌发病风险的关联;使用单因素和多因素logistic回归探究与胃癌发病风险密切相关的遗传和环境因素,以回归系数作为权重,对与胃癌相关的遗传和环境因素加权后计算风险评分(risk score,RS),计算公式如下:
RS=β0 + ∑i=1kβiXi
其中,β0为常量,k为纳入因素的个数,Xi为第i个研究因素,βi为logistic回归得到的第i个因素的回归系数。
使用RS评估胃癌发病风险,以四分位数将RS分为0(RS<Q25),1(Q25 ≤ RS<Q50),2(Q50 ≤ RS<Q75),3(RS>Q75),以0组作为参照组,使用logistic回归计算其他组的95%CI和OR,探究RS与胃癌发病风险的关联。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象特征本研究纳入了总计982例研究对象,其中胃癌病例457例(胃腺癌447例),健康对照525例。病例组男性257例,女性200例;年龄范围35~73岁,平均年龄(58.03 ± 6.95)岁;对照组男性278例,女性247 例;年龄范围35~75岁,平均年龄(57.51 ± 5.74)岁。病例组和对照组之间,性别、年龄、吸烟、吃油炸食物和肿瘤家族史的分布差异均无统计学意义(P>0.05),饮酒、饮茶和吃腌制食物的分布差异均有统计学意义(P<0.05),见表1。
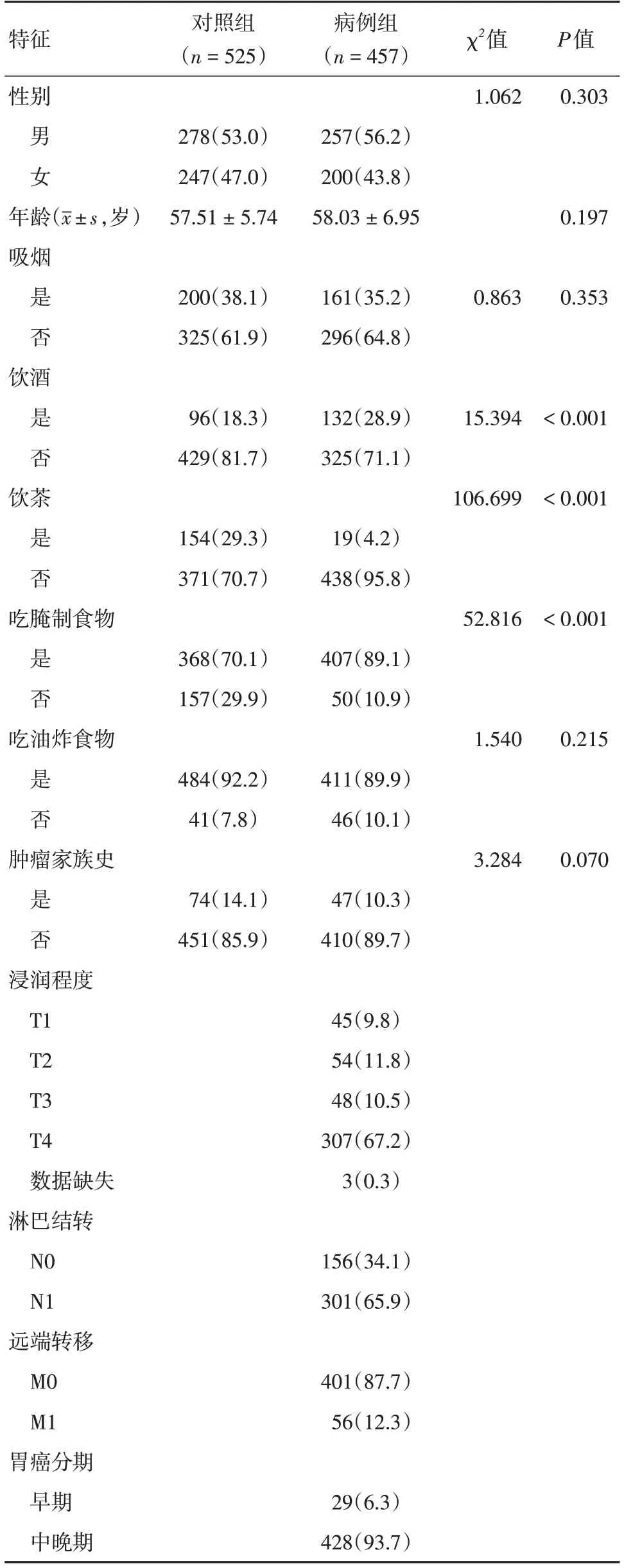
表1 研究对象特征Tab.1 Characteristics of study participants 例(%)
2.2 候选 SNPs的基因分型和群体代表性分析YTHDF1 rs6011668基因分型为CC、TC和TT基因型;HNRNPA2B1 rs2070601基因分型为AA、AG和GG基因型;rs76558212基因分型为TT、TC和CC基因型。在对照组中,rs6011668、rs2070601和rs76558212的基因型符合Hardy-Weinberg平衡(均P<0.05),该人群具有较好的群体代表性,见表2。
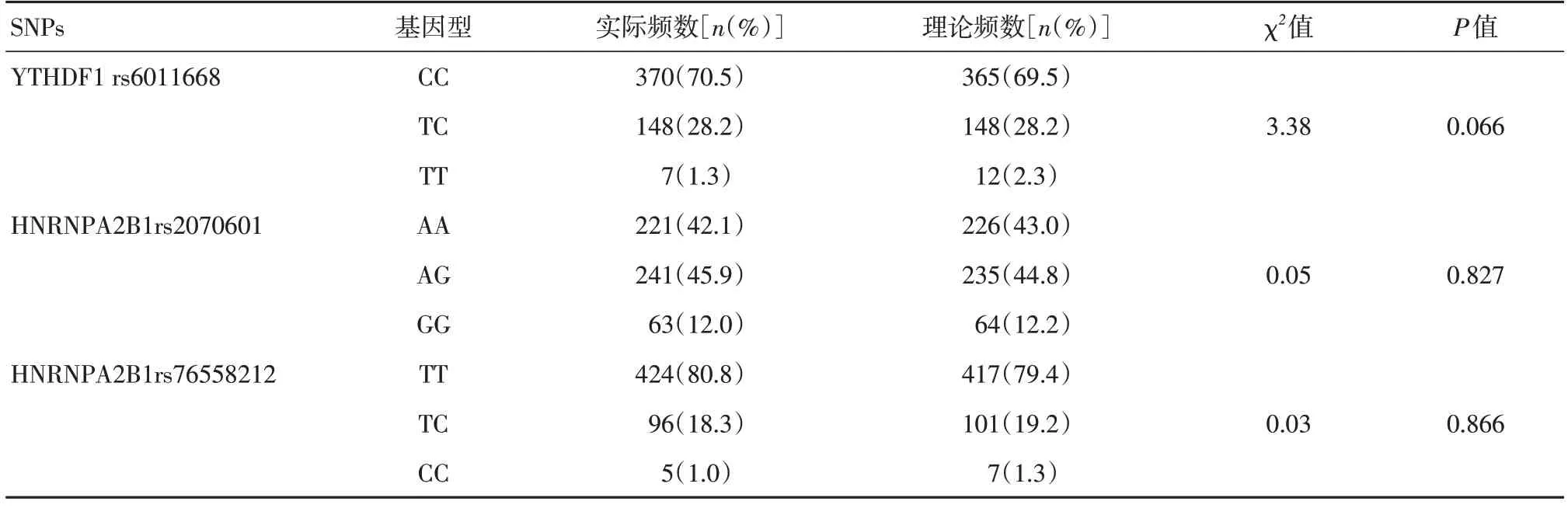
表2 对照组人群 Hardy-Weinberg 遗传平衡检验Tab.2 The Hardy-Weinberg equilibrium test for the controls
2.3 候选SNPs与胃癌发病风险的相关性分析在共显性、显性、隐性和等位基因4 种遗传模型下,应用logistic回归分析YTHDF1 rs6011668、HNRNPA2B1 rs2070601和rs76558212与胃癌发病风险的关联。结果表明,在共显性模型中,rs6011668TT基因型携带者的胃癌发病风险是CC基因型携带者的3.075倍(OR=3.075,95%CI:1.128~8.382,P=0.028);在隐性模型中,TT基因型携带者的胃癌发病风险是CC/TC基因型携带者2.961倍(OR=2.961,95%CI=1.091~8.033,P=0.033);未发现HNRNPA2B1rs2070601 和rs76558212与胃癌发病风险的关联,见表3。
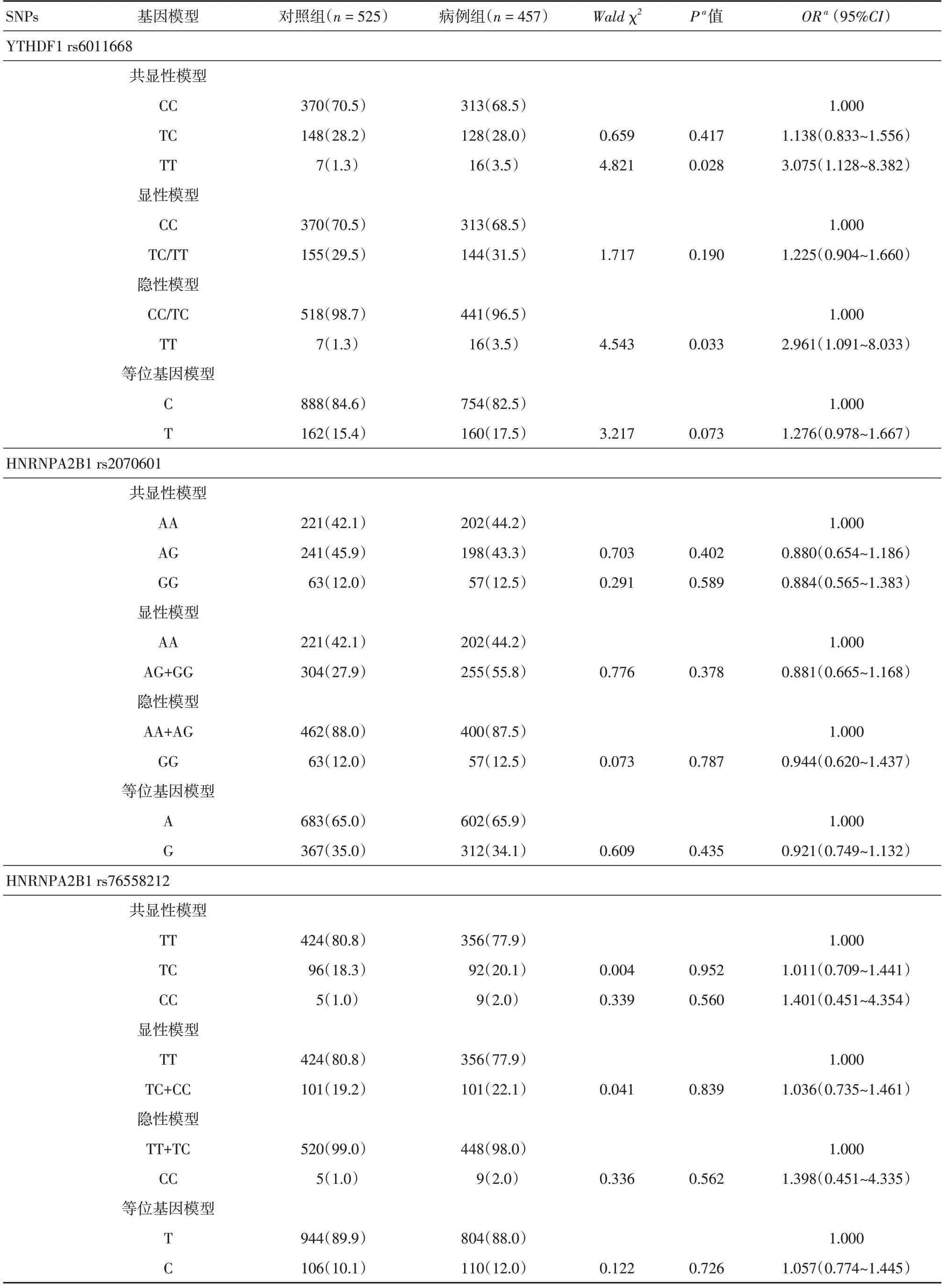
表3 候选SNPs基因型及等位基因频数分布Tab.3 Genotype distribution and allele frequencies of the candidate SNPs
2.4 YTHDF1 rs6011668与胃癌发病风险的分层分析为了进一步探究YTHDF1 rs6011668与胃癌发病风险的关联,本研究使用logistic回归对可能与胃癌发病风险相关的因素(年龄、性别、吸烟、饮酒、饮茶、吃腌制食物、吃油炸食物和家族肿瘤史)进行分层分析。结果表明:不饮茶亚组、吃腌制食物亚组和吃油炸食物亚组中,与CC/TC基因型相比,TT基因型携带者的胃癌的发病风险显著增加(P<0.05),见表4。
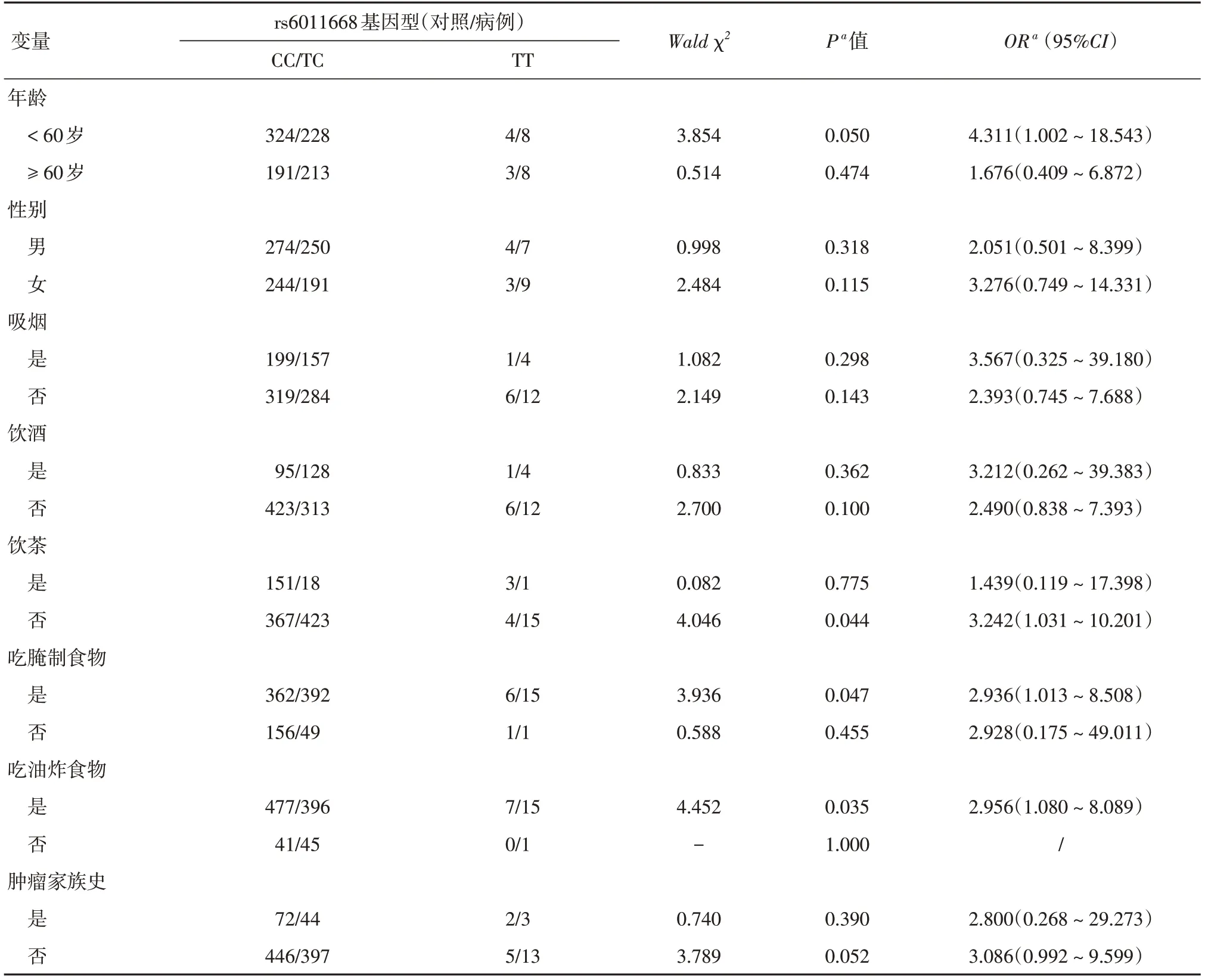
表4 YTHDF1 rs6011668与胃癌发病风险的分层分析Tab.4 Subgroups-analysis of YTHDF1 rs6011668 and the risk of gastric cancer
2.5 YTHDF1 rs6011668与胃癌临床特征的分层分析为了探究YTHDF1 rs6011668与胃癌临床进展(浸润程度、淋巴结转移、远端转移和临床分期)的关联,本研究使用logistic回归对不同胃癌临床病理特征进行分层分析。结果表明,与CC/TC基因型携带者相比,TT基因型携带者的胃癌浸润超过固有肌层、淋巴结转移、远端转移和中晚期胃癌的风险增加(P<0.05),见表5。
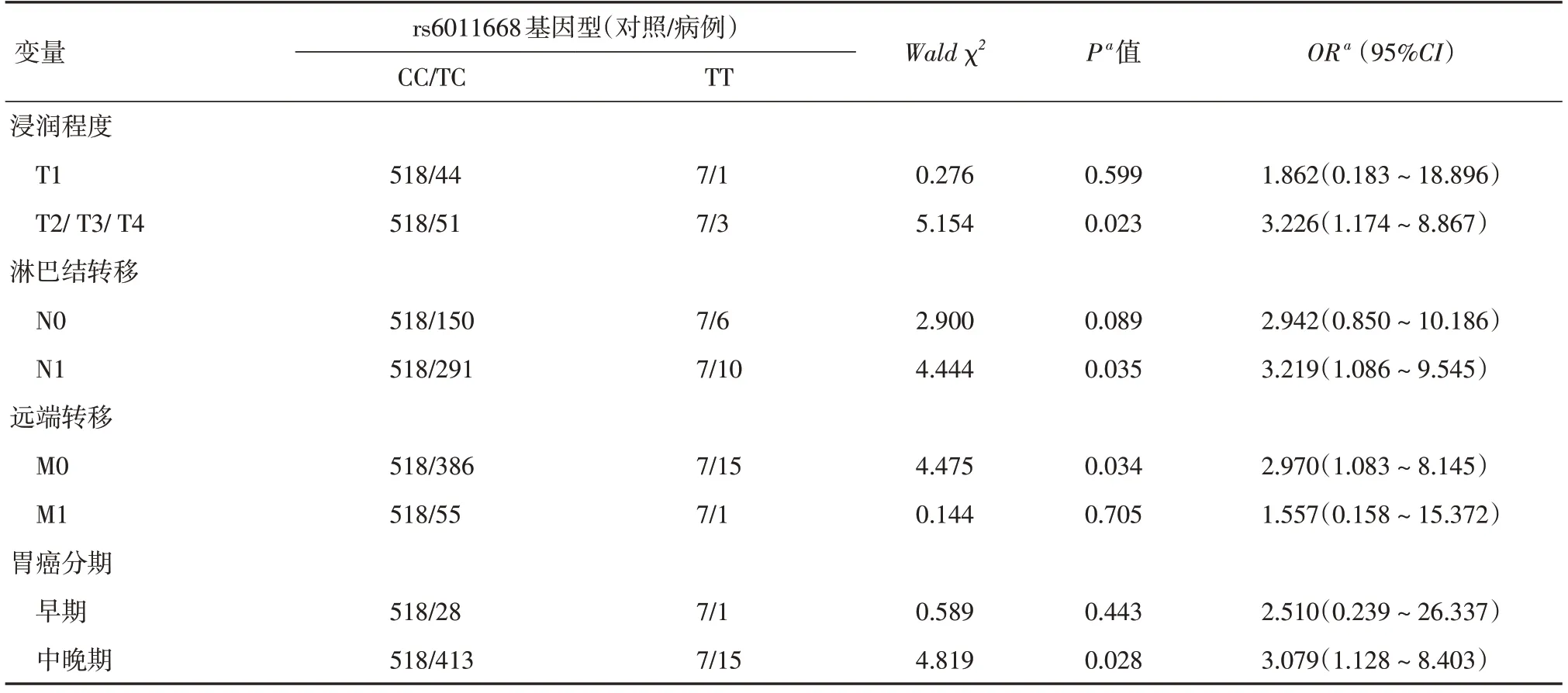
表5 YTHDF1 rs6011668与胃癌临床病理特征的分层分析Tab.5 Subgroups-analysis of YTHDF1 rs6011668 and the clinicopathological characteristics of gastric cancer
2.6 遗传-环境因素综合风险评分与胃癌发病风险的关联
2.6.1 单因素logistic回归分析胃癌相关环境因素单因素logistic回归分析胃癌相关因素,结果表明,饮酒、饮茶、吃腌制食品与胃癌发病风险相关:饮酒者胃癌的发病风险是不饮酒者的1.815倍(OR=1.815,95%CI:1.345~2.450,P<0.001);与不饮茶者相比,饮茶者发生胃癌的风险降低了89.5%(OR=0.105,95%CI:0.064~0.172,P<0.001);吃腌制食品者的胃癌发病风险是不吃腌制食品者的3.473倍(OR=3.473,95%CI:2.452~4.919,P<0.001),见表6。
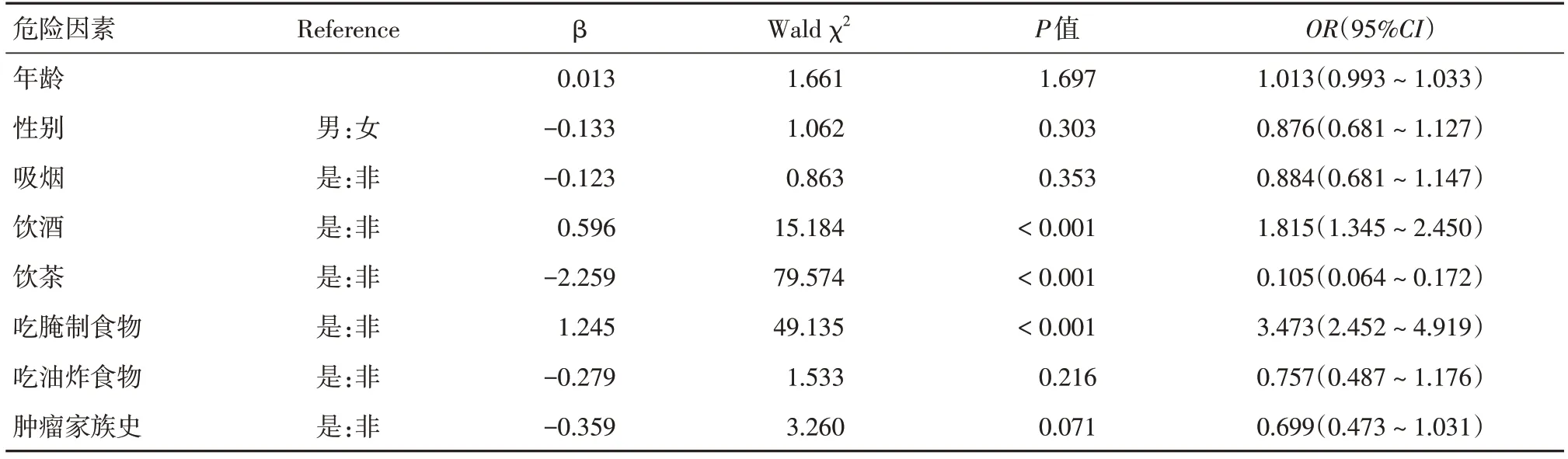
表6 单因素logistic回归分析胃癌相关因素Tab.6 A one-way logistic regression analysis of factors related to gastric cancer
2.6.2 多因素logistic回归分析胃癌相关因素及综合遗传-环境因素的 RS 在病例和对照中的分布YTHDF1 rs6011668是本研究新发现与胃癌发生风险相关的遗传因素,将遗传因素(rs6011668)和环境因素(饮酒、饮茶、吃腌制食品)纳入多因素logistic回归,结果显示,rs6011668、饮酒、吃腌制食品是胃癌的危险因素,饮茶是胃癌的保护因素。使用多因素logistic回归计算回归系数,从而计算研究对象的遗传·-环境因素综合的RS,公式为RS=-1.034 + 1.089 × wGRS + 0.991 × 饮酒 +(-2.560) × 饮茶 + 1.227 × 吃腌制食物。病例组和对照组的RS分别为0.33 ± 0.80和-0.62 ± 1.30,RS在两组间的分布差异有统计学意义(P<0.001),见表7和图1。
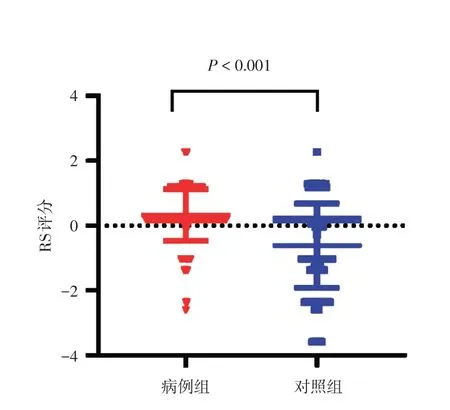
图1 遗传-环境因素综合 RS 在病例和对照中的分布Fig.1 Distribution of risk scores for combined geneticenvironmental factors in cases and controls
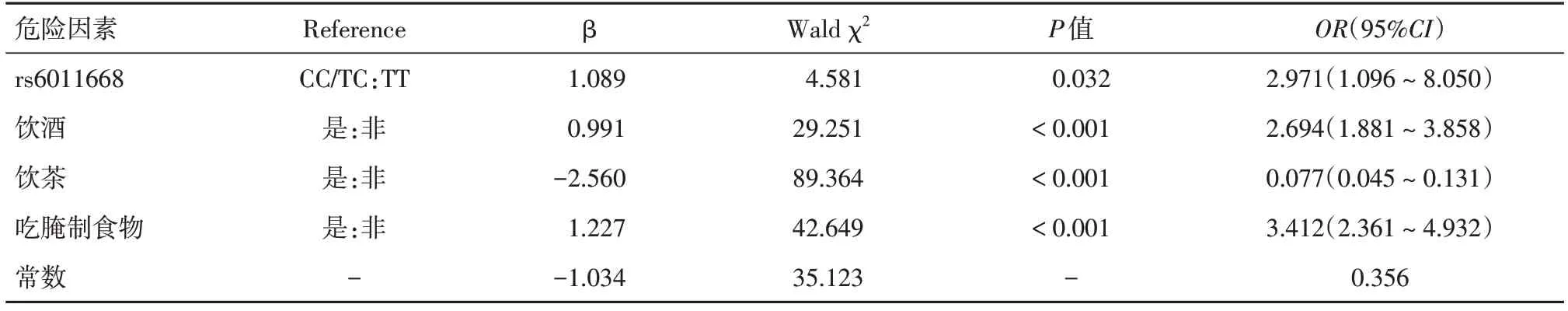
表7 多因素 logistic 回归分析胃癌的遗传和环境因素Tab.7 Multifactorial logistic regression analysis of genetic and environmental factors of gastric cancer
2.6.3 RS的四分位数分组与胃癌发病风险的关联RS得分越高,胃癌的发病风险越大。以RS四分位数对所有研究对象分组,与RS<Q25组相比,Q25 ≤ RS<Q50 组胃癌发病风险为3.090(OR=3.090,95%CI:1.718~5.559,P<0.001),Q50 ≤ RS<Q75组胃癌发病风险为 9.731(OR:9.731,95%CI:5.811~16.294,P<0.001),RS ≥ Q75组胃癌发病风险为 19.949(OR=19.949,95%CI:11.207~35.510,P<0.001),见表8。

表8 不同 RS 的四分位数分组与胃癌发病风险的相关性分析Tab.8 Correlation analysis between quartile groupings of different RS and the risk of gastric cancer
3 讨论
胃癌是全球发病率和致死率最高的恶性肿瘤之一,遗传因素和环境因素共同导致了胃癌的发生和发展。m6A修饰是一种广泛参与肿瘤和疾病发生发展的RNA修饰类型。SNP是人类基因组中最丰富的可遗传变异,可作为肿瘤遗传易感性生物标志物。因此,探究与胃癌发生发展相关的m6A修饰调控因子的功能性SNPs,成为探究胃癌危险因素的新方向。例如,LI等[15]研究发现,m6A去甲基化酶FTO和 ALKBH1的SNPs与胃癌风险相关:FTO rs2287142的AG/AA基因型与胃癌风险的降低显著相关;ALKBH1 rs1076496的GA/GG基因型与年龄≥ 55岁人群的胃癌风险增加密切相关,但与年龄<55岁人群的胃癌风险降低显著相关。此外,WANG等[16]研究发现m6A结合蛋白IGF2BP1的新型SNP rs9906944的CT/TT基因型与胃癌发病风险降低显著相关。
YTHDF1是一种重要的m6A结合蛋白,其被广泛报道参与调控宫颈癌、乳腺癌、卵巢癌、肠癌等多种人类癌症的发生发展[17-20]。课题组的前期研究发现 YTHDF1可能与胃癌的发生发展相关,YTHDF1在胃癌组织和胃癌细胞中表达上调,其表达谱变异与胃癌患者的高危亚型明显相关,有成为胃癌诊断生物标志的潜在可能[21];BAI等[22]研究发现YTHDF1在胃癌组织中过量表达,并通过诱导细胞增殖和抑制DCs介导的抗肿瘤免疫反应促进胃癌的发生发展;YOU等[23]实验证明具有高CD47表达和环状精氨酸-甘氨酸-天冬氨酸修饰的工程化小细胞外囊泡,用于有效传递针对YTHDF1的短干扰RNA,通过表观遗传和免疫调节治疗胃癌。截至目前,YTHDF1 rs6011668与肿瘤遗传易感性的相关性研究较少,LIU等[14]分析发现,rs6011668TC/TT基因型与年龄≤ 18个月儿童肾母细胞瘤风险的增加显著相关,但是在年龄>18个月儿童中,TC/TT基因型呈现保护因素。关于YTHDF1 rs6011668与胃癌遗传易感性的相关性尚未得知,本研究应用病例-对照研究,结合研究对象的一般人口统计学资料、生活方式和临床信息,探究rs6011668与胃癌风险的关联。研究发现,与CC/TC基因型携带者相比,TT基因型携带者胃癌的发病风险增加2.961倍,进一步分层分析发现,TT基因型主要增加不饮茶者、吃腌制食物者和吃油炸食物者的胃癌发病风险;此外,TT基因型携带者增加胃癌浸润程度、淋巴结转移、远端转移和中晚期风险。
HNRNPA2B1是另一种m6A结合蛋白,已经被报道在包括卵巢癌、食道癌、乳腺癌在内的多种癌症中发挥致癌作用[24],同时HNRNPA2B1与胃癌发生、发展和预后的研究也被报道:HNRNPA2B1在胃癌组织中高表达,化学靶向HNRNPA2B1恢复p53活性有成为治疗胃癌新策略的潜在可能[25];BIRC5异构体202(BIRC5-202)在胃癌细胞中发挥了致癌功能,HNRNPA2B1调节BIRC5的剪接,有成为化疗抗性胃癌细胞治疗目标的潜在可能[26]。目前鲜有HNRNPA2B1 SNPs与肿瘤发生发展相关性的研究报道,本研究探究了HNRNPA2B1 rs2070601和rs76558212位点与胃癌发病风险的关联,但未发现其与胃癌发病风险具有显著相关性。
胃癌的发生发展是环境因素和遗传因素共同作用的结果。研究表明,幽门螺旋杆菌感染、吸烟、饮酒、高盐饮食和高脂肪饮食等环境因素会增加胃癌的发病风险,饮茶、多水果蔬菜饮食和低盐饮食可以减少胃癌的发病风险[27]。例如,LI等[28]通过13.4年的随访研究发现,在男性中,饮酒与胃癌,尤其是贲门癌和非贲门癌风险的增加显著相关;亚硝胺大量存在于腌制食物中,REN等[29]研究发现食用咸肉或腌制蔬菜可能增加50%的胃癌发病风险;MARTIMIANAKI等[30]发现饮用绿茶能预防胃癌的发病。本研究发现饮酒、吃腌制食物是胃癌危险因素,饮茶是胃癌保护因素,与上述结果一致。为了探究环境-遗传因素与胃癌发病风险的关联,本研究将遗传(rs6011668TT基因型)和环境因素(饮酒、饮茶和吃腌制食物)加权后分别计算病例组和对照组的RS,探究两组间RS分布差异并分析其与胃癌发病风险的关联。研究发现,RS评分越高,胃癌的发病风险越高,与RS<Q25组相比,Q25 ≤ RS<Q50组、Q50 ≤ RS<Q75组和RS ≥ Q75组的胃癌发病风险分别为3.090、9.731和19.949,综合环境-遗传因素对胃癌发病风险的评估更准确。
综上所述,本研究通过病例-对照研究,首次探究了YTHDF1 rs6011668、HNRNPA2B1 rs2070601和rs76558212遗传变异与高发区人群胃癌风险的相关性,研究发现YTHDF1 rs6011668突变基因型与胃癌风险增加和临床进展加速相关,结合环境因素和遗传变异能够更好地评估胃癌的发病风险,为高发区人群胃癌发病风险的预测提供更好的参考依据。在今后的研究中,需要在更大规模的人群中进行进一步验证,并深入探究rs6011668对YTHDF1表达的影响,以便更科学地解释rs6011668与胃癌发生发展的关联。

