外周血Tfh细胞比例及其胞内IL-21含量与蓝光视网膜损伤的相关性
章梦一 余洋洋,2 李征亚 俞永珍,3 张春丽 程天豪,3 雷亦笑 周文杰 邹秀兰,3 邹玉平,2,3
1中国人民解放军南部战区总医院(广州 510010);2南方医科大学第一临床学院(广州 510515);3广州中医药大学(广州 510405)
光是视觉产生的基础,但同时光也可激活氧化自由基等对视网膜造成损伤[1]。能够产生视觉的环境光波长是380~760 nm,但暴露过长时间的可见光会导致视网膜损伤,对夜行动物来说,环境光强度的2~3倍能对其视网膜造成损伤[2]。视网膜光损伤模型一直被用来研究视网膜退行性疾病,如老年性黄斑变性(age-related macular degeneration,AMD),其引起的视网膜解剖结构的变化与啮齿类动物光损伤晚期阶段的视网膜细胞重塑极其相似[3]。蓝光目前是视网膜光损伤造模的主要选择。NAKAMURA[3]用1100Lux的蓝光连续照射C57BL/J小鼠7 d,发现小鼠出现了严重的视网膜光损伤,而12 000 Lux的白色光相同光照时间却并没有诱导严重的视网膜光损伤。JAVIER[4]等人揭示了对年轻白化小鼠暴露高强度(5000 Lux)白光7 d显著引起视网膜光损伤,但当滤除蓝光成分后,即使暴露在强烈的照射下,视网膜的光损伤也显著减少。
有学者[5-7]指出,视网膜光损伤可诱导炎症因子的表达以及补体反应。Tfh 细胞和 B 细胞的关系是相辅相成,缺一不可。滤泡辅助T细胞(T follicular helper,Tfh)是CD4+效应T细胞的一个亚群,它的效应功能与一些与衰老和/或炎症相关的疾病有关,如动脉粥样硬化、自身免疫性疾病[8]。Tfh细胞被认为通过各种途径协助B细胞增殖、类切换重组和抗体分泌,这些途径涉及ICOS、IL-21等的作用[9]。由于这些特征,我们定义外周循环血中CXCR5+ICOS+CD4+T细胞被认为是Tfh细胞的对应物。研究[10]发现,在AMD患者中存在Tfh细胞异常上调的现象。但目前未见Tfh细胞在早期视网膜光损伤的报道,本研究拟通过检测外周血Tfh细胞如例及胞内IL-21含量,寻找其与视网膜光损伤的相关性。
1 材料与方法
1.1 材料与仪器Brown Norway大鼠(北京维通利华实验动物技术有限公司);FL-1D蓝光辐照计(北京师范大学光电仪器厂),LED蓝光光源(具体参数:主波峰451 nm,色纯0.982(中山共炫光电科技有限公司);Topcon眼底照相机(日本Topcon公司);罗兰电生理仪、Ganzfeld刺激器(德国罗兰公司),实验动物专用操作台、金属环状角膜接触电极、金属针状角膜接触电极(北京高视远望有限责任公司),HE染色液、分化液、返蓝液(武汉塞维尔生物有限公司)、中性树胶(国药集团化学试剂有限公司),BX-51显微镜(日本Olympus公司),Anti-CD4 antibody(BD-561833),Anti-CXCR5 antibody(Bioss bs-3598R),Anti-ICOS antibody(Invitrogen 15-9949-82),IL-21(Bioswamp RA20183),CD4大鼠分选珠分离试剂盒、MACS 缓冲液、磁力架、磁珠分选柱(德国美天旎公司)。
1.2 实验分组随机将BN大鼠分为0 d组、3 d组、7 d组和14 d组,每组大鼠各6只,光照不同时间节点后观察各组各项指标的变化。本实验获得中国人民解放军南部战区总医院伦理委员会批准(编号:SYDW2022023)。制备大鼠用的蓝光光照用 LED 灯源,使用蓝光辐照计进行测量,使大鼠饲养箱的蓝光光照强度平均在(3 000 ± 500)Lux,其中该蓝光灯源的长宽规格为460 mm × 300 mm,光照时将该灯源朝向内部并置于大鼠饲养箱的顶部。大鼠随机分组后均在12 h明(45 Lux)和12 h暗(0 Lux)的循环光环境中适应2周,光照前暗适应至少24 h。除正常对照组外,其余光照组均放在自制的大鼠光照饲养箱中,持续光照3 h,光照结束后将大鼠送回暗环境中。
1.3 外周血Tfh细胞(滤泡辅助性T细胞)检测断尾采取EDTA抗凝外周血2 mL,按说明书采用Ficoll-Hypaque密度离心法分离PBMC后,取100 μL细胞悬液,并按说明书加入FITC-CD4、PE-CXCR5和PE-Cy5-ICOS抗体,避光于室温静置反应15 min后行流式细胞仪检测。
1.4 Tfh细胞胞内IL-21含量检测同上使用Ficoll-Hypaque密度离心法分离得到PBMC后,用CD4免疫磁珠分选CD4+T细胞,CXCR5抗体染色分选出的CD4+T细胞后离心得Tfh细胞,采用ELISA法检测Tfh细胞分泌的IL-21细胞因子浓度。
1.5 视网膜电图检查提前暗适应后,用复方托吡卡胺滴眼液散开大鼠瞳孔,腹腔麻醉后按照说明书将金箔记录电极安放在角膜中央,参考电极插入在大鼠两侧颊部浅表皮下组织,接地电极插入大鼠尾端浅表皮下组织,在Ganzfeld刺激器前暴露眼球,记录暗适应3.0ERG程序大鼠在光刺激下的波形。
1.6 眼底照相对大鼠行全身麻醉后,应用Topcon眼底照相机(日本Topcon公司)对大鼠行眼底照相。
1.7 HE染色检查行脊椎脱臼法处死大鼠后摘除双侧眼球,按脱水浸蜡、包埋、切片、切片脱蜡、苏木素染色、伊红染色、脱水封片和显微镜检查顺序依次处理。
1.8 统计学方法使用SPSS 20.0统计学软件进行数据分析。各检测指标使用均数加减标准差表示,各组的样本均数经Levene检验方差齐。采用two-way anova及普通方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 外周血Tfh细胞检测0 d、3 d、7 d和14 d组的Tfh细胞比例依次为(3.75 ± 0.59)%、(6.30 ±0.63)%、(9.38 ± 0.93)%和(13.93 ± 2.19)%(总体差异F=30.74),视网膜蓝光损伤后,外周血中 Tfh细胞比例随光照时间延长不断增加,3 d组、14 d组与0 d组相比,Tfh细胞比例明显增加,差异有统计学意义(P<0.05和P<0.01)(图1)。
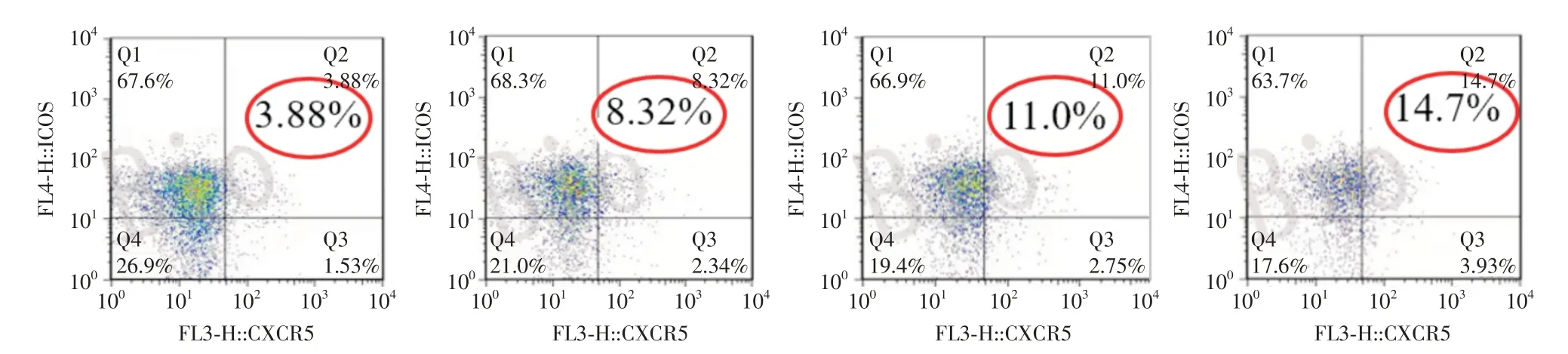
图1 流式细胞术检测 Tfh 细胞占外周血 CD3/4+T比例Fig.1 Flow cytometry was used to detect the proportion of Tfh cells in peripheral blood CD3/4+T cell
2.2 Tfh细胞内IL-21含量检测0 d、3 d、7 d和14 d组Tfh细胞内IL-21含量依次为(101.2 ± 3.23)pg/mL、(135.4 ± 6.42)pg/mL、(176.6 ± 17.14)pg/mL和(225.2 ± 20.59)pg/mL,胞内 IL-21含量也随光照时间延长均明显增加,3 d组、7 d组和14 d组与0 d组相比,差异均有统计学意义(P<0.05,P<0.01和P<0.01)(总体差异F=57.09,见图2)。
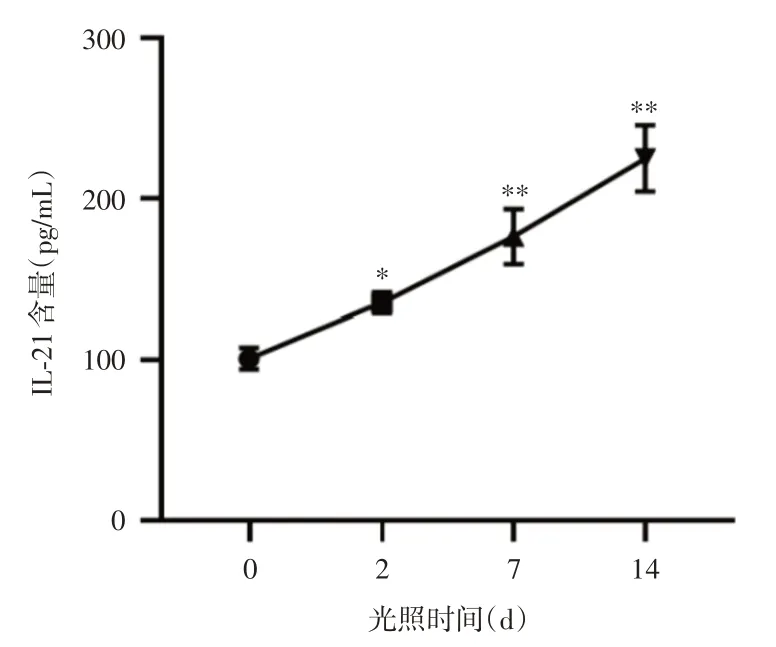
图2 不同组Tfh细胞内IL-21含量。Fig.2 IL-21 content in Tfh cells of different groups
2.3 视网膜电图检查蓝光照射可导致视网膜电生理功能下降,不同时间光照射后ERG波形发生特征性变化(见图3,表1-4)。ERG显示光损伤后视网膜功能降低,随光照时间延长而加重,a波潜伏期随光照时间延长而延长,其中7 d组和14 d组与0 d组相比,差异均有统计学意义(总体差异F=24.78,P<0.01和P<0.000 1),a波振幅随光照时间延长而降低,3 d组、7 d组和14 d组与0 d组相比,差异均有统计学意义(总体差异F=139.6,P<0.01、P<0.000 1和P<0.000 1);b波潜伏期随光照时间延长而延长,3 d组、7 d组和14 d组与0 d组相比,差异均有统计学意义(总体差异F=294.1,P均<0.0001),b波振幅随光照时间延长而降低,3 d组、7 d组和14 d组与0 d组相比,差异均具有统计学意义(总体差异F=120,P均<0.000 1)。
表1 不同光照组暗适应3.0ERG a波潜伏期(ms)Tab.1 Dark Adaptation in different light groups 3.0ERG A-wave latency (ms) ±s,ms
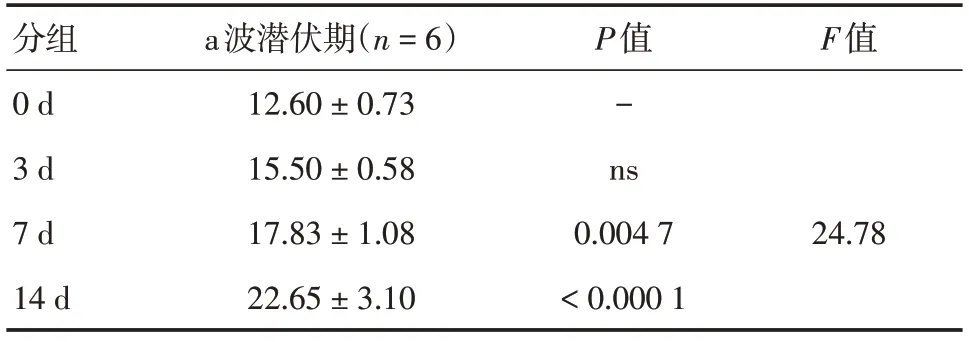
表1 不同光照组暗适应3.0ERG a波潜伏期(ms)Tab.1 Dark Adaptation in different light groups 3.0ERG A-wave latency (ms) ±s,ms
分组0 d 3 d 7 d 14 d a波潜伏期(n=6)12.60 ± 0.73 15.50 ± 0.58 17.83 ± 1.08 22.65 ± 3.10 P值-ns 0.004 7<0.000 1 F值24.78
表2 不同光照组暗适应3.0ERG a波振幅(uv)Tab.2 Dark adaptation to 3.0ERG a amplitude (uv)in different light groups ±s,uv
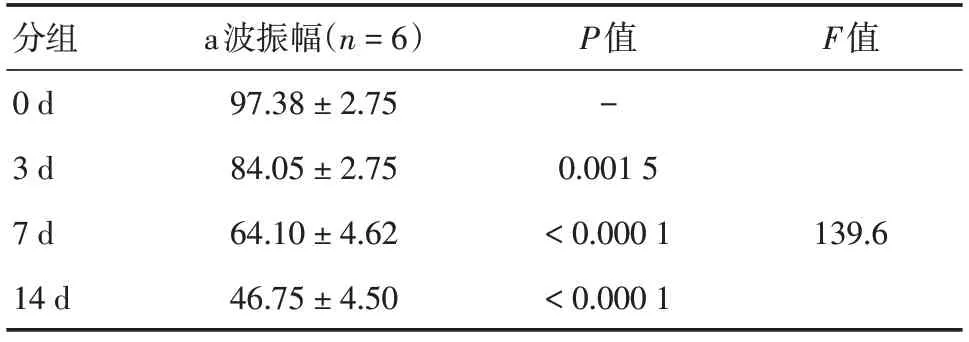
表2 不同光照组暗适应3.0ERG a波振幅(uv)Tab.2 Dark adaptation to 3.0ERG a amplitude (uv)in different light groups ±s,uv
分组0 d 3 d 7 d 14 d a波振幅(n=6)97.38 ± 2.75 84.05 ± 2.75 64.10 ± 4.62 46.75 ± 4.50 P值-0.001 5<0.000 1<0.000 1 F值139.6
表3 不同光照组暗适应3.0ERG b波潜伏期(ms)Tab.3 Dark Adaptation in different light groups 3.0ERG A-wave latency (ms) ±s,ms
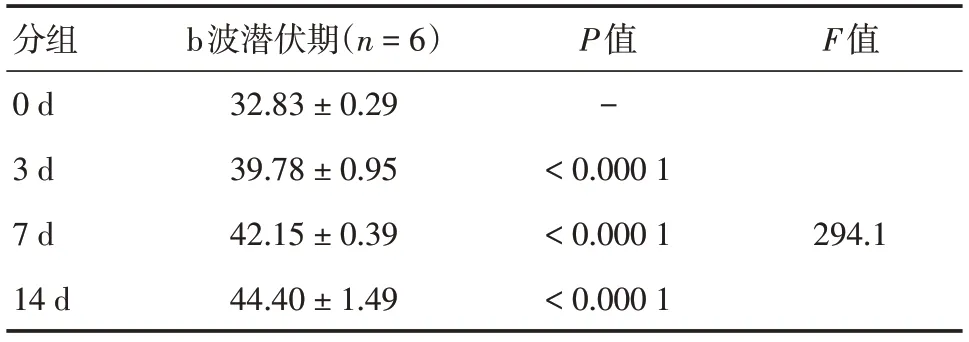
表3 不同光照组暗适应3.0ERG b波潜伏期(ms)Tab.3 Dark Adaptation in different light groups 3.0ERG A-wave latency (ms) ±s,ms
分组0 d 3 d 7 d 14 d b波潜伏期(n=6)32.83 ± 0.29 39.78 ± 0.95 42.15 ± 0.39 44.40 ± 1.49 P值-<0.000 1<0.000 1<0.000 1 F值294.1
表4 不同光照组暗适应3.0ERG b波振幅(uv)Tab.4 Dark adaptation to 3.0ERG b amplitude (uv)in different light groups ±s,uv
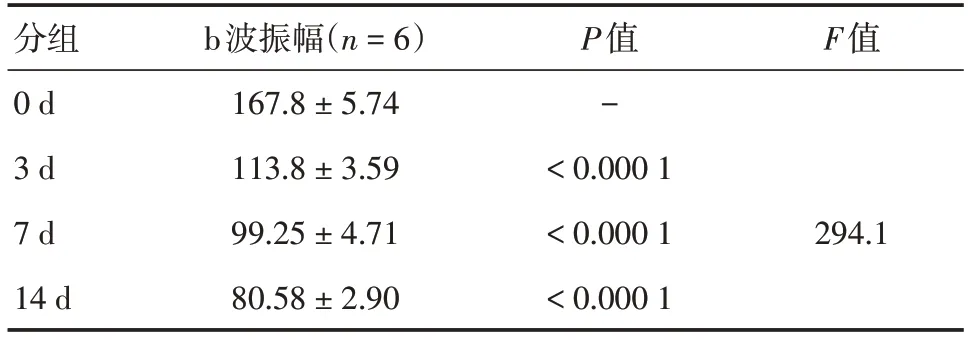
表4 不同光照组暗适应3.0ERG b波振幅(uv)Tab.4 Dark adaptation to 3.0ERG b amplitude (uv)in different light groups ±s,uv
分组0 d 3 d 7 d 14 d b波振幅(n=6)167.8 ± 5.74 113.8 ± 3.59 99.25 ± 4.71 80.58 ± 2.90 P值-<0.000 1<0.000 1<0.000 1 F值294.1

图3 各组暗适应3.0ERG波形变化Fig.3 Variation of 3.0ERG waveform in each group
2.4 眼底照相蓝光损伤可导致大鼠视盘色淡,视网膜动脉呈铜丝样甚至银丝样,视网膜静脉扩张,大量骨细胞样色素沉着以及出血和白点状颗粒改变(见图4)。其中0 d组(图4-A):视网膜平伏,视网膜血管、视盘结构清楚,未见出血点及黄白色点状颗粒;3 d组(图4-B):局灶性轻度的骨细胞样色素沉着,视网膜静脉扩张,偶可透见下方脉络膜大血管;7 d组(图4-C):视盘色淡,视网膜动脉呈铜丝样,时可见出血点;14 d组(图4-D):见大量骨细胞样色素沉着。

图4 光照对各组大鼠眼底的影响Fig.4 Influence of light on fundus of rats in each group
2.5 HE染色检查蓝光照射后大鼠视网膜组织变薄,其中视网膜外核层变薄更为显著(见图5)。0 d组大鼠各层视网膜厚度正常,各层组织结构清晰;3 d组全层视网膜结构大致正常,ONL轻度变薄;7 d组视网膜层间轻度肿胀,甚至变薄,ONL组织疏松,变薄,细胞核排列紊乱、部分堆积、甚至断层,RPE层萎缩、中断不连续和脉络膜小血管轻度萎缩;14 d组视网膜明显变薄,视网膜结构紊乱,其间呈空泡样改变,RPE 层萎缩、中断不连续和脉络膜小中血管萎缩。ONL厚度各组依次为(41.14 ±3.32)μm、(33.56 ± 1.28)μm、(27.82 ± 1.90)μm和(21.13 ± 2.27)μm(总体差异F=45.64),随光照时间延长ONL厚度明显变薄,3 d组、7 d组和14 d组与0 d组相比,差异均有统计学意义(P<0.05、P<0.05和P<0.01)。
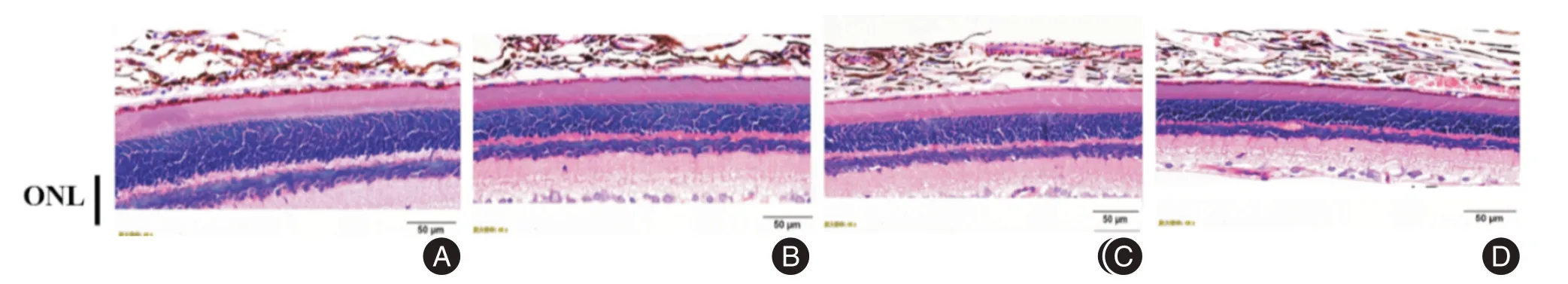
图5 光照对各组大鼠视网膜的影响Fig.5 Effect of light on the retina of rats in each group
2.6 Tfh 细胞与各指标相关分析采用Pearson相关分析法检测 Tfh 细胞与各指标之间的相关性(图6-7)。蓝光光照视网膜后:外周血Tfh细胞比例及其胞内IL-21含量与视网膜蓝光损伤的程度存在相关性(R2=0.855 1,P<0.000 1)。其中,外周血Tfh细胞比例与ONL厚度呈负相关(R2=0.823 2,P<0.000 1);外周血Tfh细胞比例与a波和b波峰时呈正相关(R2=0.842 6和R2=0.702 9,P均<0.000 1),外周血Tfh细胞比例与a波和b波振幅呈负相关(R2=0.907 8和R2=0.665 5,P均<0.000 1)。
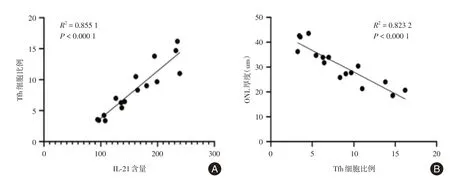
图6 Tfh细胞比例与胞内IL-21含量、ONL厚度相关分析Fig.6 Correlation analysis of Tfh cell proportion with intracellular IL-21 content and ONL thickness

图7 Tfh 细胞比例与暗适应3.0 ERG各指标间关系Fig.7 Relationship between Tfh cell proportion and dark adaptation 3.0 ERG
3 讨论
随着现代社会的进步与发展,人们使用和接触手机、电脑和节能灯霓虹灯等电子产品的时间与频率越来越多,电子产品中包含有大量450~475 nm的蓝光。蓝光在可见光中波长最短,光能量最大,穿透性最强,故蓝光最容易穿透角膜和晶状体达到眼底视网膜,并与视网膜产生作用造成损伤[11]。
本实验中,ERG 在造模后第5天[12]进行,因为光诱导的视网膜损伤从发生到视网膜出现稳定的损伤变化需要一定的时间,ERG 作为衡量视网膜功能学的指标,其波长和振幅均有不同程度的延长和降低,其中7 d组较3 d组变化更明显,HE染色显示3 d组大鼠ONL厚度轻度变薄,推测因光照时间较短,细胞功能未全部失活,有一定的自愈能力,而7 d组大鼠视网膜明显变薄,细胞核排列紊乱。表明7 d组大鼠无论在功能上还是形态学上,视网膜均有较大程度的光损伤。而程强[13]等人研究花青素对光诱导的大鼠视网膜保护时,发现光照3 h后3.0 ERG的a波和b波振幅明显下降,光照后的大鼠ONL细胞数减少。张楚[14]等人将SD大鼠暴露在蓝光的环境下,光照后HE染色检测显示视网膜萎缩和感光细胞层减少,上述研究结果与本实验的研究结果基本一致,光损伤可导致大鼠视网膜结构和功能受损。
Tfh细胞表面表达的趋化因子受体5(CXCR5)在C-X-C 趋化因子配体13 (chemokine C-X-C motif ligand 13,CXCL13)的趋化作用下介导Tfh细胞迁移至淋巴滤泡内的T细胞,随后与B细胞相互作用[9]。在生发中心,Tfh细胞被认为通过各种途径协助B细胞增殖、类切换重组和抗体分泌,这些途径涉及PD-1、CD40 L、ICOS和IL-21等的作用[9]。而Tfh细胞研究多见于HIV和重症肌无力等自身免疫性疾病的报道,与视网膜光损伤关系未知,本研究通过建立大鼠视网膜光损伤模型,按照不同光照时间分组,在建模完成后抽取大鼠外周血液检测Tfh细胞比例。结果显示:外周血Tfh细胞比例随着光照时间延长和大鼠视网膜光损伤加重呈上升趋势,表明Tfh细胞比例与蓝光视网膜损伤及其程度具有一定的相关性,目前国内外均未见相关研究报道。
IL-21是PARRISH等[15]在2000年发现的Ⅰ型细胞因子家族中IL-2亚家族的新成员,IL-21R主要在T细胞、NK细胞、树突状细胞(dendritic cell,DC)和巨噬细胞上表达,IL-21通过与IL-21R结合,调节T和B细胞的增殖和分化,影响T细胞、浆细胞和生发中心细胞的功能[16]。IL-21在促进肿瘤[17]和纤维化[18]的发生发展中起重要作用,如在结肠癌[19]的小鼠模型中,病例组的表达高于对照组。Tfh可分泌IL-21,且 IL-21为Tfh分泌的主要细胞因子,也是其最主要的效应执行分子。所以仅有Tfh细胞所占比例增多并不足以说明有功能的Tfh细胞参与了视网膜光损伤的过程,因此,本实验还通过胞外刺激破膜和ELISA法检测Tfh分泌的IL-21含量,发现随着光照时间延长和视网膜的损伤,外周血Tfh分泌的IL-21含量比例呈上升趋势,进一步表明Tfh细胞及其胞内IL-21含量与蓝光视网膜损伤相关,查阅文献目前未见相关研究报道。
本研究目前发现外周血的检测因子与视网膜蓝光损伤具有相关性,但其中的作用信号通路需进一步的研究。有研究[21]表明ICOS信号对于激活Tfh谱系转录因子Bcl6的早期诱导至关重要,Bcl6随后上调CXCR5的表达,同时在Tfh细胞上表达ICOS有助于维持Tfh分化[20]。因此,为进一步探讨Tfh细胞在视网膜光损伤中的作用机制,下一步拟探讨Tfh细胞是否通过ICOS/Bcl-6/CXCR5信号通路参与视网膜光损伤。

