Mettl14介导的m6A修饰对改善心肌梗死的分子机制
郑学斌 沙莎 杨慧琼 刘恋
长沙市第四医院(湖南师范大学附属长沙医院)全科医学科(长沙 410006)
心肌梗死(myocardial infarction,MI)是一个重大的公共卫生问题,随着治疗策略的改进,其病死率正在下降[1]。然而,在没有建立靶向治疗的情况下,与MI相关的心力衰竭仍然是一个主要问题。心肌梗死后心脏重塑是由左心室形状和功能的若干变化引起的,最终导致继发于心脏纤维化病理变化的心力衰竭[2]。作为真核信使RNA(mRNA)最丰富的化学修饰,已知N6-甲基腺苷(m6A)通过调节靶基因表达来影响各种基本的生物过程[3]。m6A水平的改变介导细胞凋亡、增殖、自我更新和发育[4]。然而,m6A甲基化在MI进展中的潜在作用仍有待进一步挖掘。甲基转移酶样14(methyltransferase-like 14,METTL14)是一种m6A写入蛋白,广泛参与了心血管发病机制等重大疾病的进展[5]。最近研究证实,METTL14在糖尿病性心肌病大鼠心肌组织中下调,其上调通过介导m6A修饰活性以NLRP3依赖性方式抑制心肌细胞焦亡[6]。然而,METTL14介导的m6A修饰是否调节MI及其潜在机制仍然未知。在这项研究中,我们探索了METTL14介导的m6A修饰在MI中的生物学作用,并揭示了METTL14可以作为一种新的预测生物标志物和治疗靶点来阻断MI的进展。
1 材料与方法
1.1 动物和分组处理4周大的雄性C57BL/6小鼠购自北京维通利华实验动物技术有限公司。所有小鼠都喂食标准食物和水。实验小鼠维持在标准条件下[在(22 ± 2)℃ 恒温和60%湿度的房间内],以12 h的昼夜循环为小鼠提供自由采食的食物和水。适应性喂养7 d,通过永久结扎左冠状动脉前降支(left anterior descending,LAD)构建MI小鼠模型[7]。假手术组进行相同的手术,但没有结扎LAD。将小鼠用于以下实验:实验1考察MI对小鼠心脏组织m6A修饰水平影响。将小鼠随机分为4组,每组10只:假手术组(Sham)、MI诱导后1 d组、4 d组和7 d组。实验2考察METTL14过表达对MI小鼠的改善作用。将小鼠随机分为4组,每组10只:Sham+AAV9-NC组、Sham+AAV9-METTL14组、MI+AAV9-NC组和MI+AAV9-METTL14组。各组小鼠分别在MI诱导前1周将AAV9-METTL14或AAV9-NC通过尾静脉注射到小鼠体内。MI诱导后4 d,收集心脏组织用于后续分析。动物实验经长沙市第四医院(湖南师范大学附属长沙医院)动物伦理委员会批准(批件号:XD-2020-12)。
1.2 AAV9介导的METTL14过表达AAV9基因组颗粒获自本元正阳基因技术有限公司。将METTL14克隆到AAV9载体(AAV9-METTL14)中,然后通过尾静脉注射到小鼠体内,滴度为每g体重0.5 × 1011个载体基因组(vg/g)。以相同的剂量和时间点注射对照AAV9载体(AAV9-NC)。
1.3 超声心动图使用带有MS400换能器的Vevo 2100回波在麻醉小鼠(3.0%异氟醚和1.0 L/min的O2流量)中进行二维超声心动图。计算了射血分数(%EF) 和缩短百分比(%FS)。
1.4 斑点印迹使用Trizol试剂(美国Invitrogen公司)从心脏样本和细胞中提取RNA。NanoDrop(美国Thermo Fisher Scientific公司)用于分析RNA质量。将RNA样品点样在尼龙膜上。然后将膜放入紫外交联剂中交联5 min。将膜置于5%脱脂牛奶中密封2 h,加入m6A一抗4 ℃孵育过夜。第2天,应用二抗孵育2 h。另一张膜用亚甲蓝染色作为对照。
1.5 心脏微血管内皮细胞(cardiac microvascular endothelial cells,CMECs)分离和分组处理根据先前的研究[8],使用CD31偶联微珠从小鼠心肌组织中分离CMECs,并在内皮培养基(ECM,美国ScienCel公司)中培养。为了在体外刺激缺氧缺血微环境,对细胞进行去氧葡萄糖(oxygen-glucose deprivation,OGD)处理。CMECs在动态O2和CO2分室控制器Oxycycler C42(美国Biospherix公司)中于37 ℃下培养24 h,气体混合物由5% CO2和95% N2组成。将细胞分为以下两个实验:实验1考察考察OGD处理对CMECs中m6A修饰水平影响,将细胞分为NC组和OGD组,NC组在正常环境下培养,OGD组则进行OGD处理。实验2考察METTL14是否通过USP48对OGD诱导的CMECs细胞起保护作用,将细胞分为NC组、OGD组、OGD + SgNC组、OGD + METTL14KO组和OGD +METTL14KO + USP48组。除NC组外,其余组建立OGD模型。OGD + SgNC组、OGD + METTL14KO组和OGD + METTL14KO + USP48组在建立OGD模型前48 h分别用SgNC、METTL14KO或USP48过表达质粒转染细胞。
1.6 CRISPR/Cas9技术敲除CMECs中的METTL14我们设计了靶向METTL14的单向导RNA(METTL14KO) (http://crispr.mit.edu):mMETTL14-sgRNA:CGCTTCGCGAGAGATTGCA。sgRNA至少选择10~15个单克隆进行敲除检测。接下来,设计引物以扩增敲除的目标片段并送去测序。使用Lenti-V2-GFP病毒载体构建敲除病毒。
1.7 免疫荧光将心脏组织在/Tween-20封闭溶液中孵育1 h。然后将样品与一抗在4 ℃下孵育过夜,并在室温下与适当的荧光二抗孵育3 h。细胞核用DAPI染色。用LSM700激光扫描共聚焦显微镜(德国Carl Zeiss公司)捕获图像。免疫印迹的一抗如下:α-SMA (1∶500,英国Abcam公司)、CD31(1∶500,英国Abcam公司)和VE-Cadherin(1∶500,英国Abcam公司)。
1.8 ROS染色检测在等密度的6孔培养皿上铺板的CMECs中测量线粒体ROS水平[9]。细胞在37 ℃下用线粒体ROS指示剂MitoSOX™ Red(2 μmol/L,美国Invitrogen公司)染色15 min。使用LSM700激光扫描共聚焦显微镜获得细胞图像。
1.9 RNA-seq和数据分析在OGD处理24 h后,收集METTL14敲低细胞及其对照用于RNA-seq。通过Oligo dT富集总RNA样品,然后使用KAPA Stranded RNA-Seq Library Prep Kit(美国Illumina公司)构建文库。采用Illumina NovaSeq 6000仪器进行测序。根据Arraystar的标准方案进行小鼠m6AmRNA表观转录组微阵列样品制备和微阵列杂交。
1.10 蛋白质印迹将从组织和细胞中收集的蛋白通过10%~15% SDS-PAGE分离并转移到硝酸纤维素膜上。将膜与一抗在4 ℃下孵育过夜。次日,将膜与二抗一起孵育1 h,使用增强的化学发光试剂(美国Millipore Sigma公司)观察免疫反应条带。研究使用的一抗和二抗购自英国Abcam公司。以β-actin作为内源性参考,使用Image J软件对蛋白质进行量化。
1.11 统计学方法所有结果均以平均值 ± 标准差表示。使用SPSS 25.0软件进行统计分析。应用单向方差分析进行多重比较,组间两两比较使用Student-Newman-Keuls事后检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MI和OGD诱导m6A修饰异常心脏组织RNA m6A修饰水平在MI诱导后4 d和7 d高于Sham组(图1A)。MI诱导后1、4、7 d,METTL14表达降低,METTL3表达升高;其他酶(KIAA1429、WTAP、ALKBH5和FTO)没有明显变化(图1B),此外,在OGD诱导的CMECs细胞中检测到RNA m6A修饰水平高于NC组,并且METTL14表达降低(图1C、D)。
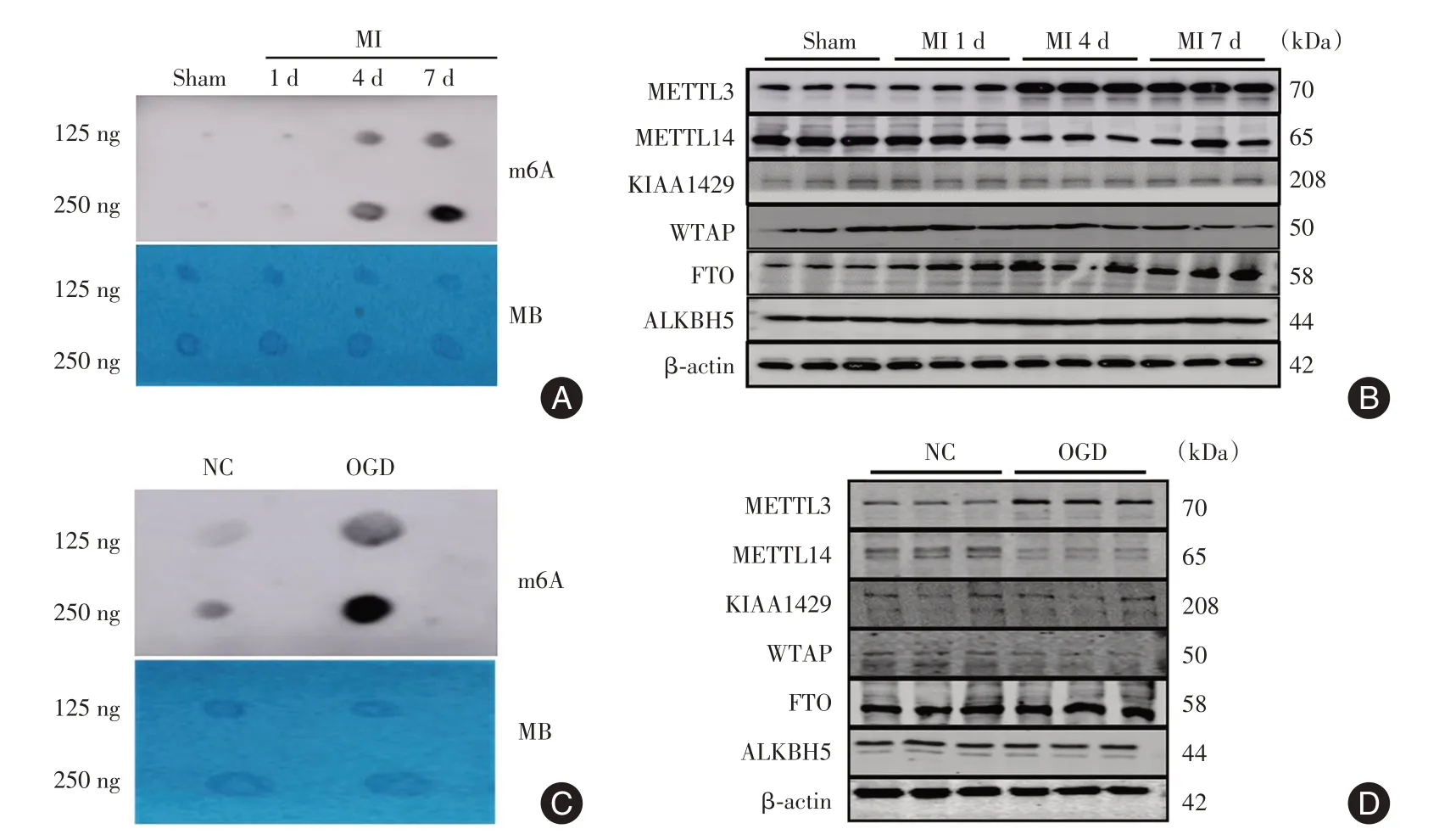
图1 MI和OGD诱导m6A修饰异常Fig.1 Abnormal m6A modification induced by MI and OGD
2.2 METTL14上调改善MI小鼠的微血管损伤和心脏功能小鼠在接受心肌MI损伤或假手术前,通过尾静脉注射AAV9-METTL14上调心脏组织中METTL14(图2A)。与Sham+AAV9-NC组相比,MI +AAV9-NC组小鼠心脏组织中血管内皮连接蛋白VE-cadherin表达显著下调(P<0.05)。MI+AAV9-METTL14组小鼠心脏组织中VE-cadherin表达较MI +AAV9-NC组显著上调(P<0.05)(图2B)。MI+AAV9-METTL14组的射血分数显著高于MI+AAV9-NC组(P<0.05),和左心室尺寸低于MI +AAV9-NC组(P<0.05)(表1)。
表1 MI后各组小鼠超声心动图参数和心脏/体重的差异Tab.1 Differences of Echocardiographic Parameters and Heart/Weight of Mice in Different Groups after MI ±s
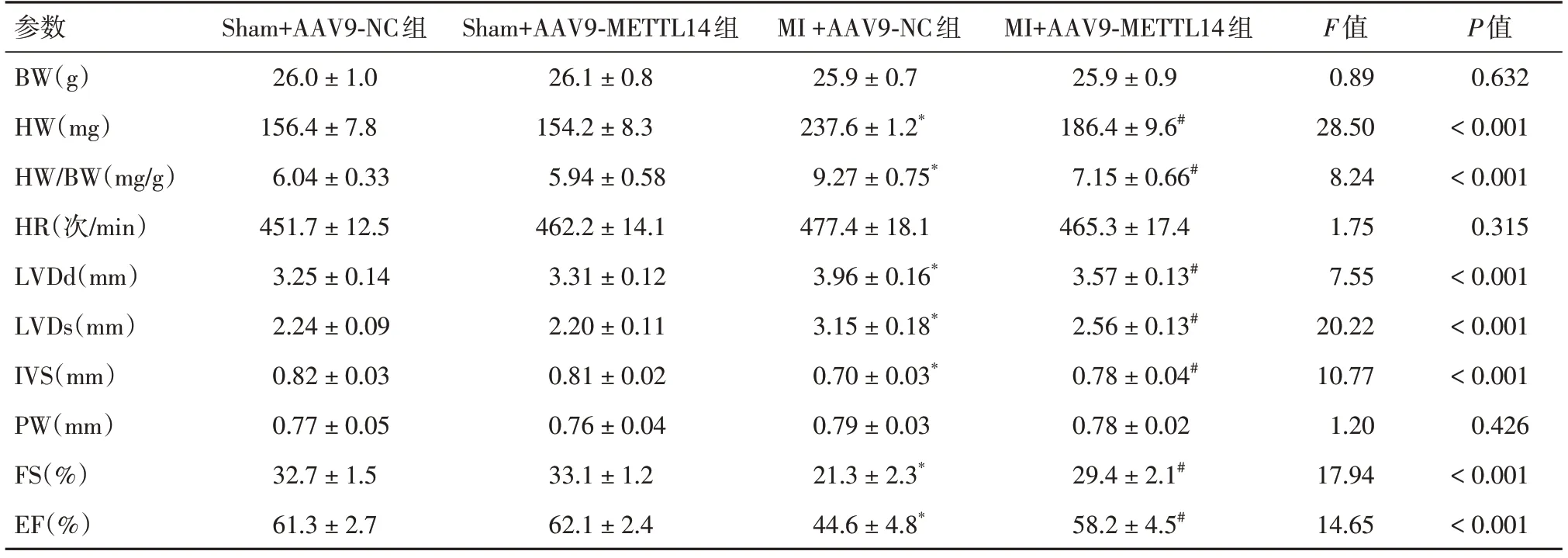
表1 MI后各组小鼠超声心动图参数和心脏/体重的差异Tab.1 Differences of Echocardiographic Parameters and Heart/Weight of Mice in Different Groups after MI ±s
注:BW,体重;HW,心脏重量;LVDd,左心室舒张期尺寸;LVDs,左心室收缩尺寸;IVS,室间隔厚度;PW,后壁厚度;PW,后壁厚度;FS,左心室缩短率;HR,心率;与Sham+AAV9-NC组比较,*P<0.05;与MI +AAV9-NC组比较,#P<0.05
P值0.632<0.001<0.001 0.315<0.001<0.001<0.001 0.426<0.001<0.001参数BW(g)HW(mg)HW/BW(mg/g)HR(次/min)LVDd(mm)LVDs(mm)IVS(mm)PW(mm)FS(%)EF(%)Sham+AAV9-NC组26.0 ± 1.0 156.4 ± 7.8 6.04 ± 0.33 451.7 ± 12.5 3.25 ± 0.14 2.24 ± 0.09 0.82 ± 0.03 0.77 ± 0.05 32.7 ± 1.5 61.3 ± 2.7 Sham+AAV9-METTL14组26.1 ± 0.8 154.2 ± 8.3 5.94 ± 0.58 462.2 ± 14.1 3.31 ± 0.12 2.20 ± 0.11 0.81 ± 0.02 0.76 ± 0.04 33.1 ± 1.2 62.1 ± 2.4 MI +AAV9-NC组25.9 ± 0.7 237.6 ± 1.2*9.27 ± 0.75*477.4 ± 18.1 3.96 ± 0.16*3.15 ± 0.18*0.70 ± 0.03*0.79 ± 0.03 21.3 ± 2.3*44.6 ± 4.8*MI+AAV9-METTL14组25.9 ± 0.9 186.4 ± 9.6#7.15 ± 0.66#465.3 ± 17.4 3.57 ± 0.13#2.56 ± 0.13#0.78 ± 0.04#0.78 ± 0.02 29.4 ± 2.1#58.2 ± 4.5#F值0.89 28.50 8.24 1.75 7.55 20.22 10.77 1.20 17.94 14.65
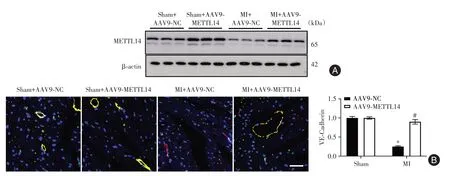
图2 METTL14上调改善MI小鼠的微血管损伤Fig.2 Up-regulation of METTL14 improves microvascular injury in MI mice
2.3 METTL14上调减轻MI诱导的内皮线粒体功能障碍与Sham+AAV9-NC组小鼠相比,在MI+AAV9-NC组小鼠中观察到线粒体长度显著缩短(P<0.05),片段化线粒体的形成显著增加(P<0.05),同时伴随线粒体ROS水平显著增加(P<0.05)。AAV9-METTL14抑制了MI诱导的内皮线粒体功能障碍(图3)。
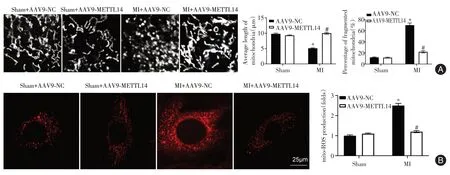
图3 METTL14上调减轻MI诱导的内皮线粒体功能障碍Fig.3 Up-regulation of METTL14 alleviates MI-induced endothelial mitochondrial dysfunction
2.4 METTL14介导USP48 mRNA的m6A修饰METTL14敲低显著影响CMECs细胞基因的表达(图4A)。6个转录本在RNA-seq和表观转录组微阵列数据中重叠。将这6个转录本与MI心脏组织的RNA-seq进行了比较。结果发现只有USP48降低,m6A甲基化水平受METTL14显著调节并影响其表达(图4B)。与Sham+AAV9-NC组相比,MI+AAV9-NC组小鼠心脏组织中USP48表达显著下调(P<0.05)。MI+AAV9-METTL14组小鼠心脏组织中USP48表达较MI +AAV9-NC组显著上调(P<0.05)(图4C)。

图4 METTL14介导的USP48 mRNA的m6A修饰Fig.4 m6A modification of USP48 mRNA mediated by METTL14
2.5 METTL14通过USP48对OGD诱导的CMECs细胞起保护作用与NC组相比,在OGD组CMECs细胞中观察到线粒体ROS水平显著增加(P<0.05),同时伴随着VE-cadherin表达水平显著降低(P<0.05)和α-SMA水平显著增加(P<0.05)。CMECs细胞中METTL14敲低加剧了这些变化(P<0.05),当加入USP48过表达质粒则逆转了这些变化(P<0.05)(图5)。
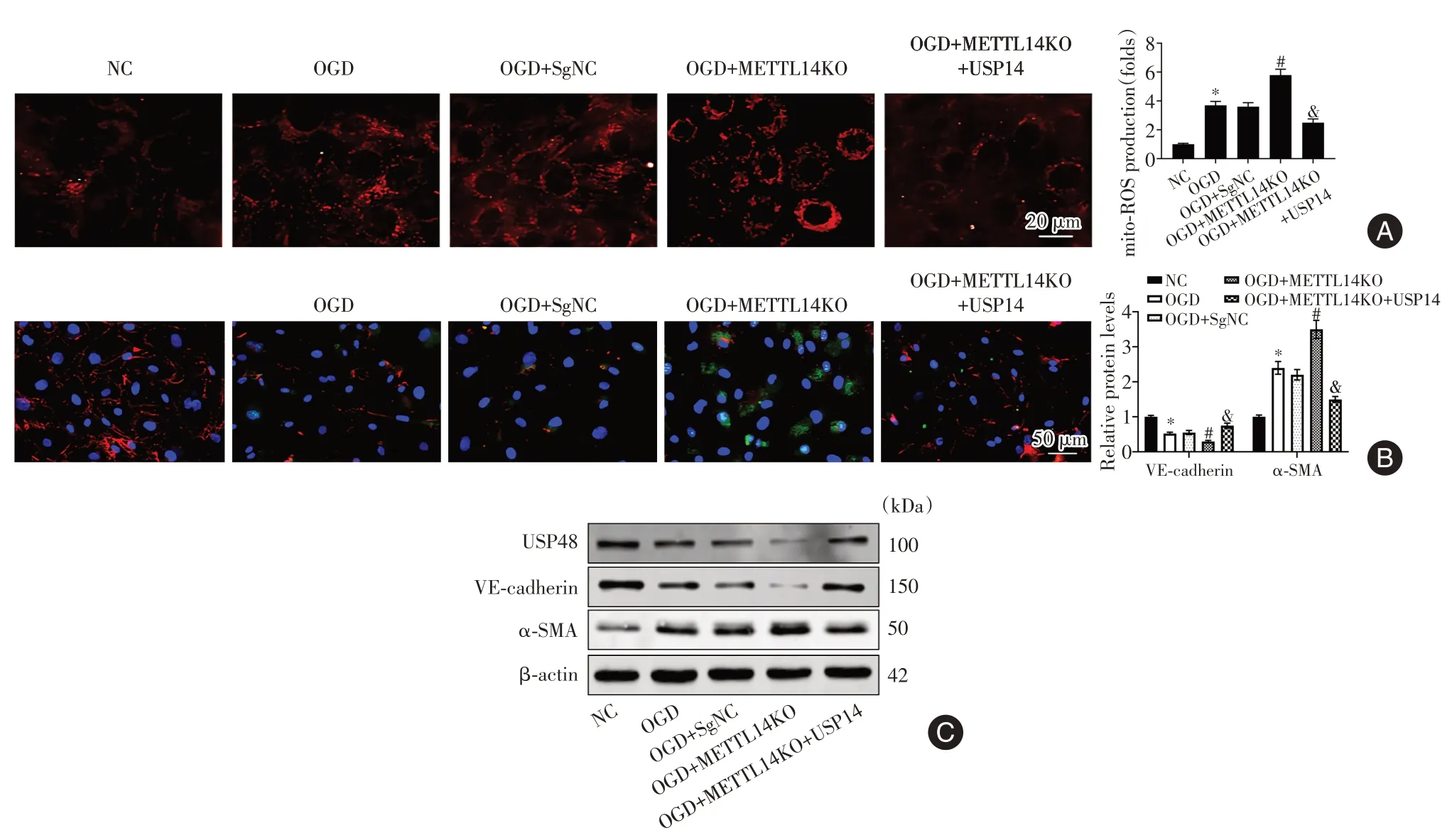
图5 METTL14通过USP48对OGD诱导的CMECs细胞起保护作用Fig.5 METTL14 protects CMECs cells induced by OGD through USP48
3 讨论
MI引起的微血管损伤的分子机制相对复杂,因此在心脏MI损伤期间保护心脏微循环的药物很少。m6A修饰是真核mRNA和非编码RNA中最丰富的修饰,在各种人类疾病中发挥着重要作用,包括癌症进展、糖尿病、神经发育障碍和缺血性心脏病[10]。最新证据[11-13]表明m6A修饰与CVD的发生和进展密切相关,包括心脏肥大、心力衰竭、缺血性心脏病等。然而,METTL14是否与心血管疾病有关,例如MI,在很大程度上是未知的。在这项研究中,我们证明MI中m6A水平显著增加是由于甲基转移酶METTL14的下调。METTL14上调改善MI小鼠的微血管损伤和心脏功能,与先前研究发现一致[14-15]。
几项研究已经描述了METTL14在内皮损伤中的作用,但是这些报道的结论并不一致。研究[16]表明,人动脉平滑肌细胞模型中的METTL14沉默减少了钙化并增强了血管修复功能。另一项研究[17]报道,METTL14的表达降低可以抑制内皮炎症和动脉粥样硬化的发展,表明METTL14可能作为动脉粥样硬化临床治疗的潜在靶点。然而,与m6A水平升高会导致许多心脏病的心脏损伤的证据相反,PANG等[18]研究发现,在I/R损伤期间,腺病毒介导的METTL14过表达显著减少了梗死面积和内皮细胞凋亡,并改善了心脏功能。我们的结果与PANG等[18]发现一致,功能增益和功能丧失测定结果显示,METTL14上调改善MI小鼠的微血管损伤和心脏功能,METTL14敲低则加剧了OGD诱导的CMECs细胞损伤。这些数据解释了METTL14介导的m6A修饰对缺血性心脏的保护作用。
据报道,线粒体损伤有助于MI诱导的内皮损伤[19]。心肌缺血迅速增强线粒体裂变因子诱导的线粒体裂变,导致mtDNA损伤和内皮氧化应激[19]。此外,心肌缺血通过诱导线粒体膜高渗透性、mPTP开放和细胞色素c渗漏来激活线粒体凋亡[20]。同样地,本研究发现在MI处理的CMECs中线粒体形态学发生改变,氧化应激被诱导,而AAV9-METTL14抑制了MI诱导的内皮线粒体功能障碍。从机制上讲,CMECs细胞中降低的METTL14会刺激USP48 mRNA的m6A修饰,导致USP48的稳定性降低。先前研究[21]已证实,USP48在肝细胞癌中的异常表达与METTL14诱导的m6A修饰有关,该修饰影响了USP48 mRNA的稳定性。此外,代谢是USP48消融改变的最显著富集的途径,即USP48的消耗增强了有氧糖酵解的代谢通量,同时增加了线粒体断裂[22]。在进一步研究中,我们发现USP48过表达逆转了OGD对METTL14敲低的CMECs细胞的损伤作用。这些结果表明,METTL14可能通过调节USP48的m6A修饰参与介导MI内皮线粒体功能障碍。
总之,我们的研究结果首次揭示METTL14在MI中低表达,并通过增加CMECs细胞USP48的m6A修饰水平以降低其稳定性,从而介导CMECs细胞线粒体功能障碍。我们的工作揭示了MI的新致病机制,并为探索有效的MI治疗策略开辟了新途径。然而,m6A稳态是通过m6A甲基化酶复合物和去甲基化酶的协调调节来实现,本研究并未阐明METTL3和METTL14的相互作用关系,及其对m6A修饰水平的影响,值得在未来的研究中做进一步探讨。

