精子膜及线粒体活性氧对男性生育力的影响及其在辅助生殖技术中的应用
刘居理 陈胜辉 李琳 姚文亮 杨丽娟 饶研文
江西中医药大学附属生殖医院(南昌市生殖医院)(南昌 330004)
目前,精液常规分析仍然是临床用来评估男性生育力最为主要的手段,也是最为常规的检测。据估计,精液常规分析评价生育力仅有70%的准确性。其主要原因在于常规精液分析只检测了精液的理化性质、精子浓度、数量、活力等。而这些指标只能反映精液的基本情况,并不能对精子内在功能进行评估。由于导致男性不育的因素众多,而且存在个体差异,外加精液参数参考范围较广,因此除了无精子症或严重少、弱、畸形精子症外,仅仅通过精液分析对男性生育力进行评估是很不准确的。有研究[1]表明,临床上大约有1/3的男性不育患者常规精液分析结果均正常和接近正常,因此有必要进一步完善精子功能评估的方法。
近年来,随着研究的深入及技术的发展,出现了一些新的评估精子功能的方法,如精子核DNA完整性、线粒体膜电位、诱发精子顶体反应、精子活性氧(reactive oxygen species,ROS)检测等。已有研究[2]表明,精子ROS对精子质膜损伤所导致的受精能力丧失是造成男性不育的主要原因之一。研究[3]发现,适量ROS对精子受精具有重要的生理作用,但如果ROS过量则可造成精子损伤,导致精子活力下降、死亡率增高,从而引起男性不育。有研究表明,在25%~40%的不育男性的精液中检测到高水平的ROS。因此,ROS对男性生育力的影响越来越受到生殖医学工作者的重视。而采用体外受精-胚胎移植技术进行助孕过程中,需要对精液进行优化处理。由于精浆中含有抗氧化酶,对精子具有保护作用,而精液处理通常需要去除精浆,从而使精子更易受到ROS的损伤。另外,在精液处理过程中,往往需要进行离心,而精液多次离心会显著增加ROS水平[4]。高水平的ROS可能会增加精子DNA断裂率,而已有研究将精子DNA损伤与胚胎死亡增加联系起来。因此,ROS是影响男性生育力及辅助生殖技术成功的一个重要病因和病理因素,其在生殖医学的地位是不容忽视的。
以往许多研究[5-6]都是针对精浆中的ROS进行的,而精浆ROS水平受精液中白细胞的干扰非常大[7],导致结果与实际可能存在较大偏差,影响了研究结论的准确性,也限制了其在临床的应用。近年来,随着技术的不断发展以及生殖领域对病因探索的进一步需求,准确评估精子膜及线粒体ROS水平显得更具意义,因为精子本身ROS更能反映其内在功能。而目前对精子膜及线粒体ROS在生殖领域的应用研究甚少,因此有必要明确精子膜及线粒体中ROS对男性生育力的影响及其在辅助生殖技术中的应用价值,以期为男性不育患者提供一个新的生育力评估手段及病因治疗方向,为辅助生殖助孕患者受孕时机的选择提供一个参考指标。
1 资料与方法
1.1 研究对象选取来我院就诊的男性不育患者150例,拟接受体外受精-胚胎移植助孕的夫妇50例及正常生育志愿者50例为研究对象并签署知情同意书。男性不育患者纳入标准:同居两年以上未避孕,性生活正常而未育,女方检测未发现异常,年龄≤ 45岁。正常生育志愿者纳入标准:精液检测参数在正常参考范围内且近2年内已生育男性,年龄≤ 45岁。拟接受体外受精-胚胎移植助孕的夫妇纳入标准为:(1)夫妇染色体检查均为正常核型,男性检査包括男性第二性征、阴茎、阴囊、精索、输精管、附睾、睾丸等均无异常。(2)单纯由女性输卵管因素导致不育。女方年龄≤ 35岁,助孕次数≤ 2次,不孕年限≤ 5年,MⅡ卵子数≥ 4枚。本研究在实施前已通过医学伦理委员会的审查批准(南昌市生殖医院医伦审字2021年第008号)。
1.2 分组为探讨精子ROS与男性不育的关系,将研究对象分为:男性不育组(150例男性不育患者)和正常生育组(50例正常生育志愿者)。为探讨精子ROS与精子膜功能和精子核DNA完整性的关系,根据精子ROS检测结果将上述200例男性研究对象分为:ROS正常组(精子膜高ROS精子比例≤ 40%且线粒体高ROS精子比例≤ 55%)和ROS异常组(精子膜高ROS精子比例>40%或线粒体高ROS精子比例>55%)。为探讨精子ROS与受精率,卵裂率,优胚率及妊娠结局的关系,根据男方精液优化处理后精子ROS检测结果将50例拟接受体外受精-胚胎移植助孕的夫妇分为:IVF对照组(精子膜高ROS精子比例≤ 40%且线粒体高ROS精子比例≤ 55%)和IVF观察组(精子膜高ROS精子比例>40%或线粒体高ROS精子比例>55%)。
1.3 研究方法
1.3.1 精液样本采集及精液常规分析按《WHO人类精液分析实验室技术手册》(第5版)要求对男性不育组及正常生育组进行精液采集及常规分析和精子膜功能测定,并留取100 μL精液标本存储于-20 ℃冰箱用于精子核DNA完整性的测定。同时对其精子膜及线粒体ROS进行测定并根据结果将研究对象分为ROS正常组及ROS异常组。
1.3.2 精子膜及线粒体ROS测定采用DCFHDA及MitoSOX Red对精子进行染色,利用流式细胞仪对精子膜及线粒体ROS水平进行检测及分析。根据试剂盒提供的阈值:精子膜高ROS精子比例≤ 40%且线粒体高ROS精子比例≤ 55%者为活性氧正常,精子膜高ROS精子比例>40%或线粒体高ROS精子比例>55%者为活性氧异常。
1.3.3 精子膜功能测定精液液化后用伊红Y对精子进行染色,利用相差显微镜对染色后精子进行观察,分析精子膜功能情况。
1.3.4 精子核DNA完整性测定采用吖啶橙对精子进行染色,利用流式细胞仪对精子核DNA完整性进行检测,通过DNA碎片指数(DFI)分析软件对精子核DNA完整性进行分析。
1.3.5 促排卵及取卵根据患者情况选择合适的方案进行促排卵,在B超监测下行穿刺取卵术。
1.3.6 精液优化处理采用双层密度梯度离心法对接受体外受精-胚胎移植助孕夫妇的男方精液进行优化处理后,在充分保证体外受精所需精子的情况下,留取部分精子并进行精子膜及线粒体ROS测定并根据结果将研究对象分为IVF对照组及IVF观察组。
1.3.7 体外受精采用常规IVF受精方式进行。
1.3.8 受精观察及胚胎评估在取卵后的第1天(D1)进行受精情况的观察,第3天(D3)进行卵裂期胚胎的观察,第5天(D5)及第6天(D6)进行囊胚期的观察并记录。
1.3.9 胚胎移植对适合新鲜移植的患者,在取卵后的第3天进行卵裂胚的移植或在取卵后的第5天或第6天进行囊胚移植。对不适合新鲜移植的患者,则将可用胚胎进行玻璃化冷冻并保存,择期移植。
1.3.10 妊娠结局随访移植后35 d随访临床妊娠情况。
1.4 统计学方法采用SPSS 25.0统计软件进行分析。计量资料用均数±标准差表示,采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同组别精子膜及线粒体ROS检测结果比较男性不育组与正常生育组比较,精子膜高ROS精子比例差异有统计学意义(P<0.01),而精子线粒体高ROS精子比例差异无统计学意义(P>0.05);在精子ROS异常率方面,男性不育组显著高于正常生育组,差异有统计学意义(P<0.05)。见表1。
表1 不同组别精子膜及线粒体ROS检测结果比较Tab.1 The comparison of sperm membrane and mitochondrial ROS levels in different groups ±s
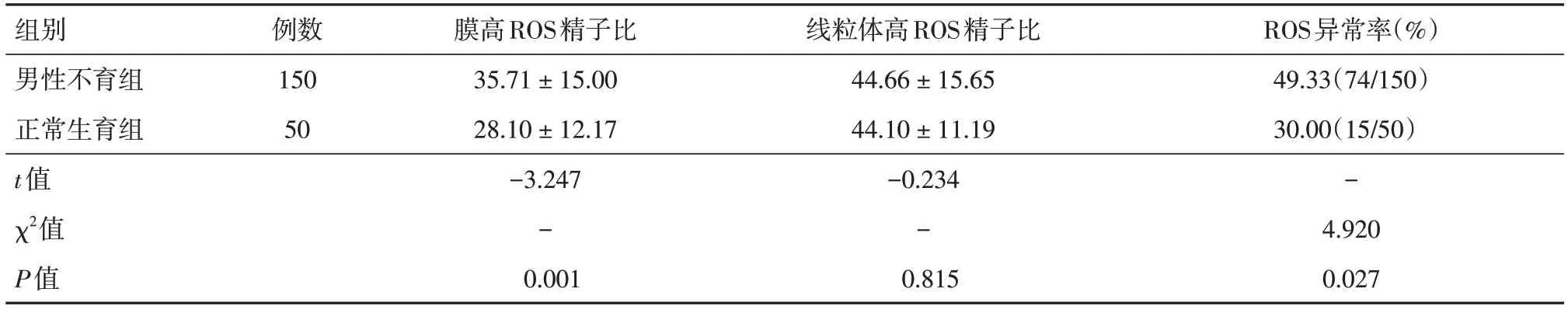
表1 不同组别精子膜及线粒体ROS检测结果比较Tab.1 The comparison of sperm membrane and mitochondrial ROS levels in different groups ±s
组别男性不育组正常生育组t值χ2值P值例数150 50膜高ROS精子比35.71 ± 15.00 28.10 ± 12.17-3.247-0.001线粒体高ROS精子比44.66 ± 15.65 44.10 ± 11.19-0.234-0.815 ROS异常率(%)49.33(74/150)30.00(15/50)-4.920 0.027
2.2 不同组别精子膜功能及核完整性检测结果比较ROS正常组与ROS异常组比较,精子膜功能正常率差异有统计学意义(P<0.01),而精子核DNA完整性差异无统计学意义(P>0.05)。见表2。
表2 不同组别精子膜功能及核完整性检测结果比较Tab.2 The comparison of sperm membrane function and nuclear integrity in different groups ±s,%

表2 不同组别精子膜功能及核完整性检测结果比较Tab.2 The comparison of sperm membrane function and nuclear integrity in different groups ±s,%
组别ROS正常组ROS异常组t值P值例数111 89精子膜功能正常率46.74 ± 6.63 41.65 ± 9.75-4.381<0.001精子DNA碎片指数14.66 ± 9.12 16.37 ± 9.59 1.288 0.199
2.3 不同组别临床资料比较IVF对照组与IVF观察组比较,年龄,不孕年限,获卵数,移植胚胎种类、数量、评分及子宫内膜等基本情况差异无统计学意义,具有可比性。IVF对照组、IVF观察组受精率、卵裂率、优胚率及临床妊娠率分别为:75.44%vs.66.21%,95.27%vs.97.51%,49.07%vs.44.26%,61.90%vs.58.62%,两组结果比较,受精率差异有统计学意义(P<0.05),而卵裂率、优胚率及临床妊娠率差异无统计学意义(P>0.05)。见表3、4。
表3 不同组别临床资料比较Tab.3 The comparison of clinical data in different groups ±s
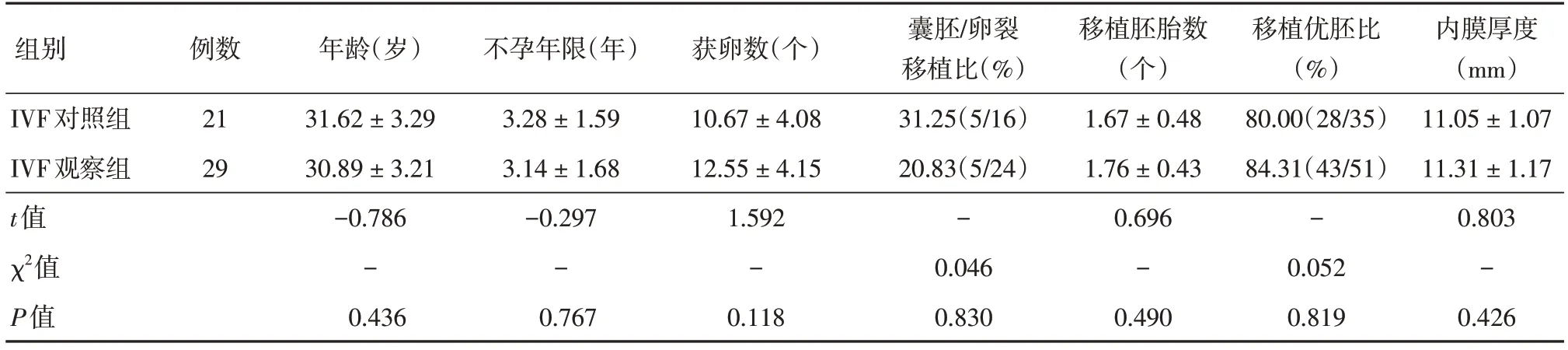
表3 不同组别临床资料比较Tab.3 The comparison of clinical data in different groups ±s
组别IVF对照组IVF观察组t值χ2值P值例数21 29年龄(岁)31.62 ± 3.29 30.89 ± 3.21-0.786-0.436不孕年限(年)3.28 ± 1.59 3.14 ± 1.68-0.297-0.767获卵数(个)10.67 ± 4.08 12.55 ± 4.15 1.592-0.118囊胚/卵裂移植比(%)31.25(5/16)20.83(5/24)-0.046 0.830移植胚胎数(个)1.67 ± 0.48 1.76 ± 0.43 0.696-0.490移植优胚比(%)80.00(28/35)84.31(43/51)-0.052 0.819内膜厚度(mm)11.05 ± 1.07 11.31 ± 1.17 0.803-0.426

表4 不同组别受精率、卵裂率、优胚率及临床妊娠率比较Tab.4 The comparison of fertilization rate,cleavage rate,superior embryo rate and clinical pregnancy rate in different groups
3 讨论
目前,我国不孕症的患病率为7%~10%[8],其中接近50%是由男性因素引起的[9]。在引起男性不育的众多因素中,ROS被认为是其中的主要原因之一[10]。在日常生活环境当中,许多常见因素如吸烟[11]、手机辐射[12]等均可促进精子ROS的产生,因此精子ROS与男性生殖关系密切。虽然已有许多关于ROS与精子功能的研究,但临床应用甚少,且检测样本往往采用精浆,受精液中白细胞及非精子细胞的影响较大,容易产生偏差,从而限制了其临床应用。而精子膜及线粒体ROS检测的是精子本身,受其他因素影响较少,特异性更强,结果也更准确。
在辅助生殖技术中,往往需要对精液进行优化处理以回收高活力精子,这部分用于受精的精子ROS水平也许更能反映其真实状况。有研究[13]提示,高ROS水平会导致精子DNA碎片率的增加,进而使男性生育力降低,同时增加女方复发性流产风险,影响IVF助孕结局[14-15]。另外,有研究[16]表明:当ROS含量过高时,可损害精子膜的流动性,提高膜的通透性,使精子质膜受体和下游信号通路紊乱,从而降低精子活力,影响精子形态。
为进一步明确精子ROS对男性生育力的影响及其在辅助生殖中的应用价值,以及精子ROS与精子核DNA完整性和精子膜功能的相关性。本项目利用DCFH-DA进行精子膜ROS的检测,利用MitoSOX Red进行精子线粒体ROS的检测。由于DCFH-DA本身没有荧光,可以自由通过细胞膜,进入细胞后可以被细胞内的脂酶水解生成DCFH,其不能透过细胞膜,从而使探针容易被标记到细胞内。在ROS存在的条件下,DCFH被氧化成荧光物质DCF,发绿色荧光,荧光强度与细胞内ROS呈正比。而MitoSOX Red是一种可以自由通过细胞膜的脂溶性阳离子染料,染料的脂溶性增加了其透过细胞膜及线粒体膜的透过率,带正电可以使其特异性的与超氧阴离子结合并固定在核酸之上。当MitoSOX Red被超氧阴离子氧化后会与线粒体DNA结合使线粒体发出红色荧光,荧光强度与超氧阴离子水平呈正比。因此该检测方案具有较好的准确性及科学性。本研究显示:(1)男性不育组精子膜ROS水平明显高于正常生育组,精子ROS异常率也显著增高,说明精子ROS水平与男性生育力具有一定联系,这与既往研究结果也是相符的[17-18]。(2)ROS正常组、ROS异常组精子膜功能正常率差异有统计学意义(P<0.01),本研究提示:精子膜及线粒体ROS水平与精子膜功能呈负相关,其机制可能为精子膜及线粒体ROS可通过氧化应激使精子轴丝受损,诱导精子形态缺陷,进而导致精子膜功能下降[19-20]。这与现有研究结果也是一致的[21]。(3)ROS正常组、ROS异常组精子核DNA完整性并差异无统计学意义(P>0.05)。说明精子膜及线粒体高ROS精子比例与精子核DNA完整性无直接关系,这与既往研究显示的高水平ROS会增加精子DNA断裂率并不一致,其原因可能是:本研究检测的指标是高ROS精子占所检测精子的比例,反映的并不是精子ROS的绝对浓度,所以结论存在一定偏差。这也提示精子膜及线粒体ROS检测可作为反映精子功能的一个独立指标。(4)IVF对照组与IVF观察组比较,受精率差异有统计学意义(P<0.05),说明精子膜及线粒体ROS水平与受精率具有一定关系,ROS水平过高可导致精子受精能力降低。而本研究并未发现ROS与卵裂率、优胚率及临床妊娠率间具有显著关联,推测其原因可能为:过量ROS可导致精子顶体膜过氧化和顶体活性降低,使精卵融合受损导致受精失败[22],而并不参与受精卵后续发育过程。另外,由于本次的研究对象有限,且导致不孕不育的机制复杂,因此结果可能存在一定偏差,需有待于更多的样本数据和更详细的分子机制去验证。
综上可见,精子ROS与男性生育力具有一定关系,ROS异常可导致精子膜功能受损,并可影响精子受精能力,从而影响男性生育功能。精子ROS检测可作为男性生育力评估的一个新手段并可为男性不育的诊疗提供依据。对于辅助生殖助孕患者,特别是卵子数量较少者,为尽力避免由于ROS过高导致受精率下降而影响后续胚胎的获得,可根据精子ROS情况选择合适的助孕时机。

