SIX4在子宫内膜癌中的表达与临床意义及其对Ishikawa细胞侵袭和迁移的影响
陆思楚 周 新 闫洪超
子宫内膜癌(endometrial carcinoma,EC)是妇科常见的三大恶性肿瘤之一,是欧美最常见的妇科恶性肿瘤,其发生率占女性生殖系统恶性肿瘤的20%~30%[1]。近年来,随着女性内分泌代谢疾病发生率升高、婚孕年龄推迟及寿命延长等原因,EC发生率逐年上升,且趋于年轻化,严重危害着女性身体健康。虽然通过影像学或其他方法可以早期诊断内膜癌,通过手术治疗或结合辅助放化疗使预后良好。但是部分患者容易发生转移,5年生存率往往较低[2]。因此,发现影响EC恶化进展的生物学标志物,研究EC的侵袭和迁移机制,寻找新的治疗靶点具有重要意义。
同源异型盒基因4 (sine oculis homeobox homolog 4, SIX4)是人类同源异型盒家族成员之一。最初研究显示,SIX4在哺乳动物的组织器官发育中起着重要的作用。近年来一些研究表明,SIX4也参与调控肿瘤的分化与进展,可能通过上皮间充质转化(epithelial mesenchymal transition, EMT)增强肿瘤的侵袭和迁移[3]。EMT是肿瘤细胞侵袭转移的重要前提,在此过程中上皮细胞极性丧失,间充质样特性形成,其特征包括E-cadherin表达减少及N-cadherin表达升高[4]。目前SIX4基因与EC的关系尚未见报道,其是否参与了EC致癌机制,是通过何种信号通路来调控肿瘤进展的有待于进一步研究。SIX4有望成为新的癌症治疗靶点,进而对该基因进行靶向药物的研制与开发,以为临床治疗提供进一步依据。
本研究将采用实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)法检测SIX4在子宫内膜腺癌组织中的表达水平,并探讨其与子宫内膜腺癌患者临床病理特征的关系。运用RNA技术靶向抑制内膜癌Ishikawa细胞中SIX4蛋白的表达,并观察抑制SIX4表达后对E-cadherin、N-cadherin的表达及内膜癌Ishikawa细胞侵袭和迁移能力的影响,以期为子宫内膜癌的临床诊断和治疗提供新的思路和方法。
材料与方法
1.临床标本:选取2021年1月~2022年3月于徐州医科大学附属医院行手术治疗的子宫内膜腺癌患者60例。患者年龄34~77岁,平均年龄为55.48±4.62岁;FIGO分期:Ⅰ~Ⅱ期34例,Ⅲ~Ⅳ期26例;浸润肌层程度<1/2 38例, ≥1/2 22例。淋巴结转移阴性36例,淋巴结转移阳性24例;纳入标准:①所有临床标本术后病理证实为子宫内膜腺癌;②术前未接受放化疗及生物靶向治疗;③不合并其他类型肿瘤病史及影响预后的慢性疾病史;④临床资料完整。同期收集因子宫良性病变行刮宫术或全子宫切除术,且术后病理证实为正常内膜的组织标本30例作为对照组,年龄38~64岁,平均年龄为50.42±5.91岁。本研究已征得患者的知情同意及徐州医科大学附属医院医学伦理学委员会批准(伦理学审批号:XYFY2022-KL150-01)。
2.实验材料:Ishikawa细胞株复苏于徐州医科大学中心实验室,RPMI-1640培养基购自南京凯基生物科技发展有限公司;胎牛血清购自杭州四季青生物工程材料有限公司;兔抗人SIX4多克隆抗体及内参兔抗人GAPDH多克隆抗体均购自美国Proteintech公司;E-cadherin、N-cadherin抗体均购自美国ABMART公司。反转录试剂盒和RT-qPCR试剂盒均购自上海吉玛公司;SIX4引物序列、内参引物序列、SIX4siRNA及对照siRNA均由上海吉玛公司设计合成;Transwell小室购自美国Millipore公司;胰蛋白酶、脂质体(Lipofectamine 8000)购自上海碧云天生物技术有限公司。
3.RT-qPCR法检测SIX4的表达:Trizol法分别提取内膜癌组、对照组组织中的总RNA,RT-qPCR法分别检测其表达水平。产物与GAPDH内参进行校正,2-ΔΔCt法测定其相对表达量。
4.细胞培养及细胞转染:(1)细胞培养:在37℃,5%的CO2的恒温培养箱中,使用含10%胎牛血清、1%青链霉素溶液的1640培养基培养子宫内膜腺癌Ishikawa细胞,孵育至细胞融合95%左右进行传代,传3~4代细胞处于对数生长期时进行后续实验。(2)细胞转染:将生长状态良好的细胞接种于6孔板继续培养,待细胞融合至70%左右进行转染。利用Lipofectamine 8000将3条siRNA及阴性对照siRNA-NC分别转染子宫内膜癌Ishikawa细胞,48h后收集细胞检测。siRNA-1上游引物:5′-GGCGAGGA-GACGGUGUAUUTT-3′,siRNA-1下游引物:5′-AAUACACCGUCUCCUGGCCTT-3′;siRNA-2上游引物:5′-CCAGUUCAUCUGAUGGCAUTT-3′,siRNA-2下游引物:5′-AUGCCAUCAGAUGAACUGGTT-3′;siRNA-3上游引物:5′-GCUUCGAGUCGGCCAACCATT-3′,siRNA-3下游引物:5′-UGGUUGGCCGACUCGAAGCTT-3′;siRNA-NC上游引物:5′-UUCUCCGAACGUGUCACGUTT-3′,siRNA-NC下游引物:5′-ACGUGACACGUUCGGAGAATT-3′。
5.RT-qPCR法检测各组细胞SIX4mRNA表达水平:于转染48h后收集各组细胞,Trizol法提取RNA。用RT-qPCR法检测SIX4mRNA表达水平。产物与内参GAPDH进行比较,2-ΔΔCt法测定相对表达量。
6.Western blot法:转染48h后裂解细胞并收集蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法检测蛋白浓度后进行Western blot法检测,成像后使用ImageJ软件进行分析。
7.Transwell实验检测细胞侵袭能力:上室预先用Matrige基质胶(1∶8稀释)包被,制备细胞悬液后以4×104个/孔密度接种于上室,下室中加入600μl含10%胎牛血清的培养基,继续培养24h取出。用4%多聚甲醛固定1h,结晶紫染色15min,用棉签擦去未迁移细胞后磷酸盐缓冲液(phosphate buffered solution, PBS)冲洗3次。随机选取5个视野计算细胞数,取其平均值进行数据统计分析。
8.细胞划痕实验检测细胞迁移能力:转染后待各组细胞密度接近100%,用200μl无菌枪头进行划痕,PBS冲洗脱落细胞后加入1640培养基继续培养,分别在0h和24h在显微镜下观察,选取不同视野标记拍照,使用ImageJ软件计算细胞划痕面积并进行分析。迁移率(%)=(0h划痕面积-24h划痕面积/0h划痕面积)×100%。
结 果
1.SIX4mRNA在内膜癌组和对照组中的表达:SIX4mRNA在内膜癌组和对照组中的相对表达量分别为1.000、0.288±0.076,内膜癌组中,其表达水平较对照组明显升高(P<0.05),详见图1。其中60例子宫内膜腺癌中,SIX4mRNA的表达水平与子宫内膜癌患者的年龄、组织类型和分化程度均无关(P>0.05),与肌层浸润、有无淋巴结转移和FIGO分期相关(P<0.05),详见表1。
表1 SIX4mRNA表达水平与子宫内膜癌临床病理特征之间的关系
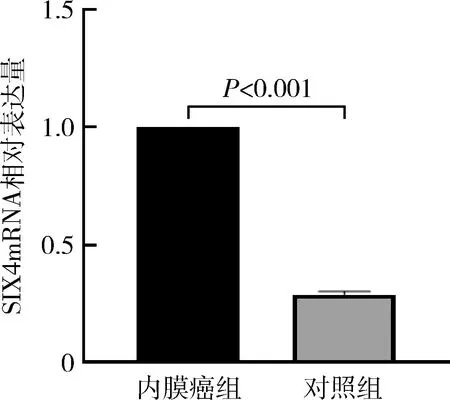
图1 SIX4mRNA在各子宫内膜组织中的相对表达量
2.SIX4干扰效果:RT-qPCR检测结果显示,正常组、阴性对照组、抑制组1、抑制组2及抑制组3的SIX4mRNA相对表达量分别为1.000、0.892±0.062、0.281±0.025、0.106±0.016及0.517±0.062,其中抑制组2干扰效果最明显,差异有统计学意义(P<0.001),故选取干扰效果最好的抑制组2进行后续的实验,详见图2。
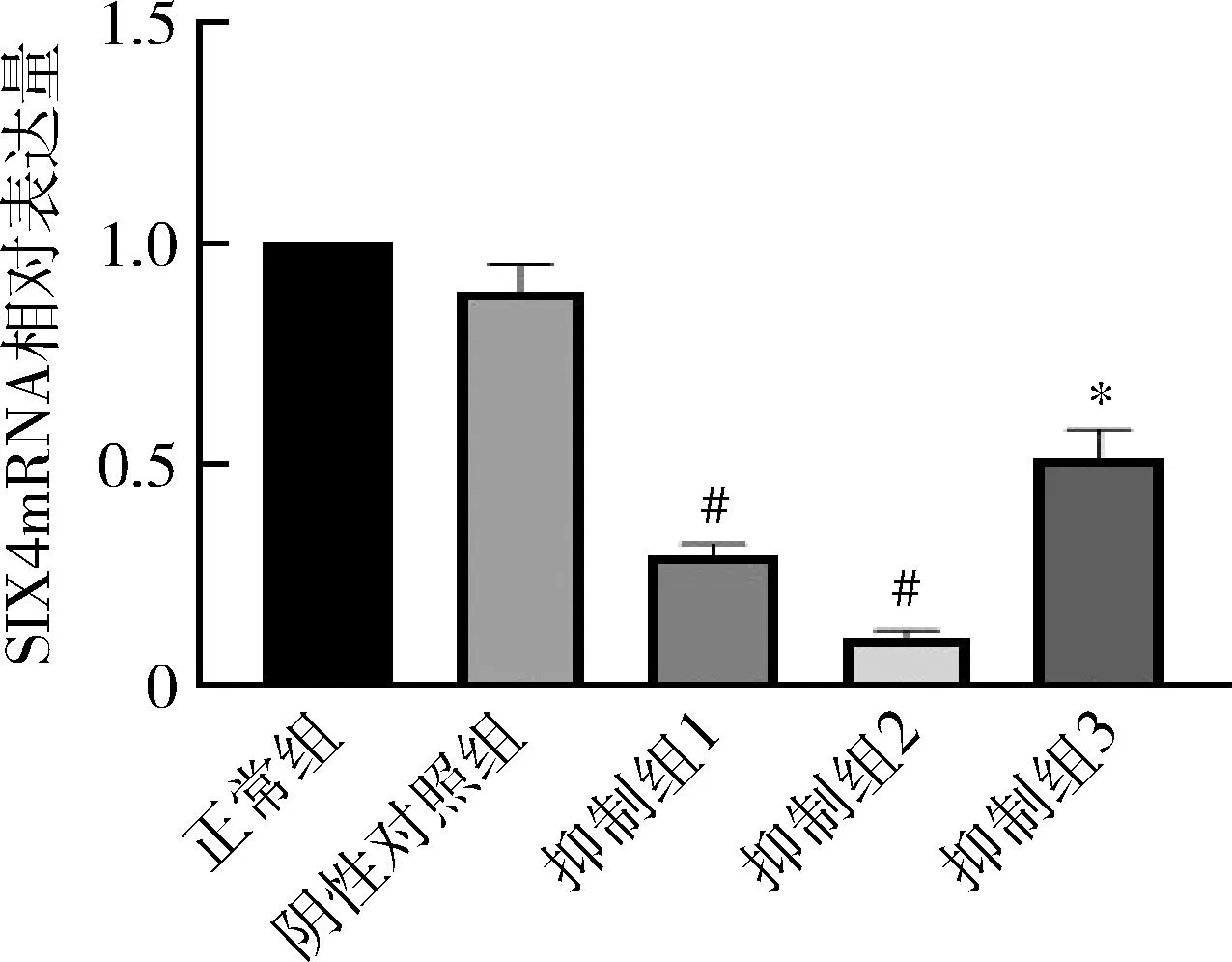
图2 RNA干扰对各组细胞SIX4mRNA表达的影响与正常组比较,*P<0.01,#P<0.001
3.SIX4、E-cadherin及N-cadherin蛋白表达水平:相较于正常组,阴性对照组SIX4、E-cadherin及N-cadherin蛋白表达水平未见明显差异;相较于正常组,抑制组2 E-cadherin蛋白表达水平升高,SIX4、N-cadherin蛋白表达水平降低(P<0.05),详见图3。

图3 RNA干扰对Ishikawa细胞SIX4、E-cadherin及N-cadherin蛋白表达影响A.3组细胞中SIX4、E-cadherin及N-cadherin蛋白表达结果;B.3组细胞中SIX4、E-cadherin及N-cadherin蛋白水平的表达量。*P<0.05,**P<0.01
4.3组Ishikawa细胞侵袭能力比较:正常组穿膜细胞数为203.3±15.5个,阴性对照组穿膜细胞数为187.7±15.2个,抑制组2穿膜细胞数为86.0±7.5个。数据分析显示,阴性对照组穿膜细胞数与正常组比较,差异无统计学意义,抑制组2明显低于正常组,差异有统计学意义(P<0.05),详见图4。
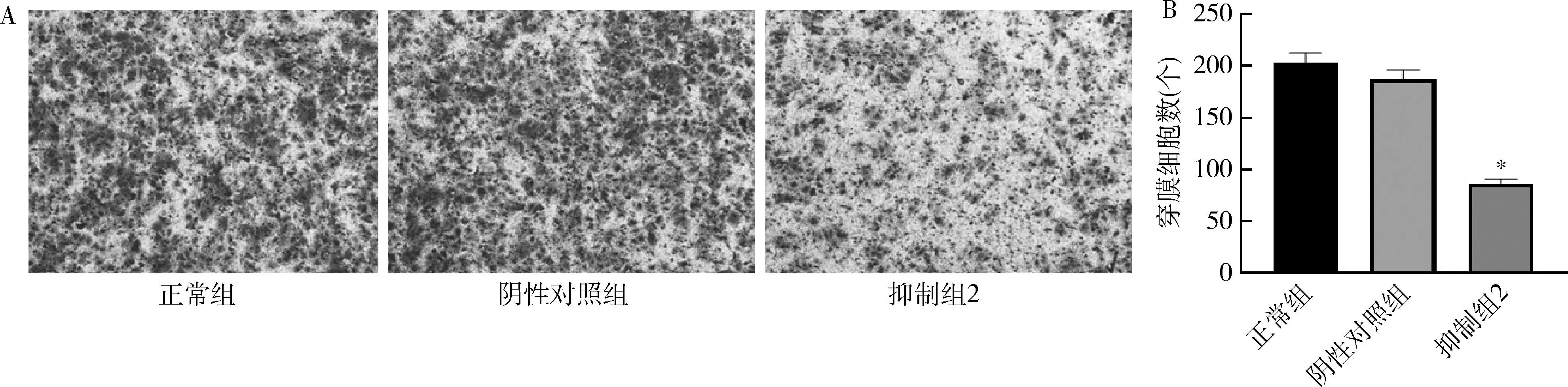
图4 Transwell实验检测细胞侵袭能力A.3组细胞Transwell实验结果(结晶紫染色,×400);B.3组细胞穿膜细胞的个数。与正常组比较,*P<0.05
5.3组Ishikawa细胞迁移能力比较:划痕实验结果显示,正常组迁移率为46.36%±3.36%,阴性对照组迁移率为39.06%±2.43%,抑制组2迁移率为18.74%±5.45%。与阴性对照组比较,正常组迁移率未见明显差异,抑制组迁移率明显低于阴性对照组,差异有统计学意义(P<0.01),详见图5。
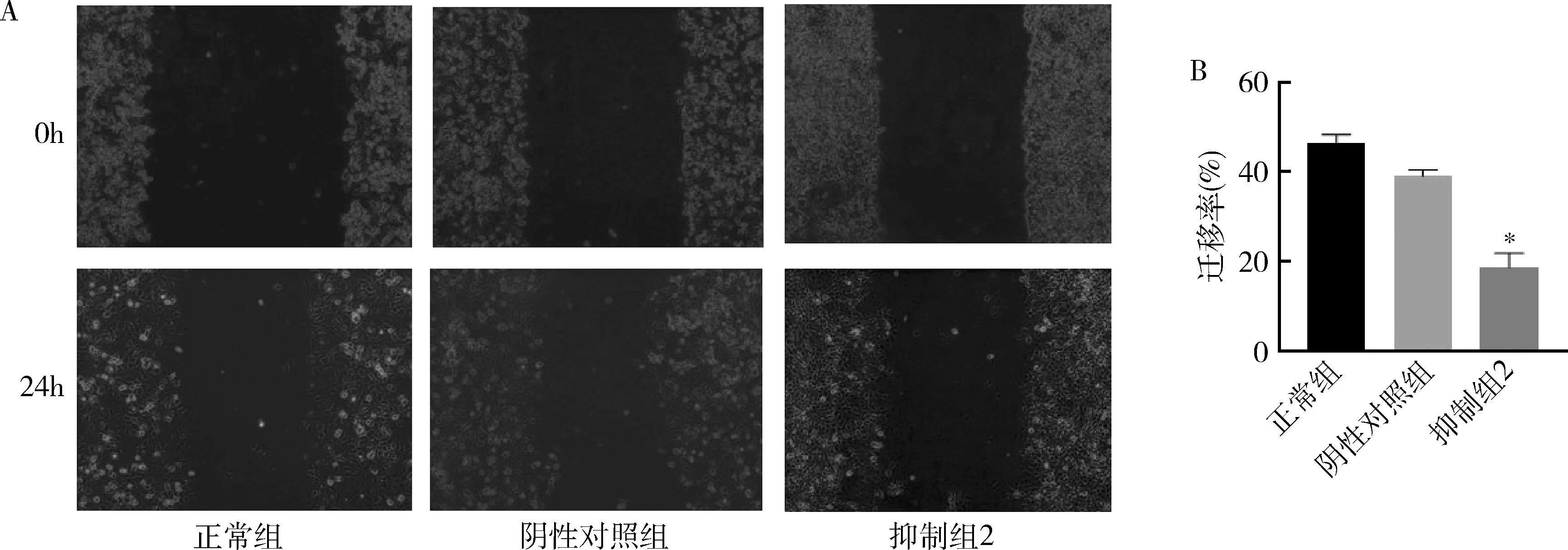
图5 划痕实验检测细胞迁移能力A.3组细胞划痕实验结果(×200);B.3组细胞的迁移率。与正常组比较,*P<0.01
讨 论
EC是欧美发达国家最常见的女性恶性肿瘤,终身发病风险为2.7%,其在中国发生率也呈逐年增加趋势,对女性健康造成极大危害[5]。目前EC发病机制尚未完全明确,根治性手术是治疗早期EC的最重要方法,而对于无法接受手术的中晚期EC患者,探索EC新的治疗靶点具有极其重要的意义。
人类SIX家族由6个成员组成:SIX1、SIX2、SIX3、SIX4、SIX5和SIX6。SIX家族蛋白作为肿瘤干细胞相关的表面标志物,不仅是器官发生的关键调节因子,而且在肿瘤发生、发展中起着关键作用[6]。SIX4定位于人类染色体14q23上,是一段高度保守DNA编码基因序列,通过将DNA序列与靶基因结合,既可以作为转录抑制因子,也可以作为转录激活因子,进而调节钠钾泵亚基的表达,也参与细胞生存、分化和迁移等过程[3, 7, 8]。作为SIX蛋白家族中的一员,SIX4与肿瘤的发生、发展进程必然密不可分。在妇科肿瘤中,有研究证实,SIX4的过表达可促进卵巢癌的增殖、侵袭及迁移[9]。在其他肿瘤中,Sun等[10]研究表明,SIX4基因在结直肠癌中的高表达,且导致预后不良,其作用机制为SIX4通过与缺氧诱导因子-1α协同上调血管内皮生长因子-α的表达,进而促进肿瘤生长。Tang等[11]实验证实SIX4在非小细胞肺癌中增强肿瘤增殖、侵袭与迁移能力。
有研究显示,肝癌中SIX4的高表达与TNM分期及生存期相关,可能参与了EMT进程[12]。Sun等[13]研究证实,SIX4在乳腺癌组织中的表达异常增高,机制为SIX4通过促进磷酸化的STAT3核易位,激活EMT通路,从而加速肿瘤的侵袭和转移。近年来有研究表明,在食管鳞状细胞中敲低SIX4的表达后,EMT相关的分子标志物发生逆转,提示敲低SIX4后部分逆转食管癌细胞的EMT过程[14]。此外,SIX4作为miR-203a的靶基因,参与了膀胱癌的恶性发展和EMT[15]。
因此,虽然SIX4已被证实在许多肿瘤中存在异常表达,但却少有研究探讨其与子宫内膜癌间的发生、发展关系。本研究将探索SIX4与子宫内膜癌之间的联系,首先通过RT-qPCR法检测SIX4在子宫内膜腺癌组织样本中的表达水平,结果显示,SIX4在内膜癌组织中的表达量显著高于正常内膜组织,且其表达水平与子宫内膜癌的FIGO分期、肌层浸润深度及淋巴结转移临床病理特征相关,表明了SIX4表达水平与子宫内膜癌的恶性程度及进展呈正相关。
为了进一步探究SIX4在子宫内膜癌恶性进展中的具体作用机制,将靶向抑制SIX4的siRNA转染至内膜腺癌Ishikawa细胞系,进而获得了低表达SIX4的Ishikawa细胞。用Western blot法检测到抑制SIX4表达后,E-cadherin表达升高,N-cadherin的表达降低,这表明SIX4通过参与EMT过程促进肿瘤进展,抑制其表达后可部分逆转。Transwell实验及细胞划痕实验结果显示,敲低Ishikawa细胞内SIX4的表达后,其侵袭及迁移能力受到明显抑制,这表明SIX4的高表达在子宫内膜腺癌恶性进展中具有重要的作用。然而本研究中的总体样本量和涉及的EMT相关标志物较少,所以实验未能探究更深层次的作用机制,其相关机制有待于进一步研究。
综上所述,SIX4在子宫内膜癌发生、发展中发挥一定的作用,其可能通过EMT过程促进肿瘤进展,抑制其表达可降低子宫内膜腺癌Ishikawa细胞侵袭和迁移能力,SIX4有潜力成为子宫内膜癌诊断的生物学标志物及防治新靶点。

