DCTN2和CREPT在胃癌组织中的表达及其对胃癌患者预后的影响
肖 娜 夏素芹 李 莉
胃癌是全球第五大常见的恶性肿瘤,其发生率及病死率占我国恶性肿瘤的第2位[1]。早期胃癌患者经内镜及外科治疗后,其5年生存率可达91%[2]。由于其早期症状不典型,绝大多数患者确诊时已处于中晚期,失去了手术治疗的机会,其5年生存率不超过25%[3]。因此,早发现、早诊断、早治疗是胃癌诊疗中的关键。
动力蛋白激活蛋白(dynactin, DCTN)是一种多亚基复合物,通过激活动力蛋白,参与细胞的有丝分裂、细胞骨架重新组装及调控物质向微管负端运输,在各种细胞功能中发挥着许多重要作用[4]。DCTN2目前被认为是DCTN的主要调节者和微管交通的组织者,与恶性黑色素瘤、结肠腺癌等多种疾病的发生有关,因为其庞大而复杂的结构,其作用的机制尚未得到充分研究[5,6]。
肿瘤高表达细胞周期相关蛋白(cell-cycle-related and expression-elevated protein in tumor,CREPT)能够和转录中的关键酶--RNA聚合酶Ⅱ(RNAPⅡ)在癌基因细胞周期蛋白D1(Cyclin D1)上结合,使Cyclin D1基因形成环状结构,从而促进基因的转录,加速细胞周期的进程、增强肿瘤细胞的增殖和迁移能力,促进肿瘤的发生与发展,为肿瘤的基因诊断和基因靶向治疗提供了新思路[7]。目前已发现CREPT与非小细胞肺癌、肾癌、宫颈癌等肿瘤的发生、进展密切相关,而CREPT在胃癌中的表达水平及其与胃癌患者预后的关系尚不明确[8~10]。本研究通过免疫组化法检测DCTN2和CREPT在胃癌及癌旁组织中的表达水平,分析其与胃癌患者的临床病理特征及预后的关系,初步探讨DCTN2和CREPT在胃癌诊断及预后预测中的价值。
对象与方法
1.研究对象:纳入2014年3月~2015年9月在徐州医科大学附属医院初治并接受胃癌切除术的90例胃癌患者,其中男性51例,女性39例,患者中位年龄为61岁,回顾性收集90例胃癌患者的术后肿瘤组织、癌旁组织(取材距肿瘤边缘≥5.0cm,且病理证实无肿瘤细胞浸润)和临床资料,所有患者均经组织病理学证实为胃癌,其中70例胃癌患者术后接受化疗,20例患者术后未化疗。纳入标准:①组织病理学确诊为胃癌;②初治患者,术前未接受放疗、化疗、靶向治疗等抗肿瘤治疗;③具有完整的肿瘤标志物及影像学评估资料;④随访资料完整。排除标准:①无明确病理诊断信息;②合并有高血压、糖尿病、冠心病等基础病或其他肿瘤;③随访信息不完整或失访者。随访90例胃癌患者的1、3、5年生存率,随访截止时间为2022年9月,纳入的90例患者均完成随访。在长期随访中,死亡患者均因胃癌复发转移所致。本研究获得徐州医科大学附属医院医学伦理学委员会审核批准。
2.免疫组化法检测及结果判读:采用链霉菌抗生物素蛋白-过氧化物酶(SP)连结法进行免疫组化染色,即:组织切片经烤片、二甲苯脱蜡、梯度乙醇水化、内源性过氧化物酶灭活、抗原修复、通透、封闭后,滴加DCTN2单克隆抗体(1∶200,Proteintech,武汉三鹰生物技术有限公司)和CREPT单克隆抗体(1∶200,美国Thermo Fisher公司),将组织切片置于4℃孵育过夜。次日取出组织切片置于37℃复温45min,滴加生物素标记的二抗(1∶200,徐州微科曼得生物工程有限公司),37℃条件下孵育1h,滴加SP后37℃条件下孵育30min。上述反应中,除血清封闭外,其余各步后均需用磷酸盐缓冲液(phosphate buffered solution, PBS)漂洗。随后滴加DAB液显色10min,自来水冲洗10min后终止反应,使用苏木精(上海碧云天生物技术有限公司)复染2min,盐酸乙醇分化,充分水洗返蓝后,梯度乙醇脱水,二甲苯溶液透明,干燥后使用中性树胶封片,光学显微镜下观察拍照并保存。
病理参数采用阳性肿瘤细胞百分比评分和染色深度评分的乘积进行评估。阳性肿瘤细胞百分比评分是选取镜下5个视野(×400倍镜)的阳性细胞平均数计分:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。染色深度评分是多数细胞呈现的染色深浅与背景着色情况对比计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。2个参数相乘得出免疫反应性评分(immunereactivity score, IRS),范围为0~12分,评分<6分记为低表达,≥6分记为高表达。
3.统计学方法:应用SPSS 26.0统计学软件对数据进行统计分析,采用Graphpad prism 8进行做图。计数资料以例数(百分比)[n(%)]表示,组间比较采用χ2检验;采用Spearman法分析DCTN2与CREPT表达的相关性;采用Kaplan-Meier法分析DCTN2和CREPT的表达水平与胃癌患者预后的关系并绘制生存曲线图,组间差异比较采用Log-rank检验;采用COX比例风险模型进行单因素和多因素分析,以P<0.05为差异有统计学意义。
结 果
1. DCTN2和CREPT在胃癌及癌旁组织中的表达水平:免疫组化结果显示,DCTN2蛋白表达定位于胃癌细胞的细胞质中,CREPT蛋白表达定位于细胞核内。对DCTN2和CREPT的表达水平进行统计分析后得知,胃癌组织中有68例(75.56%)出现DCTN2高表达,而癌旁组织中仅有20例(22.22%)出现DCTN2高表达,癌组织中DCTN2的高表达率明显高于癌旁组织,差异有统计学意义(P<0.001)。胃癌组织和癌旁组织中分别有66例(73.33%)和26例(28.89%)出现CREPT高表达,癌组织中CREPT高表达率亦明显高于癌旁组织,差异有统计学意义(P<0.001),详见图1和表1。
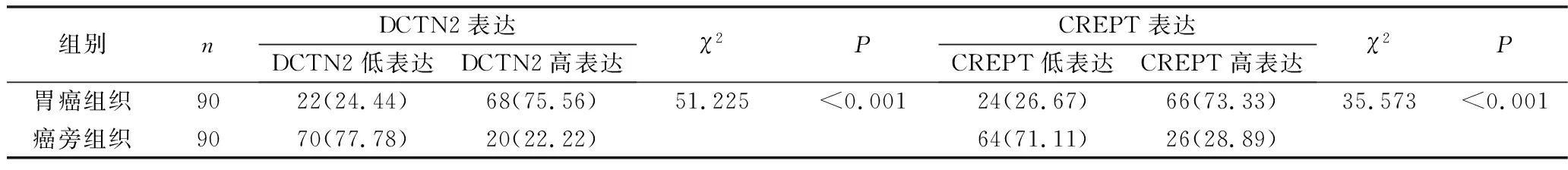
表1 DCTN2和CREPT在胃癌和癌旁组织中的表达情况[n(%)]
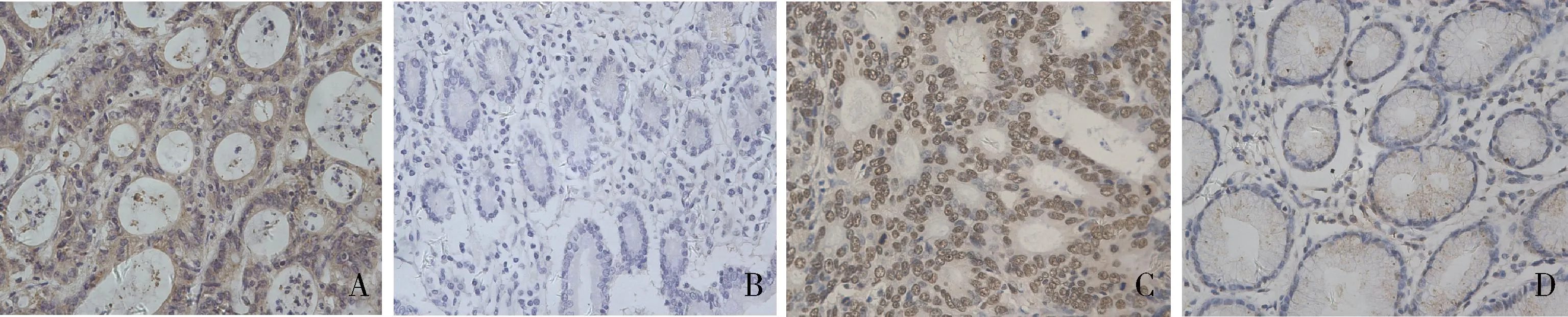
图1 免疫组化法检测DCTN2和CREPT在胃癌组织和癌旁组织中的表达(×400)A.胃癌组织中DCTN2的表达(高表达);B.癌旁组织中DCTN2的表达(低表达);C.胃癌组织中CREPT的表达(高表达);D.癌旁组织中CREPT的表达(低表达)
2.胃癌组织中DCTN2与CREPT的表达相关性:胃癌组织中共有60例(66.67%)出现DCTN2与CREPT共同高表达,12例(13.33%)出现DCTN2与CREPT共同低表达,两者在胃癌组织中的表达呈正相关(r=0.442,P<0.05)。
3.胃癌组织中DCTN2和CREPT表达与患者临床病理特征的关系:胃癌组织中DCTN2和CREPT的表达水平与患者的分化程度、TNM分期、浸润深度、淋巴结转移密切相关,即分化程度越低、TNM分期越高(Ⅲ~Ⅳ期)、浸润深度越深(T3~T4)、有淋巴结转移的胃癌患者更容易出现DCTN2和CREPT高表达,差异均有统计学意义(P<0.05)。此外,患者的性别、年龄、是否出现远处转移对DCTN2和CREPT的表达无显著影响,差异均无统计学意义(P>0.05),详见表2。
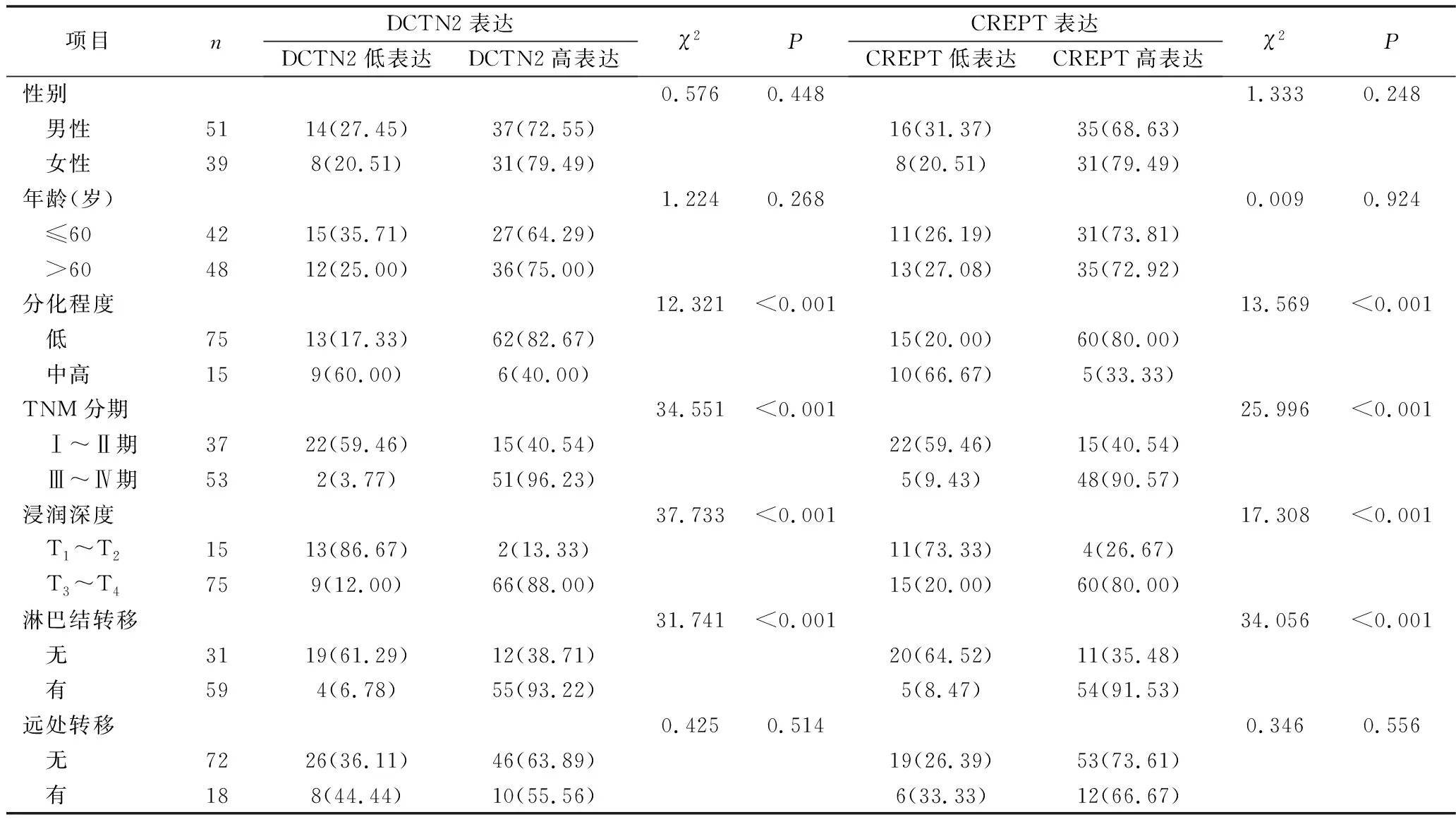
表2 胃癌组织中DCTN2和CREPT表达水平与患者临床病理特征的关系[n(%)]
4.胃癌组织中DCTN2和CREPT表达水平对患者预后的影响:DCTN2高表达组胃癌患者的术后1、3、5年累积生存率及总生存率分别为86.76%、69.12%、52.94%和20.59%,均明显低于DCTN2低表达组胃癌患者的术后1、3、5年累积生存率及总生存率(分别为100.00%、85.71%、68.18%和54.55%),差异均有统计学意义(P均<0.05)。CREPT高表达组胃癌患者的术后1、3、5年累积生存率及总生存率分别为69.70%、46.97%、22.73%和19.70%,均明显低于CREPT低表达组胃癌患者的术后1、3、5年累积生存率及总生存率(分别为100.00%、83.33%、70.73%和62.50%),差异均有统计学意义(P均<0.05),详见表3、图2和图3。
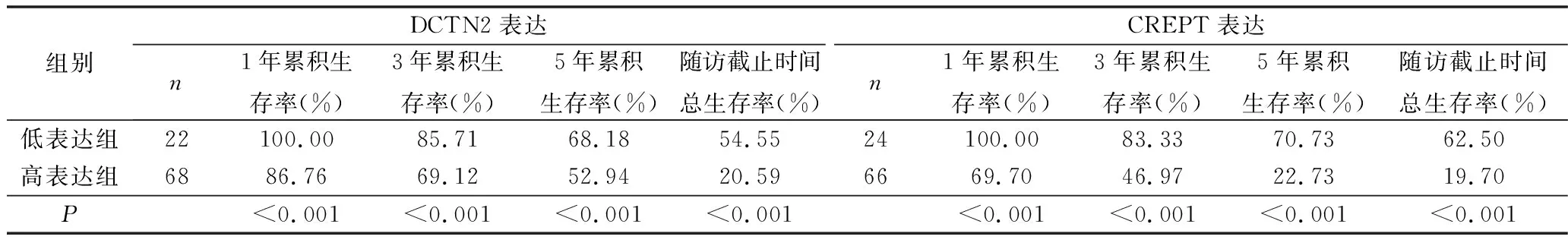
表3 胃癌组织中DCTN2和CREPT表达水平对患者生存率的影响[n(%)]
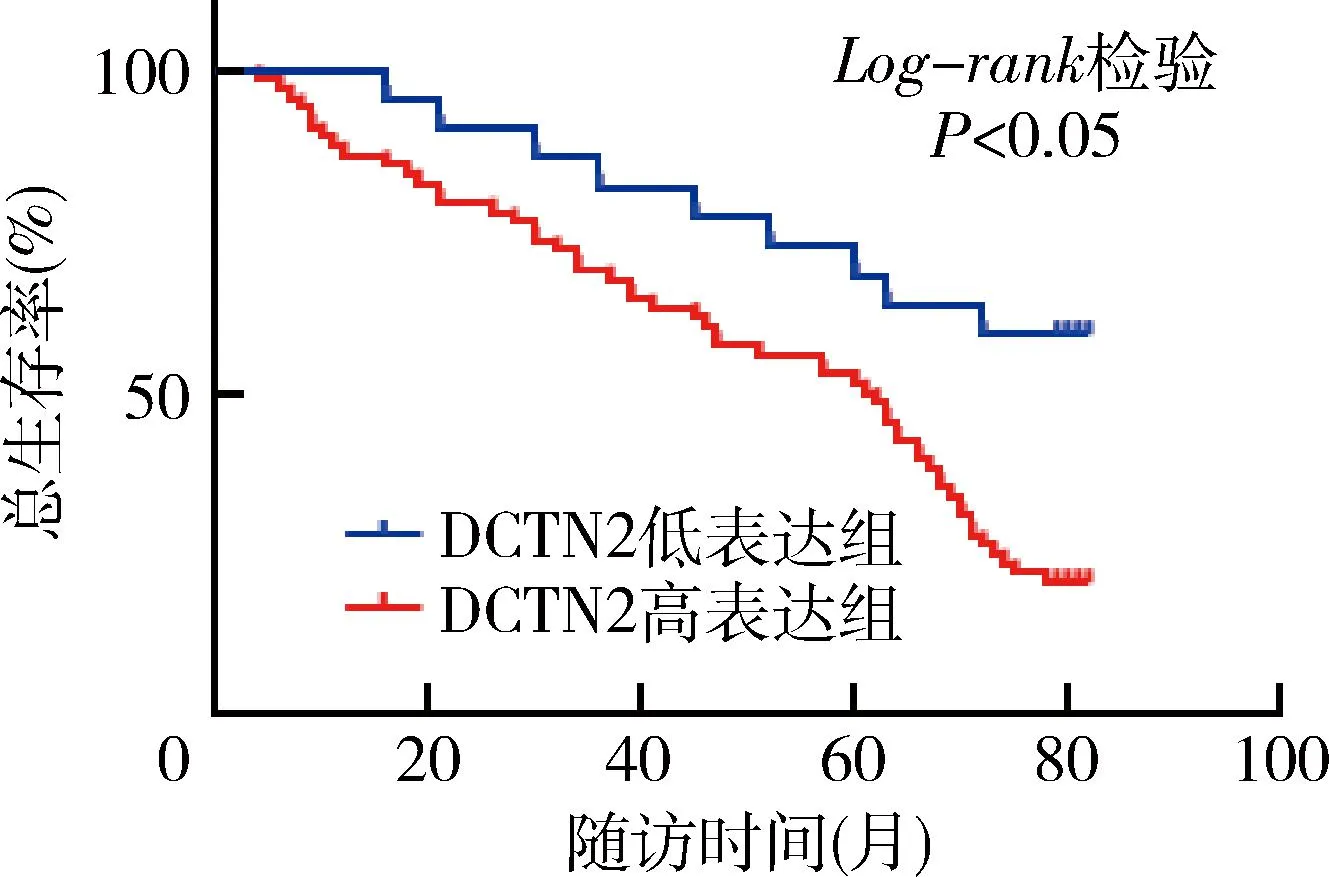
图2 胃癌组织中DCTN2表达水平对患者总生存期的影响
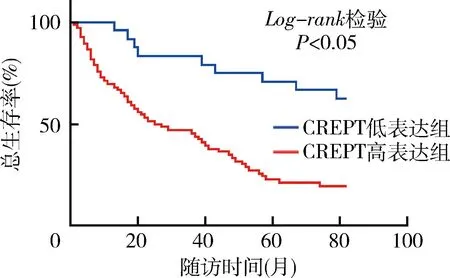
图3 胃癌组织中CREPT水平对患者总生存期的影响
5.影响胃癌患者预后的单因素和多因素COX回归分析:单因素COX回归分析结果显示,DCTN2表达水平、CREPT表达水平、年龄、TNM分期、淋巴结转移、远处转移是影响患者预后的重要因素(P<0.05),详见表4。将上述结果中差异有统计学意义(P<0.05)的预后因子进一步纳入多因素COX比例风险回归模型,结果显示,DCTN2表达水平、CREPT表达水平、TNM分期及有无远处转移是影响胃癌患者预后的独立危险因素,即DCTN2高表达、CREPT高表达、TNM高分期(Ⅲ~Ⅳ期)及有远处转移的胃癌患者的死亡风险分别是DCTN2低表达、CREPT低表达、TNM低分期(Ⅰ~Ⅱ期)及无远处转移的胃癌患者的4.790、4.516、4.647、10.517倍,详见表5。
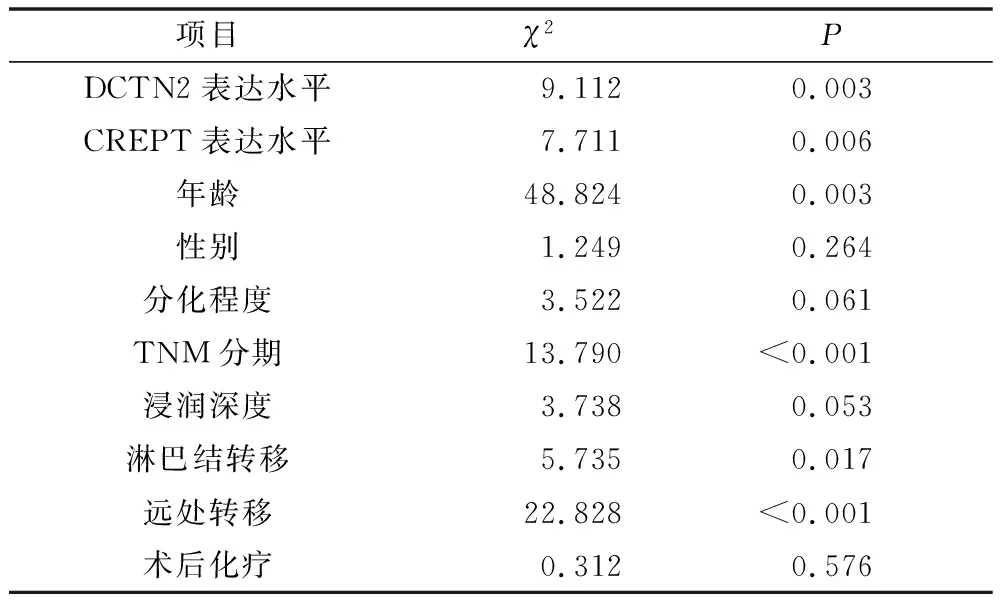
表4 影响胃癌患者预后的单因素COX回归分析
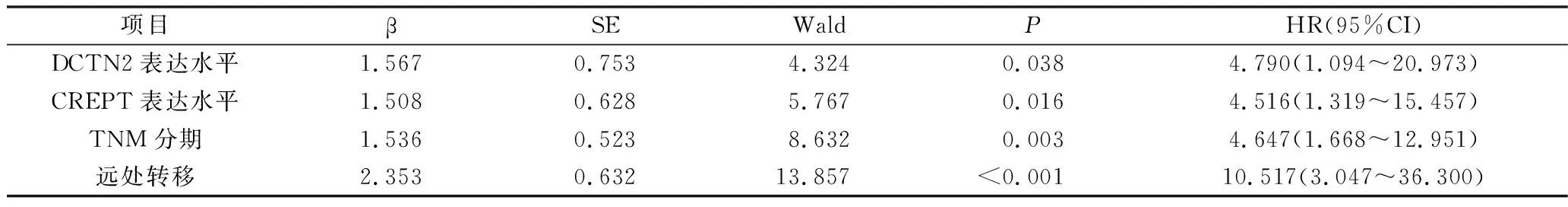
表5 影响胃癌患者预后的多因素COX回归分析
讨 论
胃癌是一种分子和表型高度异质的疾病,在全球恶性肿瘤中居第5位,是第三大常见癌症死亡原因,幽门螺杆菌感染、年龄、高盐及低水果和蔬菜饮食是其主要的危险因素[11]。尽管手术、化疗、靶向治疗、放疗、免疫治疗等治疗手段不断进步,其预后仍不理想。因此,早期诊断胃癌及寻找新的治疗靶点,是目前研究的重点。
细胞质动力蛋白是一种以腺苷三磷酸(adenosine triphosphate,ATP)为能量将化学能转化为机械能的蛋白质,为真核细胞中分子货物向微管负端运输提供动力[12]。DCTN可与动力蛋白尾部结合,激活其产生生物学活性[13],此过程需要尖端蛋白Arp11、p62、p25和p27等协助,再通过结合不同接头蛋白,如Bicaudal-D2(BICD2)、HookA组成沿着微管移动输送货物的运输机器[14,15]。DCTN蛋白是由DCTN家族基因(DCTN1~6)编码的多亚基蛋白质,具有参与激活动力蛋白、细胞有丝分裂、细胞骨架重新组装和细胞内物质运输等作用[4]。DCTN2基因位于染色体12q13~q15上,该区域在多种癌症中稳定扩增。DCTN2在人皮肤黑色素瘤、结肠癌、低级别胶质瘤等多种肿瘤中呈现高表达状态[5,6,16,17]。
近年来研究表明,DCTN2与动力蛋白依赖性自噬体聚集和自噬成熟有关[18]。除此以外,DCTN2通过调控肿瘤血管的异常生成,促进肿瘤的细胞增殖及侵袭。本研究发现,胃癌组织中DCTN2呈高表达状态,分化程度越低、TNM分期越高(Ⅲ~Ⅳ期)、浸润深度越深(T3~T4)、有淋巴结转移的胃癌患者更容易出现DCTN2高表达,且DCTN2高表达胃癌患者的术后1、3、5年累积生存率及总生存率均显著低于DCTN2低表达的胃癌患者,此外,DCTN2的表达水平是影响胃癌患者预后的独立因素,这些提示DCTN2可能与胃癌的发生与进展有关,DCTN2的高表达是胃癌患者预后不佳的影响因素之一。
CREPT是酵母Rtt103的人类同源物,定位于20号染色体,是含有C末端结构域、相互作用结构域的含核前mRNA结构域的调节蛋白,主要参与DNA损伤修复和终止RNA转录,细胞周期转变失控以及细胞周期相关基因和蛋白表达改变促进了肿瘤的发生[19,20]。2012年,我国研究者报道了人类肿瘤相关的一个新基因--CREPT,并提出CREPT通过增强RNA聚合酶Ⅱ(RNAPⅡ)向CyclinD1启动子区域募集,促进染色质环形成并阻RNAPⅡ读取基因3′末端终止位点,从而增加CyclinD1的转录,加速细胞周期G1/S期转变,从而促进肿瘤细胞增殖,加速肿瘤生长[7]。同时CREPT调控细胞周期蛋白B1促进细胞周期G2/M期转变[20]。此外,CREPT还可以诱导CDNK1、CDK6和C-MY等细胞周期相关基因的转录,最终加速细胞周期,促进细胞增殖。
近年来,研究表明,CREPT可通过与p300相互作用促进Wnt/β-连环蛋白途径,从而促进癌症生长,也可增强STAT3转录活性,促进肿瘤细胞增殖、集落形成,从而导致肿瘤的发生[21,22]。CREPT在非小细胞肺癌、结肠癌、肾癌、乳腺癌、子宫内膜癌等多种肿瘤中高表达,且与不良预后密切相关[8~10,23,24]。在本研究中,胃癌组织中CREPT表达水平显著高于癌旁组织,CREPT表达水平与胃癌的分化程度、TNM分期、浸润深度、淋巴结转移有关,进一步说明CREPT高表达促进肿瘤细胞的增殖及转移。此外,本研究的预后分析结果显示,CREPT高表达的胃癌患者术后5年生存率及总生存率显著低于CREPT低表达者,CREPT表达水平是影响胃癌患者预后的独立因素。
综上所述,DCTN2和CREPT有望成为胃癌诊断的新型标志物及治疗新靶点,并有助于判断胃癌患者的预后。但本研究样本量较小,未能深入研究DCTN2和CREPT在胃癌发病机制中的相互作用,需扩大样本量以及进一步对两者之间的相互作用关系及致癌机制进行深入研究。

