BDNF/TrKB介导的突触丢失对创伤性脑损伤小鼠远期认知障碍的影响及机制
孙衍昶 冯基高 欧阳一彬 刘达远 (海南医学院附属第二医院神经外科,海南 海口 570311)
创伤性脑损伤(TBI)是由外部物理力量引起的脑功能损伤或其他脑病理特征〔1〕。在中国,TBI 患者的死亡率为 13/10 万人,虽然近年来TBI发病率有所下降,但由于TBI病理复杂性,中枢神经系统常出现不可逆性损伤,仍会有约30%的颅脑损伤患者死于继发性二次损伤,致残致死率高〔2〕。
研究发现,TBI发生过程中会产生肿块损伤、挫伤、弥漫性轴索损伤及一系列可以造成神经元损伤的机制,如缺血、细胞凋亡、线粒体功能障碍、皮质扩散抑制和微血管血栓形成等,导致不同的临床病理特征〔3〕。尽管对 TBI 机制的大多数研究都集中在神经元损伤上,但有研究〔4〕表明,突触及其内在分子通路在多种脑部疾病中发挥重要作用,这增加了突触与 TBI 相关的可能性。且多项研究发现〔5~7〕,在TBI动物模型中可观察到突触丢失的现象,进一步提示了突触功能在TBI中的重要作用。脑源性神经营养因子(BDNF) 是哺乳动物神经系统中研究最广泛的神经营养因子,可促进感觉神经元的生长和分化及成人的突触调节〔8〕。BDNF与酪氨酸激酶受体(Trk)B作为调控中枢神经系统的重要通路,参与帕金森病、阿尔茨海默病、抑郁症、癫痫和慢性疼痛等〔9〕多种疾病的发生发展过程。并且,许多证据表明了BDNF在TBI中发挥重要作用,如王国强等〔10〕研究发现,腺病毒介导的 BDNF 基因过表达可保护TBI小鼠的海马神经元;康雅琴等〔11〕发现异氟醚处理后通过调节小鼠脑组织胰岛素样生长因子(IGF)-1、BDNF、神经生长因子(NGF)表达对新生小鼠缺血缺氧性脑损伤具有保护作用,可改善小鼠远期认知功能。但是目前还不清楚BDNF-TrkB参与TBI的具体机制,且是否和突触丢失存在联系亦不清楚。故本实验拟在TBI中探究BDNF-TrkB信号通路与突触功能的关系,并阐明其对脑损伤后远期认知功能的影响及其机制,为TBI临床治疗提供理论基础。
1 材料与方法
1.1主要材料 定量聚合酶链反应(qPCR)引物合成于金唯智公司;腺病毒过表达/敲低载体由上海吉玛基因公司制备;原位细胞凋亡检测试剂盒购自Roche公司;一抗p-磷脂酰激醇-3激酶(PI3K)、PI3K、蛋白激酶B(AKT)、p-AKT、B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)、cleaved-半胱天冬蛋白酶(caspased)3、BDNF、TrkB、p-TrKB(Tyr516)、突触蛋白(SYN)1、SYNA、突触素(Synaptophysin)、突触后致密蛋白(PSD)95、二抗抗兔IgG、辣根过氧化酶(HRP)-相关抗体、二抗抗鼠IgG、HRP相关抗体等均购自CST;荧光二抗山羊抗兔IgG H&L(Alexa Fluor® 488)、山羊抗鼠IgG H&L(Alexa Fluor® 594)购自Abcam公司。
1.2动物分组及模型制备 雄性C57BL/6小鼠240只,8~10周龄,体质量(28.0±2.0)g,由海南医学院实验动物中心提供,动物实验经医院伦理会批准。分为Sham组、TBI组、TBI_OE_NC组、TBI_OE_BDNF组、TBI_Sh_NC组、TBI_Sh_BDNF组,每组40只。采用控制性皮质撞击(CCI)法〔12〕构建TBI小鼠模型。以甲苯噻嗪(10 mg/kg) 和氯胺酮(75 mg/kg)腹腔注射麻醉,麻醉稳定后去除小鼠顶部毛发,俯卧位固定于立体定位仪,碘伏消毒头顶部位,作正中切口,分开头皮剥离骨膜,在右侧冠状缝和人字缝之间、中线旁2 mm处颅骨钻开直径为3 mm的骨窗,将小鼠头部固定于立体定位仪,应用CCI打击仪,设定参数为:打击速度1.5 m/s,深度1.5 mm,停留时间100 ms。打击后,还纳骨瓣,缝合小鼠头皮,无菌棉纱布包扎。手术完成后将动物置于加热垫上,待其恢复意识后,放回笼中。Sham组麻醉后只暴露骨窗,不做打击。腺病毒注入方式:TBI_OE_NC组和TBI_OE_BDNF组于CCI打击后立即在骨窗中心处导入10 μl微量注射器针头,深度3 mm,以1 μl/min的速度分别注入AAV_OE_NC和AAV_OE_BDNF病毒缓冲液3 μl,然后进行还纳骨瓣,缝合小鼠头皮,无菌棉纱布包扎。TBI_Sh_NC组、TBI_Sh_BDNF组麻醉后只暴露骨窗,不做打击,以同样的位置和方式分别注射AAV_Sh_NC和AAV_Sh_BDNF病毒缓冲液3 μl。
1.3qPCR检测目的基因mRNA表达 Trizol法提取细胞RNA,1%琼脂糖凝胶电泳检测RNA完整性,Nanodrop2000测定RNA的浓度与纯度,0.8 μg RNA逆转录成cDNA,qPCR体系(20 μl)为1 μl逆转录产物、10 μl SYBR Green Mix、上下游引物(10 μmol/L)各0.4 μl、8.2 μl ddH2O。预变性95 ℃、5 min,94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸 1 min,40个循环后终延伸完成PCR。内参选用β-actin,以2-△△Ct法计算目的基因表达量。实验独立重复3次。 引物序列(3′-5′):ACTB正向引物:CAGCACAGAGCCTCGCCTTT,反向:AGACAAGAG-ACCCCGCCGGTT;BDNF正向引物:ATGTGATGCCCTCGGATTATC,反向:GAGGAAGAGTAGCCAAGTGTG;TrkB正向引物:GCACTCACCTCTTCAGAACG,反向:CATCTTTGGAAGGTTCAGGTTG。
1.4Western印记法检测蛋白表达水平 收集目标小鼠脑部组织,使用冷冻研磨仪进行组织匀浆,14 000 r/min离心10 min收集上清即为总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度。每组样品取30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),湿转法将目的蛋白转至聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉室温封闭2 h,一抗4 ℃过夜孵育;次日,磷酸盐吐温缓冲液(PBST)洗涤3次,二抗室温孵育2 h;PBST洗涤后加入电化学发光(ECL)液进行显影。
1.5TUNEL法凋亡检测 严格参照原位细胞凋亡检测试剂盒操作说明书进行实验,简言之,对小鼠脑部组织切片进行透化,并在37 ℃下与 TUNEL反应混合物一起孵育60 min。磷酸盐缓冲液(PBS)洗涤3 min后,将样品在 0.1%4′,6-二脒基-2-苯基吲哚(DAPI)中孵育5 min,然后在 PBS 中洗涤。使用蔡司LSM700激光共聚焦显微镜观察并拍照。
1.6免疫荧光检测 将脑片放到12孔板,加3%双氧水封闭10 min,中杉金桥超敏二步法试剂后PBS 洗两遍,将脑片周围的水用吸水纸或卫生纸擦净,一抗Synaptophysin(1∶100)、BDNF(1∶200)稀释,加入稀释后的一抗,4 ℃过夜,次日PBS 洗净两遍后参照中杉金桥超敏二步法试剂盒说明书完成。使用蔡司LSM700激光共聚焦显微镜观察并拍照。
1.7Morris 水迷宫实验 各组分别于造模后28 d进行定位航行实验。将圆形池分为4个象限。跟踪摄像机放置游泳池上方,用于记录小鼠运动轨迹。随机选择象限将小鼠面向池壁放入水迷宫,计算机跟踪分析小鼠寻找目标平台(第一象限中水面下方2 cm处)的潜伏期,定90 s为最长时间,若90 s还没到达,人为将小鼠置于平台20 s,记录逃避潜伏期为90 s。每只动物训练5次/d,每次训练之间间隔10 min,连续训练5 d。于造模后32 d进行空间探索实验,最后一次训练结束后移去平台,将小鼠面向池壁放在第三象限,计算机记录小鼠90 s内的游泳速度及路径,计算目标象限穿越次数。
1.8统计学处理 采用SPSS20软件进行t检验、单因素方差分析,GraphPad8.0软件绘制相关图片。
2 结 果
2.1BDNF/TrkB在TBI中表达降低 透射电镜结果显示,与Sham组相比,TBI组神经元突触后致密物厚度(5、7 d)和突触体密度(3、5、7 d)显著降低(P<0.05)。见表1。qPCR及Western印迹结果显示,TBI组脑组织中BDNF和TrkB mRNA和蛋白水平随时间逐渐降低(P<0.05)。见表2、图1。
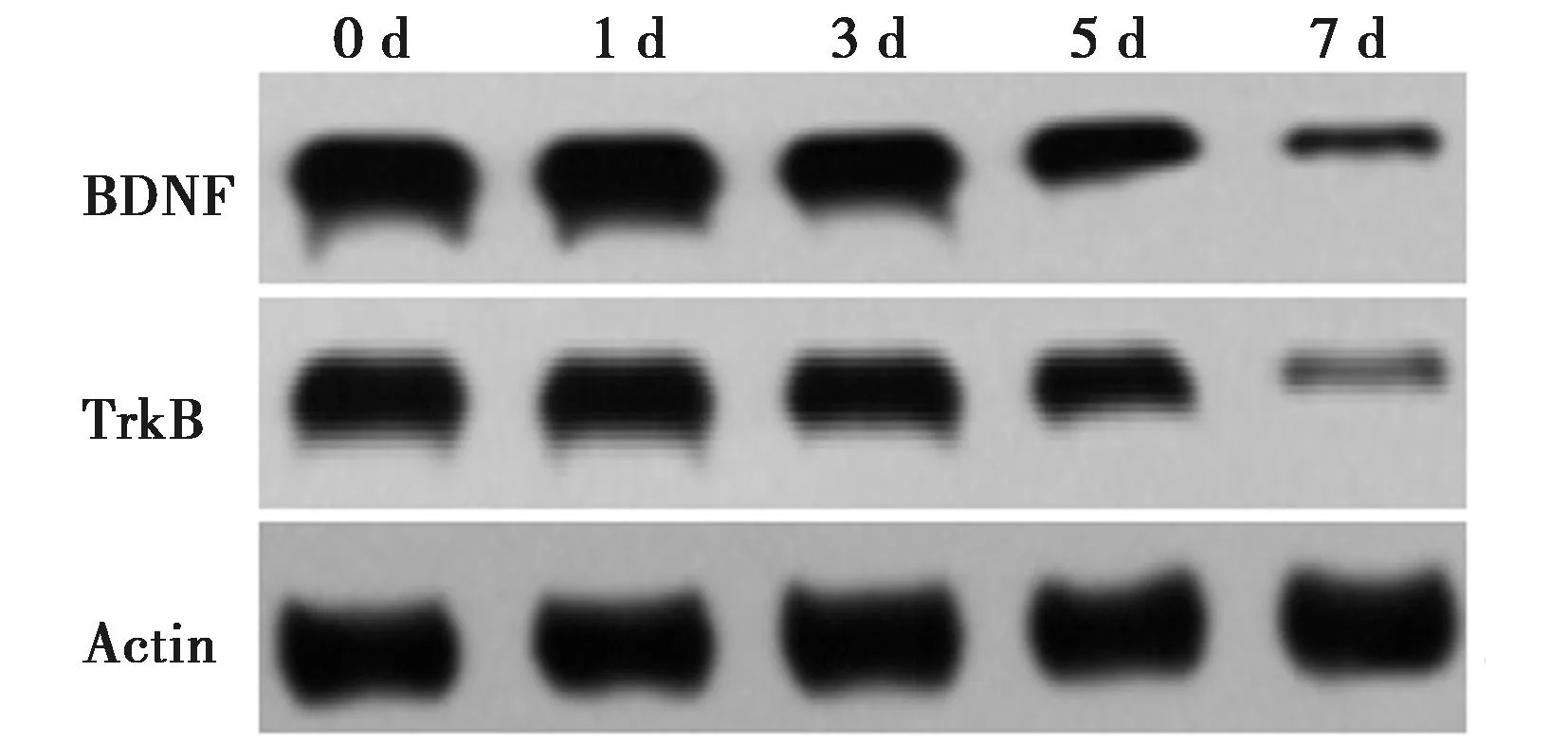
图1 Western印迹检测TBI组BDNF/TrkB蛋白表达

表1 两组神经元突触后致密物厚度及突触体密度

表2 TBI组脑组织中BDNF、TrkB相对mRNA表达
2.2过表达BDNF增加TBI小鼠模型海马体中突触数量 与Sham组比较,TBI_OE_NC组海马体BDNF表达显著减少;而TBI_OE_BDNF组BDNF蛋白表达水平显著高于TBI_OE_NC组(P<0.05)。TBI_OE_BDNF组突触数量显著多于TBI_OE_NC组(P<0.05),但与Sham组无统计学差异(P>0.05)。相较于TBI_OE_NC组,TBI_OE_BDNF组脑海马体组织中TrkB、p-TrkB、SYN1、SYNA、PSD95蛋白表达水平显著提高(P<0.05),与Sham组水平相当(P>0.05)。见表3、图2、图3。
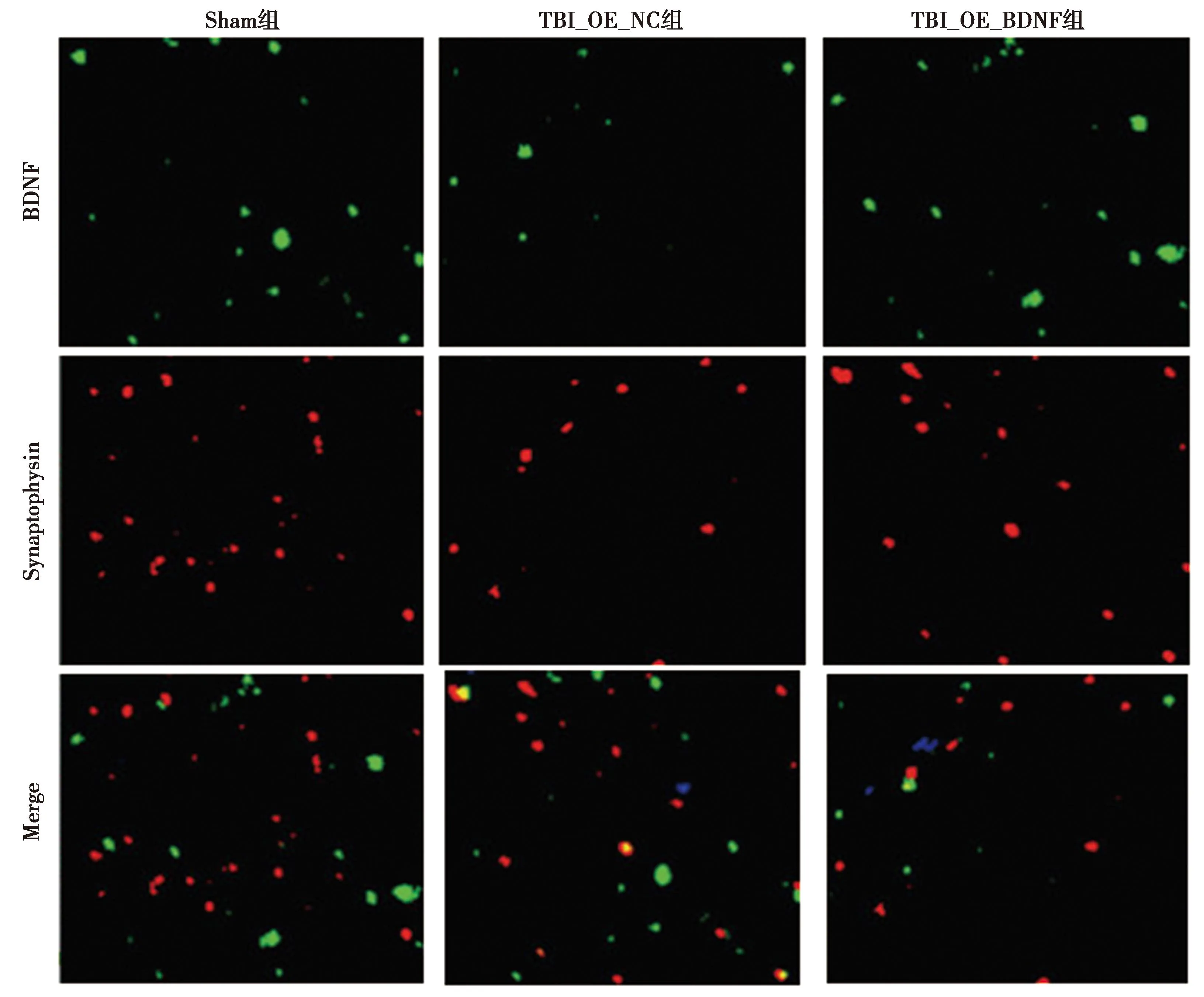
图2 免疫荧光检测各组海马体中突触数量(×200)

1~3:Sham组、TBI_OE_NC组、TBI_OE_BDNF组;图6同图3 Western印迹检测各组BDNF/TrkB及突触相关蛋白表达

表3 各组突触数量、TrkB、p-TrkB、SYN1、SYNA、PSD95蛋白表达比较
2.3过表达BDNF提高TBI小鼠模型远期认知能力 与Sham组比较,TBI_OE_NC组逃避潜伏期(3、4、5 d)显著升高,目标平台驻留时间、平台穿越次数及游泳速度显著降低(P<0.05)。与TBI_OE_NC组比较,TBI_OE_BDNF组逃避潜伏期(2、3、4、5 d)显著降低,目标平台驻留时间、平台穿越次数及游泳速度显著升高(P<0.05)。见表4。

表4 过表达BDNF对各组水迷宫实验的影响
2.4过表达BNDF抑制小鼠海马体组织细胞凋亡水平 相较于Sham组〔(2.31±0.13)%〕,TBI_OE_NC组细胞凋亡水平〔(32.3±3.78)%〕显著升高;而TBI_OE_BDNF组细胞凋亡水平〔(9.33±1.53)%〕显著低于TBI_OE_NC组。见图4。Western印迹结果显示,相较于TBI_OE_NC组,TBI_OE_BDNF组脑海马体组织中PI3K、AKT蛋白表达水平无明显差异(P>0.05),p-PI3K、p-AKT、Bcl-2蛋白表达显著升高(P<0.05),Bax、cleaved-caspased3蛋白水平显著降低(P<0.05)。见表5、图5。

图4 TUNEL法检测各组海马组织细胞凋亡(×400)
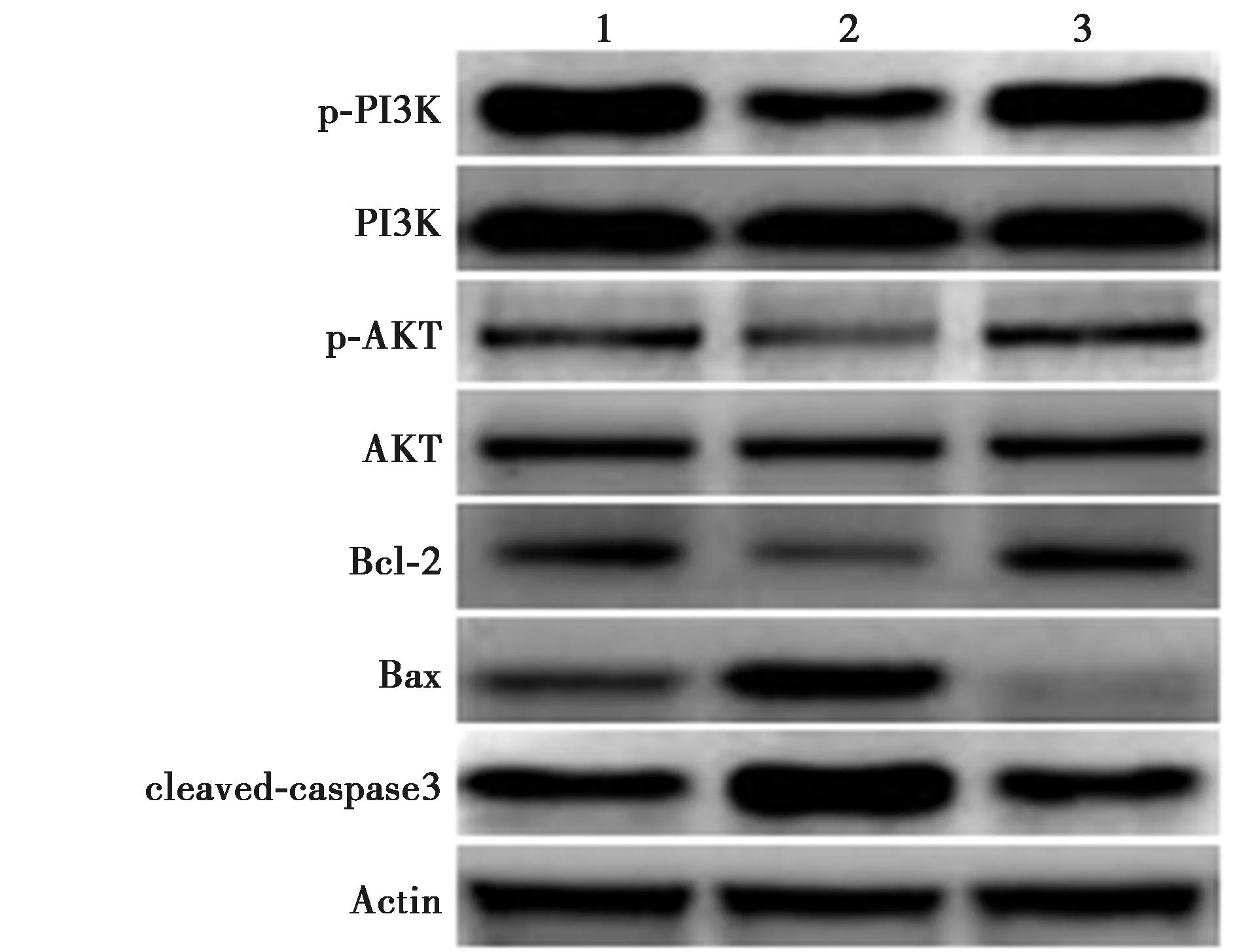
图5 Western印迹检测各组PI3K/AKT相关蛋白表达

表5 各组PI3K、p-PI3K、AKT、p-AKT、Bcl-2、Bax、Cleaved-caspase3蛋白表达比较
2.5敲低BDNF损伤小鼠的远期认知能力 相较于TBI_Sh_NC组(164.00±13.11),TBI_Sh_BDNF组海马体中突触数量(84.00±13.15)显著降低(t=7.47,P=0.002)。Morris 水迷宫结果显示,相较于TBI_Sh_NC组,TBI_Sh_BDNF组逃避潜伏期(3、4、5 d)显著增长(P<0.05),目标平台驻留时间、平台穿越次数及游泳速度显著降低(P<0.05)。见图6、表6。
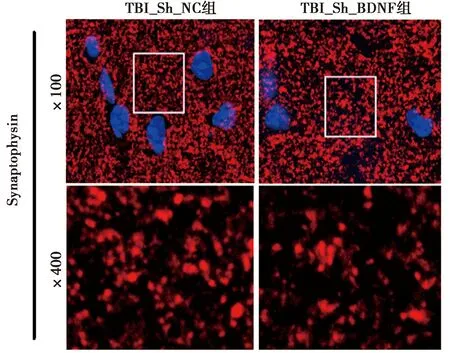
图6 共聚焦显微镜观察两组海马Synaptophysin

表6 敲低BDNF对两组水迷宫实验的影响
3 讨 论
TBI是晚年痴呆的危险因素,关于TBI的具体机制,之前的研究大多侧重于神经元损伤方面,随着突触及其内部分子通路研究的增多,越来越多的证据表明,突触在脑部疾病中发挥重要作用〔13〕。对发育、精神和神经系统疾病患者的突触蛋白质组和基因组测序的研究表明〔14~16〕,超过 130 种脑部疾病是由突触蛋白突变引起的。BDNF在中枢神经系统中广泛表达,可在发育过程中促进某些神经元群的存活和分化。在成年期,BDNF 可以调节神经元突触强度,并与学习和记忆的海马机制和疼痛的脊髓机制有关,是一种有效的神经保护剂,因此被认为是理想的脑部疾病药物靶点。BDNF 与高亲和力受体 TrkB 结合后,受体二聚化、自身磷酸化〔17〕,进而促进多种细胞内途径的激活:ras-丝裂原活化蛋白激酶〔18,19〕、磷脂酶 Cγ〔20~22〕、 磷脂酰肌醇 3' 激酶〔23,24〕、钙/钙调蛋白依赖性蛋白激酶〔25〕和环磷酸腺苷(cAMP)反应元件结合蛋白磷酸化,诱导部分蛋白质合成及突触可塑性,影响学习和记忆的形成。本研究发现,BDNF-TrkB信号通路与TBI后发生的突触丢失有着密切联系,进一步研究发现,BDNF-TrkB信号通路对突触内部蛋白调控作用及可突触重塑中的作用。
本研究Morris 水迷宫结果表明,BDNF对小鼠海马体突触密度及学习和记忆能力具有支持作用。突触丢失的主要原因是PSD中蛋白质失调引起的,而BDNF-TrkB通路可调控miRNA表达、局部蛋白质合成来调控突触的可塑性。BDNF-TrkB可激活PI3K/Akt 相关通路发挥抗细胞凋亡和促存活活性,并调节 N-甲基-d-天冬氨酸受体(NMDAR) 依赖性突触可塑性。本研究表明,BDNF过表达后可激活下游PI3K/AKT通路,促进抗凋亡相关蛋白表达,从而抑制细胞凋亡,保护突触功能。

