丹参微体快繁技术研究
郝树芹,张芙蓉,赵 凯,付 蕾,李 悦,张甜甜
(山东农业工程学院,山东 济南 250100)
丹参(Salvia miltiorrhiza)是唇形科鼠尾草属中的多年生草本植物,又称红根、大红袍,丹参偏好温暖气候,适宜栽种在土质肥沃的砂质土壤中[1]。丹参是《中国药典》收载的法定药物,为稀有名贵中药材[2]。
传统的丹参种植以无性根条繁殖技术为主,不仅繁殖系数低,而且种苗带毒量高,同时有繁殖速度慢、产出数量少、品质差的劣势[3]。长期以来丹参人工栽培生产只专注于栽培,不重视良种选育,使得品种质量退化,品种混杂严重,药材产量和质量下降。临床上应用的丹参大都来源于人工种植,人工种植过程中高产栽培措施的应用导致了丹参药用成分下降,病毒侵染以及不可控的异花授粉也加重了丹参药用成分含量的下降。丹参组织培养技术可以有效解决丹参快繁和种苗脱毒中面临的问题[4]。
根据植物细胞全能型,利用植物组织培养技术,以丹参根、茎、叶等器官为外植体,在一定条件下培养,诱导其分化为再生植株,可以快速有效获得大量的丹参植株[5]。近年来,人们将植物组织培养技术应用到丹参的外植体诱导和增殖培养中,为丹参优质品种推广和扩繁提供了种苗保障。申顺先等[6]以丹参春生幼嫩枝条为外植体,得出最适的消毒方案是用75%乙醇处理30 s,0.1%升汞处理 8 min,与房师梅等[7]得出0.1%的升汞灭菌10 min效果最佳的结果有吻合。韦献雅等[8]和张凯[9]发现,MS+6-BA 1.0 mg/L+NAA 0.1 mg/L可以作为诱导不定芽的最佳培养基配方。Shimomura K等[10]研究得出在培养基中添加吲哚-3-丁酸得出最高丹参酮产量,Miyagka H等[11]利用组织培养技术设计了一种用于生产隐丹参酮的改良培养基,都说明了丹参组织培养的重要性。总体来说,不同配比的激素对外植体离体分化起着关键的作用。想要将丹参快速繁殖应用于工业生产,最重要一步在于生产品质好、成本低的生产苗,这些关于丹参组培技术的研究,为丹参的快繁技术应用于生产奠定基础[12]。
本研究以丹参带节茎段为外植体,通过研究茎段消毒时间及不同浓度的植物生长激素的配比对丹参诱导过程、扩繁过程和生根过程的影响,选择出最适宜的培养基配方,为丹参的组织培养提供技术支持。
1 试验材料与方法
1.1 试验材料
试验材料为山东临沂丹参种苗,试验于2023年2月至2023年5月在济南普朗特农业技术有限公司进行。
1.2 试验方法
研究在不同消毒时间下,0.1%升汞对丹参外植体污染率的影响。选择丹参幼嫩茎段节为外植体,用毛刷刷掉茎段表面灰尘,修剪成4.0 cm带茎节的小段,分别用 1 min、5 min、10 min、15 min的0.1%升汞消毒(表1)。每个处理接种5瓶,每瓶接种3个外植体,每个处理3次重复,20 d后记录并统计丹参茎段的污染率和褐化率。

表1 丹参茎段消毒不同时间试验设计
1.3 初代培养
诱导丹参腋芽培养:以MS为基本培养基,分别在培养基中添加不同浓度的NAA(0.1、0.3、0.5 mg/L)和 6-BA(1.0、1.5、2.0 mg/L),筛选出适合丹参茎段诱导腋芽的培养基配方,具体配方见表2。将消毒后的丹参有节茎段修剪成1.5 cm-2 cm,接种于已标记序号的初代培养基进行诱导,每个处理接种5瓶,每瓶接种3个外植体,每个处理3次重复。40 d后观察并记录出芽状态,统计并计算诱导率。

表2 不同处理茎段诱导腋芽试验设计
1.4 继代培养
以MS为基本培养基,分别在培养基中添加不同浓度的 NAA(0.2、0.4、0.6 mg/L) 和 6-BA(1.0、1.5、2.0 mg/L),具体配方见表 3,筛选出适合丹参茎段继代的培养基配方。选用初代培养中幼嫩、质地颜色相近的带节茎段,修剪成1.5 cm-2 cm,接种于已标记序号的继代培养基上进行扩繁,每个处理接种5瓶,每瓶接种3个外植体,每个处理3次重复。放置于培养架上,40 d后记录丛生芽的生长状况和叶片状况,统计并分析增殖系数。

表3 不同处理的继代培养试验设计
1.5 生根培养
以1/2 MS为基本培养基,在培养基中分别添加不同浓度的 NAA(0.2、0.4、0.6、0.8 mg/L),具体配方见表4,筛选出适合诱导丹参生根的培养基配方。在继代培养获得的试管苗中,挑选茎干粗壮、叶色浓绿的高约3.0 cm的丹参幼苗,修剪黄叶,保留完整地上部,接种于已标记序号的生根培养基上进行生根。每个处理接种5瓶,每瓶接种2株幼苗,每个处理3次重复,35 d后观察丹参生长状况,记录最早生根时间,统计并分析生根率、平均根长、平均生根数。

表4 不同处理的生根培养试验设计
1.6 数据统计分析
使用Microsoft Excel 2022记录、整理试验数据,并用SPSS26.0统计软件进行统计分析,采用单因素方差分析,运用LSD分析法,对各个处理间差异进行显著性分析。
污染率 (%)=(污染的外植体数/接种的外植体总数)×100;
褐化率 (%)=(褐化外植体数/接种的外植体总数)×100;
诱导率 (%)=(成功茎段总数/接种的外植体总数)×100;
增值系数=增殖后的茎段数/接种茎段数;
生根率(%)=(生根总植株数/总接种数)×100;
平均生根数(%)=(总生根条数/总生根苗数)×100;
平均根长(cm)=总根长/总根数。
1.7 培养条件
光照强度为1500-2000 lx,光照时间为15 h/d,湿度为 80%,温度为(25±2) ℃,琼脂浓度 7 mg/L,pH 5.7。
2 结果与分析
2.1 外植体消毒处理
由表5可见,在不同消毒时间下,对外植体的污染率、褐化率及生长情况影响不同。总体来看,随着升汞消毒处理变长,丹参茎段的污染率先下降又上升,但褐化率上升后又下降。处理L3与处理L1和L2差异显著,L3(10 min)处理污染率最低,为00.000%,培养基内没有杂菌菌落,外植体保持绿色;L1(1 min)处理污染率最高,为33.333%,培养基内附着白色绒毛状菌落,少数外植体变褐死亡。处理L4的污染率(7.407%)显著低于处理L1,相比于处理L1,只有少数外植体上附着白色菌落。

表5 不同的消毒时间处理的影响
可见,消毒处理的时间不同消毒效果有差异。综合外植体污染率与褐化率,准确把握酒精和升汞处理时间,对外植体消毒过程至关重要。本试验发现,丹参茎段最佳消毒方案为75%乙醇消毒 30 s,0.1%HgCl2消毒 10 min。
2.2 初代培养基
根据表6、图1所示,在不同浓度配比下的NAA与6-BA,对丹参茎段腋芽诱导率有影响。培养3 d后,处理M2和处理M5处理最早出嫩黄色芽;6 d后有各处理均有出芽;30 d后各个处理中腋芽生长状况有差异。在9个处理中,处理M2中芽体长势好,芽体壮为绿色,叶大,腋芽诱导率最高为 94.44%,且与处理 M3、M4、M5、M7、M8差异显著。处理M6、M9腋芽诱导率分别为88.89%和83.33%,两者差异不显著,芽体长势较好。处理M8腋芽诱导率最低为39.90%,长势差,芽体弱为黄白色。

表6 不同浓度的激素配比对丹参茎段诱导的影响

图1 不同浓度激素的配比对诱导腋芽的影响
综合认为,在初代培养阶段,不同浓度的激素之间保持合理的配比才能有利于丹参腋芽诱导,激素配比不适宜会影响丹参茎段腋芽诱导率。试验结果表明,丹参茎段的初代培养基的最佳配方是MS+1.5 mg/L 6-BA+0.1 mg/L NAA,此时芽体长势好,芽体壮为绿色,叶大。
根据表7、图2所示,不同浓度NAA与6-BA,对丹参继代培养有影响,适宜浓度的6-BA、NAA有助于茎段的分化、增殖。在继代9个处理中,处理N4的继代苗生长状况表现为叶大,棕绿色,茎干粗,长势好,丛生芽数量多,增殖系数最高为12.83,与其他处理差异显著。其次,处理N1和处理N2增殖系数均大于11.20,增殖苗长势较好,茎干较粗。 处理 N3、N5、N6、N7、N9 间不存在显著差异,处理N3和N9增殖系数最低为8.56。

表7 不同浓度激素配比对丹参茎段继代培养的影响

图2 不同浓度激素配比对丹参继代培养的影响
总体来看,当6-BA浓度固定时,随着NAA浓度增加,增值系数先上升后下降;当NAA浓度固定时,随着6-BA浓度增加,增值系数下降。综合认为,在继代培养阶段,不同浓度的激素之间保持合理的配比才能有利于丹参增殖苗生长,激素配比不适宜都会导致继代增殖缓慢。试验结果表明,丹参茎段的继代培养基的最佳配方是MS+1.0 mg/L 6-BA+0.4 mg/L NAA,此时幼苗叶大,呈棕绿色,茎干粗,长势好,丛生芽多。
2.3 生根培养基
根据表8、图3所示,不同浓度的NAA对丹参健壮芽苗的生根有不同影响。最早生根时间为8天,此时NAA浓度为0.2 mg/L;最晚生根时间为15天,此时NAA浓度为0.8 mg/L,可见高浓度NAA会延迟生根。处理S1的平均生根率是100.00%,平均根数为5.33,两者显著高于处理S2、S3、S4,植株生长非常良好,根系多,粗长,并且有次生根。处理S1平均根长最长为0.64 cm,其次为处理S2,再次是处理S3,最后是处理S4,根长为0.12 cm,与其他处理差异显著。
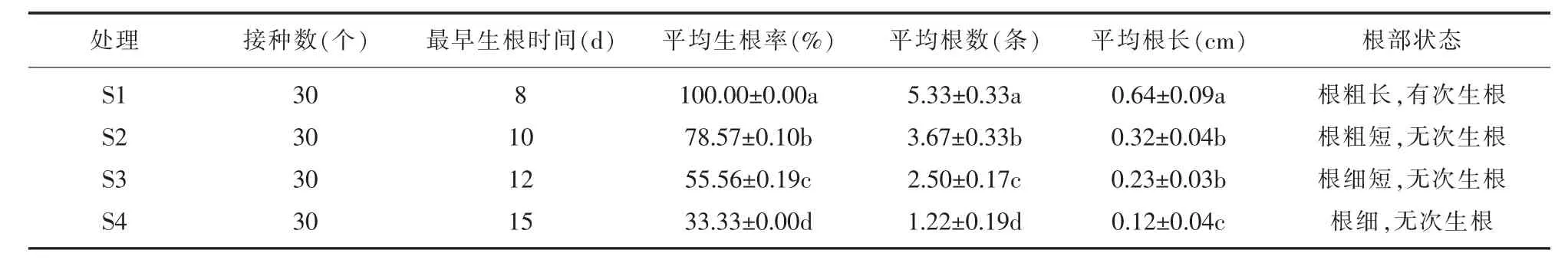
表8 不同浓度激素对丹参生根的影响

图3 不同浓度激素对丹参生根的影响
总体来看,随着NAA浓度的提高,生根率、平均生根数和平均根长都在下降,说明低浓度NAA对丹参芽苗生根有显著影响,高浓度NAA对丹参芽苗生根有阻碍作用。试验结果表明,丹参芽苗生根培养基的最佳配方是1/2 MS+0.2 mg/L NAA,此时根系粗长,根系多,有次生根。
3 讨论与结论
人工种植过程中高产栽培措施的应用导致了丹参药用成分下降,病毒侵染以及不可控的异花授粉也加重了丹参药用成分含量的下降,因此,培育出高质高量的丹参种苗,进行丹参组织培养技术研究十分有必要。
在研究丹参组织培养技术过程中,获得无菌外植体、控制杂菌污染是初代培养的关键所在。本试验得出最佳消毒处理的方案为75%乙醇消毒30 s,再用0.1%升贡溶液消毒10 min,与董静静[13]等的结论有吻合。通过试验发现在0.1%升汞中消毒时间达到15 min,茎段长势较弱,可能是因为氯化汞在进入切口内组织,且无菌水无法将其表面灭菌剂冲洗干净,致使植物材料生长受到影响。所以用升汞处理的时间过长和过短都不适宜,时间过长易造成外植体细胞死亡,时间过短消毒效果差。
在茎段腋芽诱导过程中,在培养基中添加了激素NAA与6-BA,结果表明,丹参茎段诱导腋芽培养基的最佳配方为MS+6-BA 1.5 mg/L+NAA 0.1 mg/L,但与田宇红[14]等发现的结论,诱导丛生芽的最佳培养基配方是MS+6-BA 1.0 mg/L+NAA 0.1 mg/L有所差异,原因可能有:接种时采用的外植体大小、幼嫩程度不同;丹参产地和品种的不同;培养的时间和温度导致诱导率不同。
继代培养阶段是对初代培养获得的培养材料进行增殖,不断分化形成新的完整植株、丛生苗,是丹参快繁的重要阶段,通过“芽生芽”的方式进行增殖,增值系数高,繁殖速度快。单芽苗、丛生苗多是从外植体的顶芽或腋芽直接萌发而来,芽苗变异小,性状均一稳定,用于丹参良种快繁十分有利。本试验研究发现,最佳的丹参继代培养基配方为MS+6-BA 1.0 mg/L+NAA 0.4 mg/L,此时幼苗叶大,呈棕绿色,茎干粗,丛生芽多,生长旺盛。试验表明,6-BA和NAA配合使用对丛生芽的生长、茎段的增殖有影响,适宜浓度的配比有促进作用。
本试验研究发现,丹参幼苗生根培养基的最佳配方是1/2 MS+0.2 mg/L NAA,与梁宏伟[15]等发现结论一致。在此浓度下,植株根系粗长,根系多,有次生根。试验表明,适宜浓度度NAA对丹参生根有显著影响,高浓度NAA对丹参生根有阻碍作用。
以丹参具节茎段作为外植体,研究发现,最佳消毒方案为75%乙醇消毒30 s与0.1%升汞溶液消毒10 min。丹参茎段诱导腋芽的最佳方案为MS+6-BA 1.5 mg/L+NAA 0.1 mg/L。丹参继代培养的最佳配方为MS+6-BA 1.0 mg/L+NAA 0.4 mg/L。丹参生根培养的最佳配方是1/2 MS+0.2 mg/L NAA。本研究以“芽生芽”的微体快繁技术提升丹参繁殖速度,获得的种苗繁殖速度快、形状优良,保证了优良种质资源快速供应。

