蒲公英提取物对凡纳滨对虾优势腐败菌群体感应及保鲜效果的影响
刘泰戈,许腾腾,钱怡霖,闫师杰*,刘尊英*
蒲公英提取物对凡纳滨对虾优势腐败菌群体感应及保鲜效果的影响
刘泰戈1,许腾腾2,钱怡霖2,闫师杰1*,刘尊英2*
(1.天津农学院 食品科学与生物工程学院,天津 300392; 2.中国海洋大学 食品科学与工程学院,山东 青岛 266003)
旨在探究蒲公英提取物(Extracts,TME)对凡纳滨对虾的优势腐败菌嗜水气单胞菌()群体感应(Quorum Sensing,QS)系统的抑制作用,并探究TME对凡纳滨对虾低温贮藏保鲜效果的影响。本研究采用菌株紫色杆菌(,CV026)测定TME群体感应抑制活性,并在亚抑菌浓度下测定TME对嗜水气单胞菌群体感应系统的抑制作用;随后测定凡纳滨对虾储藏过程中的菌落总数、挥发性盐基氮(Total Volatile Base Nitrogen,TVB-N)、pH值、汁液流失率以及感官评分的变化。TME对嗜水气单胞菌的最小抑菌浓度(Minimum Inhibitory Concentration,MIC)值为32 mg/mL。在1/4 MIC浓度下,TME显著抑制了嗜水气单胞菌群体感应信号分子的产生,并显著抑制嗜水气单胞菌群集运动能力和蛋白酶活性(<0.05),TME处理显著抑制了凡纳滨对虾储存过程中感官评分的降低和菌落总数、TVB-N、pH值、汁液流失率的上升(<0.05)。蒲公英提取物通过调控腐败菌的QS系统,降低了腐败菌的致腐能力,有效延长了凡纳滨对虾的保质期。
蒲公英提取物;嗜水气单胞菌;群体感应抑制剂;保鲜技术
嗜水气单胞菌()是一种常见的革兰氏阴性水产品腐败菌,其毒力因子表达和生物膜形成受群体感应系统调控[1]。群体感应是一种细菌细胞之间依靠自诱导物(Autoinducers, AIs)作为信号分子进行交流的系统,自诱导物在环境中积累达到一定浓度时会通过结合受体蛋白激活特定基因表达,并导致细菌的多种群体性行为的产生,如毒力因子分泌、生物发光、生物被膜的产生、细菌胞外酶的分泌等[2-3]。革兰氏阴性菌存在由N-酰基高丝氨酸内酯(Acyl Homoserine Lactones,AHLs)及其衍生物类信号分子介导的QS系统和由自诱导物-2(Autoinducer-2,AI-2)信号分子介导的QS系统[4-5]。
下面讨论d(v)≥7的情况。如果v是7-点,由(c)得,对于所有的i=1,2,…,7有c(v)=8, f3(v)≤5,d(vi)≥3。由引理2知,v至多关联两个有3-点的3-面,并且这两个3-面至多从v处获得假设关联v的3-面相邻一个3-点w,则v的邻点除了w都是4+-点。首先,我们讨论3-面相邻3-点的情况。假设f3(v)=5,则假设f3(v)=4,则假设f3(v)=3,则假设f3(v)=2,则c*(v)=假设f3(v)=1,则假设f3(v)=0,则其次,讨论3-面不相邻3-点的情况。假设f3(v)=5,则假设f3(v)=4,则假设f3(v)=3,则c*(v)=假设f3(v)=2,则
传统的食品防腐剂会诱导细菌产生耐药性,而群体感应抑制剂(Quorum Sensing Inhibitor, QSI)可以在亚抑菌浓度下通过多种方式干扰细菌群体感应过程来抑制细菌行为,并有效降低细菌的耐药性[6-7]。研究表明,天然植物提取物有群体感应抑制活性,可以降低信号分子的产量。例如,红洋葱皮、三叶金丝桃和银杏叶外果皮提取物均可通过抑制细菌的QS系统有效抑制不同腐败菌和致病菌的致腐能力、毒性和生物膜产生能力[8-10]。
蒲公英()是菊科多年生草本植物,营养丰富且有多重生理及抑菌功能,其提取物中的黄酮类、多酚类等物质可对大肠杆菌、沙门氏菌和金黄色葡萄球菌等常见的食品腐败菌和致病菌有不同程度的抑制作用[11]。但是目前缺乏蒲公英提取物对嗜水气单胞菌QS系统抑制作用及机理的报道。本研究利用报告菌株紫色杆菌CV026测试蒲公英提取物的QSI活性,进而探究其对嗜水气单胞菌群体感应系统的抑制效果和对冷藏凡纳滨对虾保鲜效果的影响,为开发以蒲公英为原料的新型抑菌剂提供理论依据。
1 实验
1.1 材料与仪器
主要材料:蒲公英,购于青岛医保城药业集团有限公司;新鲜的凡纳滨对虾,购买于青岛南山水产市场;紫色杆菌CV026,接受自美国Texas State University的McLean JC教授;嗜水气单胞菌,分离自凡纳滨对虾,实验室保存[12];C4-HSL标准品,Sigma公司;卡那霉素和5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal),北京索莱宝科技有限公司。
主要仪器:THZ-98AB全温振荡培养箱,上海润度生物科技有限公司;Multiskan FC酶标仪、NanoDrop Lite Plus分光光度计,Thermo Fisher Scientific公司;H2-16KR高速冷冻离心机,湖南赛特湘仪离心机仪器有限公司。
实验数据采用Origin 2021进行统计分析。每个处理有3个平行,数据均采用平均值±标准偏差的形式表示,0.05表示差异性显著。
1.2 蒲公英提取物的制备与MIC测定
1.8.3 pH的测定
1.3 蒲公英提取物群体感应抑制活性检测
参考潘玉荣等[14]的方法进行检测,在含有20.00 µg/mL C4-HSL的LB肉汤中添加TME使浓度分别为1.00、2.00、4.00和8.00 mg/mL。接种1%的紫色杆菌CV026,在160 r/min、28 ℃条件下振荡培养24 h。另设置一组不含C4-HSL的LB肉汤培养基做空白对照[15]。依次取添加了C4-HSL的培养液500 µL,然后将其放置在4 ℃、1 000 r/min的条件下离心5 min,最后将上清液弃去,将二甲亚砜溶解紫色菌素加入沉淀中,再将其放置在4 ℃、1 000 r/min的离心器内离心5 min,最终测定上清液的OD585值。
1.4 嗜水气单胞菌生长及群集运动的测定
在LB肉汤中添加TME使其质量浓度分别为2.00、4.00和 8.00 mg/mL,接种嗜水气单胞菌,以160 r/min的速率、28 ℃的温度进行振荡,每隔2 h检查一次,记录48 h的生长情况。
1.8.2 挥发性盐基氮菌落总数的测定
通过测迁移圈直径计算TME对嗜水气单胞菌群集运动的抑制率[16]。活化嗜水气单胞菌备用,在200 mL蒸馏水中分别加入2 g胰蛋白胨、1.0 g氯化钠、1.0 g琼脂及1.0 g葡萄糖制成群集培养基。将不同质量浓度的TME(0.00、2.00、4.00和8.00 mg/mL)加入到群集培养基中,然后倒板,凝固后在平板中央加2 µL菌液于28 ℃恒温培养箱中培养48 h,并测量迁移直径。
1.5 嗜水气单胞菌蛋白酶活性的测定
将灭菌的15%脱脂乳与LB琼脂培养基冷却至50 ℃,并按体积比1∶9混合均匀后倒平板并打孔。将1.4节中的嗜水气单胞菌菌液于9 000 r/min下离心10 min,吸取100 µL上清液加入牛奶平板中,在28 ℃恒温培养48 h后测量分解圈直径并计算抑制率[17],以未加提取物组作为对照。
1.6 蒲公英提取物对嗜水气单胞菌N-酰基高丝氨酸内酯产量的影响
提取并采用报告平板法检测N-酰基高丝氨酸内酯(AHLs)[18-19]。将嗜水气单胞菌以1%的体积分数种于200 mL LB肉汤中,添加TME使其终质量浓度分别为4.00 mg/mL和8.00 mg/mL。在28 ℃、160 r/min下振荡培养18 h后于4 ℃、10 000 r/min离心10 min,用等体积含0.5%甲酸的乙酸乙酯萃取上清液,于40 ℃下旋蒸上层有机相,并用1.00 mL甲醇溶解得到AHL粗提液,经0.22 µm滤膜过滤粗提液除菌,置于−20 ℃储存,以未添加提取物的液体培养基组作为阴性对照组。
The mRNA level of HMGB1 in the myocardium of the baseline group was positively correlated with BNP and LVEDD(r=0.850,P=0.003;r=0.916,P=0.001,Figure 6),but negatively correlated with LVEF(r=0.880,P=0.001,Figure 6).
准确称取不同处理组的样品10 g,加水至100 mL,混合均匀后进行打浆,取过滤后的滤液使用pH计进行测定。
1.7 凡纳滨对虾处理
1.8.6 凡纳滨对虾中AHLs的提取及检测
1.8 保鲜效果测定
1.8.1 菌落总数的测定
参照GB 4789.2—2022《食品微生物学检验菌落总数测定》中的方法测定[20]。
(二)加强护理 治疗期间应禁食禁水,对其排泄物要严格消毒,注意对病犬保暖。康复期应停喂牛奶、鸡蛋、肉类等高蛋白、高脂肪性饲料,以减轻胃肠负担,提高治愈率。对病犬的用具、犬舍、场地等进行严格的消毒以防感染其它症状。
挥发性盐基氮(Total Volatile Base Nitrogen,TVB-N)参照GB 5009.228—2016《食品中挥性盐基氮的测定》中微量扩散法测定[21]。准确称取不同处理组的样品20 g,加入100.0 mL水,均匀混合后,浸渍30 min,过滤收集滤液。然后参照标准中的方法进行TVB-N值的测定。
蒲公英提取物(extracts,TME)制备:蒲公英在50 ℃烘箱中烘烤24 h,磨碎,按照料液比1∶10(质量体积比)加入蒸馏水煮沸15 min,上清液冷冻干燥成干粉状并贮存于−20 ℃。使用时需在复溶后用0.22 µm滤膜过滤除菌。TME对嗜水气单胞菌的最小抑菌浓度通过倍比稀释法确定[13]。
过夜培养的紫色杆菌CV026以2%的体积分数接种于LB琼脂中(加入卡那霉素使质量浓度为20.00 mg/mL),倒平板打孔并加入20 μL上述不同浓度的AHL粗提液。在28 ℃恒温培养箱静置培养24 h,并测量紫色晕圈直径。
1.8.4 感官评分的测定
感官评定参考文献[22]中的方法。感官评价小组由7名人员组成,评定内容主要包括色泽、气味、组织形态等方面。评价总分在0~10分,当分数低于6分时,视为不可接受。具体评分标准如表1所示。
1.8.5 汁液流失率测定测定
同时,计算所有监测点平均累计沉降量,分析平均累计沉降量与时间的变化规律。如图3所示,监测开始时,建筑物整体有0.6 mm左右的上升,这是因为地铁施工方式引起的暂时性上升,随后,建筑物整体处于沉降阶段。可以看出,从监测开始的第5天到第150天左右,建筑物都处于沉降过程,并且沉降量和监测时间呈线性相关关系。150天以后建筑物沉降曲线趋于平缓,表明建筑物沉降量已几乎不再变化,建筑物处于稳定状态。
根据岑剑伟等[23]的方法加以修改,测定汁液流失率。测定贮藏过程中样品及残留在包装袋内的汁液质量(1)、取出虾肉后袋内渗出的汁液质量(2)。汁液流失率()的计算公式如下:=(2/1)×100%。
鲜活的凡纳滨对虾加冰猝死,去掉虾头、虾壳,使用无菌牙签挑出虾线,流水冲洗2~3次。将虾仁随机等量地分为3组(每组1.0 kg±0.1 kg),分别为空白对照组(未经提取物处理)、阳性对照组(经8.00 mg/mL卡那霉素浸泡处理15 min)、蒲公英处理组(经8.00 mg/mL TME浸泡处理15 min)。然后将处理后的样品无菌密封保存,并于4 ℃条件下进行贮藏,每间隔2 d随机取样进行相关指标测定。每个实验均重复3次。
参考文献[18]中的方法对凡纳滨对虾体内的AHLs进行提取。取不同处理组切碎后的对虾样品200 g,加入200 mL含有0.5%甲酸的乙酸乙酯,均质8 min后,以8 000 r/min的转速离心5 min;收集乙酸乙酯相,经过旋蒸浓缩后使用1 mL DMSO溶解,冷冻储存备用。
表1 感官评分标准
将提取物、根癌农杆菌A136裂解物和KH2PO4(20 mmol/L)以1∶1∶2的体积比均匀混合,取200 μL于无菌96孔板中,加入X-gal(500 μg/mL),28~30 ℃培养3 h,测定OD635处吸光度值。以等体积DMSO作为对照。
1.9 数据处理
1) Wλ=1,WMAC=1,wp=0,以1∶6阶模态频率和1∶6阶振型相关系数为目标(图4-图6)。
2 研究结果
2.1 蒲公英提取物最小抑菌浓度的结果
如图1所示,蒲公英提取物对的MIC值为32.00 mg/mL,低于该浓度的TME仅抑制的群体感应行为而不直接杀灭细菌。后续实验浓度可选择的亚抑菌浓度为0.00、1.00、2.00、4.00和8.00 mg/mL。
1)在Matlab中对每个网络在10个TRs(23.4 s)的滑动时间窗口内的时间序列数据执行SVD,得到每个参与者、网络和时间窗口的酉矩阵。
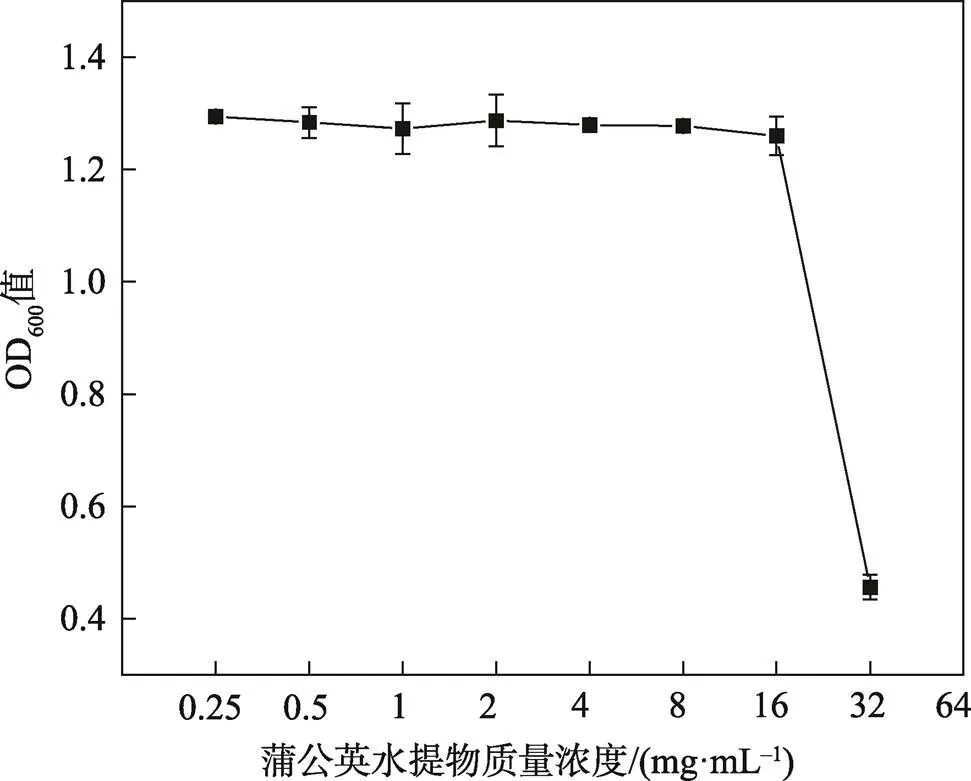
图1 TME对嗜水气单胞菌的最小抑菌浓度
2.2 蒲公英提取物的群体感应抑制活性
如图2所示,细菌密度显示亚抑菌浓度下TME对紫色杆菌CV026的生长没有显著影响,但显著影响紫色菌素的产生,8 mg/mL的TME对紫色素产量的抑制率达到49.04%(<0.05)。表明TME可在不影响紫色杆菌生长的情况下调控其群体感应系统,从而抑制紫色菌素的产生。
2.3 蒲公英提取物对嗜水气单胞菌群集运动的影响
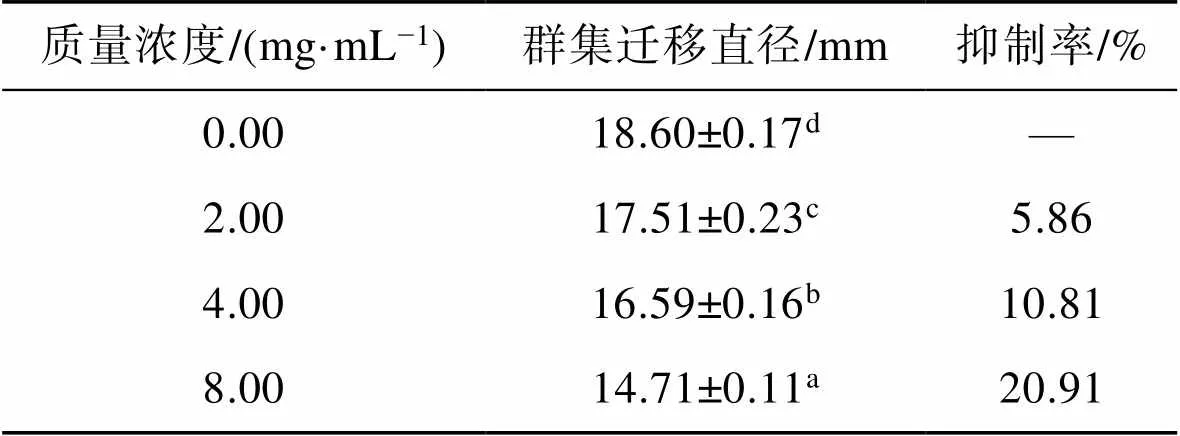
如图3所示,随TME浓度增加,嗜水气单胞菌迁移直径减小,细菌的群集运动受到明显抑制。当TME质量浓度为4.00 mg/mL和8.00 mg/mL时,对嗜水气单胞菌群集运动的抑制率分别为32.67%和80.78%(<0.05)(表2),表明蒲公英提取物在亚抑菌浓度下可以显著抑制嗜水气单胞菌的群集运动能力。
为普通群众亮吗?理论上是对的,但现实中真这么做的话,会被一些人认为不是傻子就是疯子。因为,群众的眼睛既是“雪亮的”又是“不亮的”。在一个单位,大家一起学习,一起工作,低头不见抬头见,谁工作勤奋,作风正派,群众的眼睛看得很准。可一到了关键事情上,在一些单位比如提拔重用,调职调级,评选先进等,群众的眼睛又“不亮”了,只有局长的眼睛是“雪亮的”。局长说谁行谁就行不行也行,群众大多不知情,等到知情时,已下发红头文件。到这时,不管群众心中如何想,都必须在政治上思想上组织上行动上与局长保持高度一致,不得妄议。
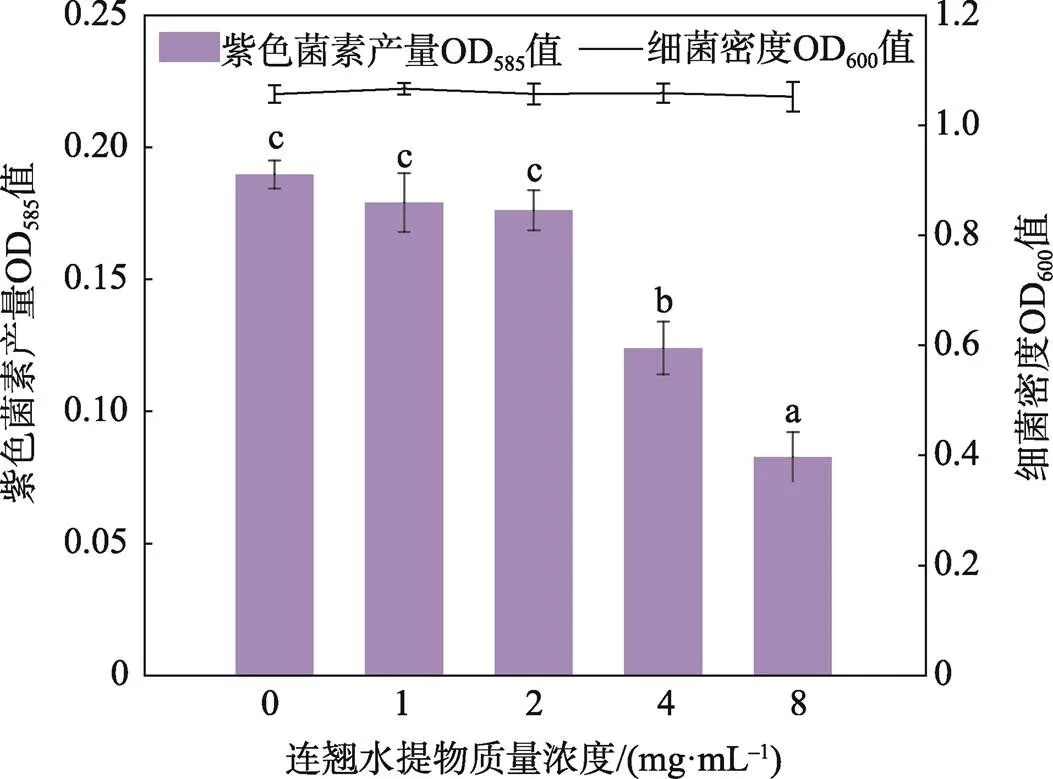
图2 TME对紫色杆菌CV026生长和产紫色菌素的影响
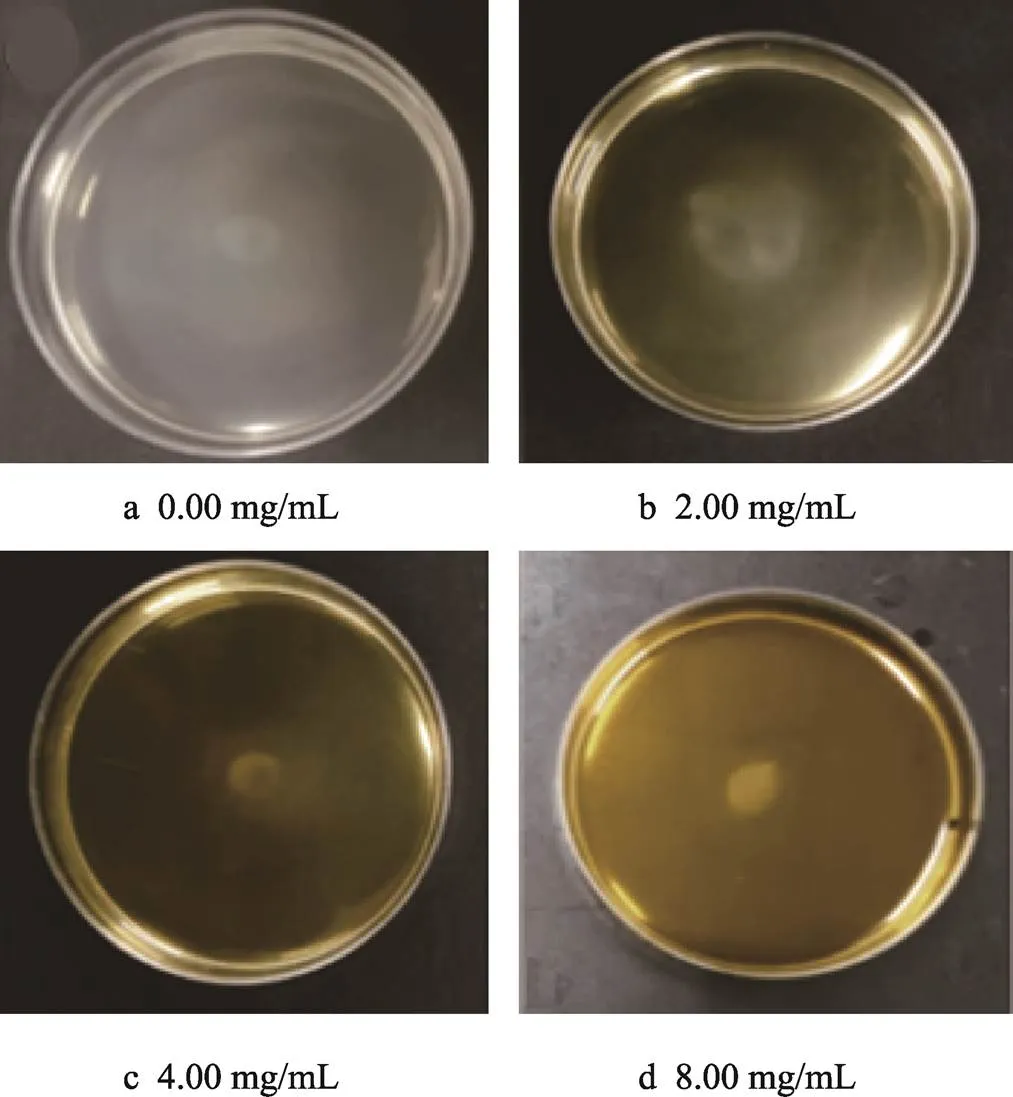
图3 不同质量浓度TME对A. hydrophila群集运动的影响
2.4 蒲公英提取物对嗜水气单胞菌蛋白酶活性的影响
微生物分泌的蛋白酶可以分解食物中的蛋白质,并加速食品品质劣变[24]。如图4所示,随TME浓度增加,嗜水气单胞菌蛋白酶分解透明圈直径逐渐减小,蛋白酶活性逐渐降低。TME对嗜水气单胞菌蛋白酶活性抑制率在其质量浓度为4.00、8.00 mg/mL时分别达到10.81%和20.91%(<0.05)(表3),表明蒲公英提取物在亚抑菌浓度下可以显著抑制嗜水气单胞菌的蛋白酶活性。
业主的成员权是指业主从专有部分的所有权中产生的对共有财产以及其他物业所享有的管理权、监督权等。基于所有权的成员权是区分所有人在所有人团体中的资格,成员凭借这种资格而享有表决权、选举权等。成员权的实现主要体现为一种财产利益以及围绕财产权利形成的共同管理权。这种共有权和共同管理权的行使必然通过全体业主的共同意志来表达,与全体业主外部的公共利益没有直接关系,而全体业主的共同意志必须在民主的基础上形成,要求业主平等、自愿地参与小区物业共有权的行使,具体表现为成员权的内容和形式由业主团体自治来决定。这种权利不同于所有权,而是成员参与管理,体现基层民主和自治,并不完全由私法来调整。㉜
表2 不同质量浓度TME对嗜水气单胞菌群集迁移直径及抑制率的影响
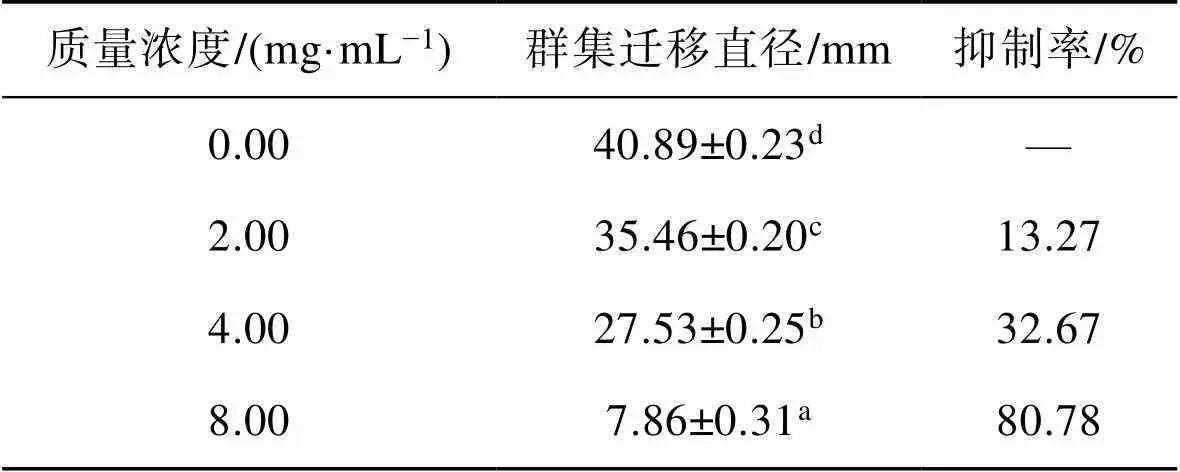
Tab.2 Effect of different concentrations of TME on the swarming motility and inhibition rate of A. hydrophila
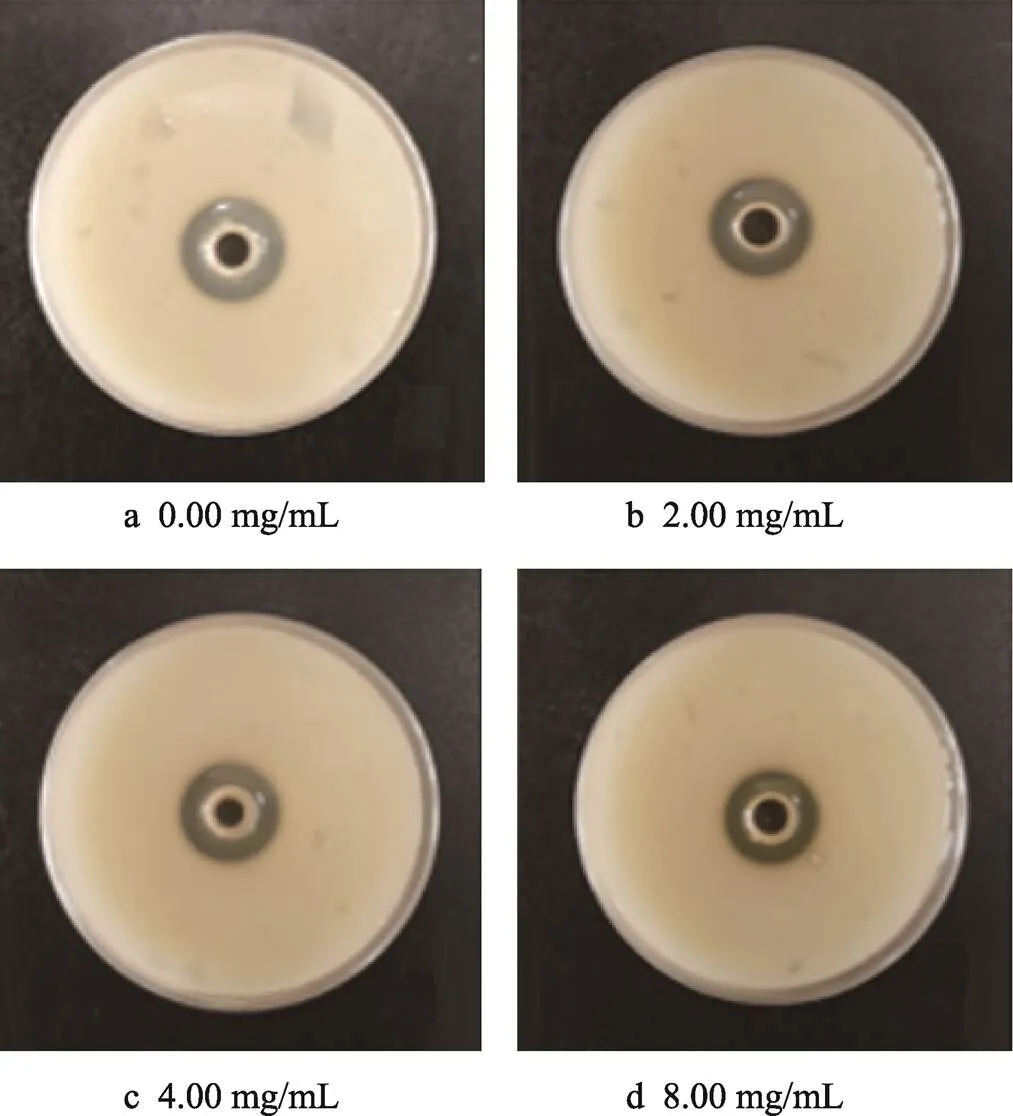
图4 不同质量浓度TME对嗜水气单胞菌胞外蛋白酶活性的影响
表3 不同质量浓度TME对嗜水气单胞菌胞外蛋白酶的抑制效果
Tab.3 Inhibition effect of different concentrations of TME on proteinase activity of A. hydrophila
2.5 蒲公英提取物对嗜水气单胞菌AHLs的影响
紫色杆菌CV026本身不产生AHLs型信号分子,但在外源信号分子AHLs存在时产生紫色素。因此,可用深色晕圈直径表示AHLs的相对产量。如图5所示,随TME浓度增加,嗜水气单胞菌信号分子所展示的紫色晕圈逐渐减小。低浓度TME对嗜水气单胞菌信号产率无显著影响,当浓度增加至8.00 mg/mL时,对嗜水气单胞菌信号分子抑制率可达7.48%(<0.05)。表明蒲公英提取物可以通过抑制嗜水气单胞菌AHLs的产生干扰其QS系统,进而影响其代谢能力与行为特征[25]。
2.6 蒲公英提取物对凡纳滨对虾菌落总数的影响
菌落总数是表征食品腐败变质的重要指标。如图6所示,对照组与处理组的菌落总数均随着贮藏时间的延长而增加,其中空白对照组增加最快。贮藏前2 d,对照组及不同处理组的细菌增加缓慢,无明显差异。在约第6天时空白对照组菌落总数值增加至7.45 lg(CFU/g),超过微生物上限7 lg(CFU/g);蒲公英提取物处理组以及阳性对照组的菌落总数值分别为6.11、6.04 lg(CFU/g),显著低于对照组的(<0.05)。
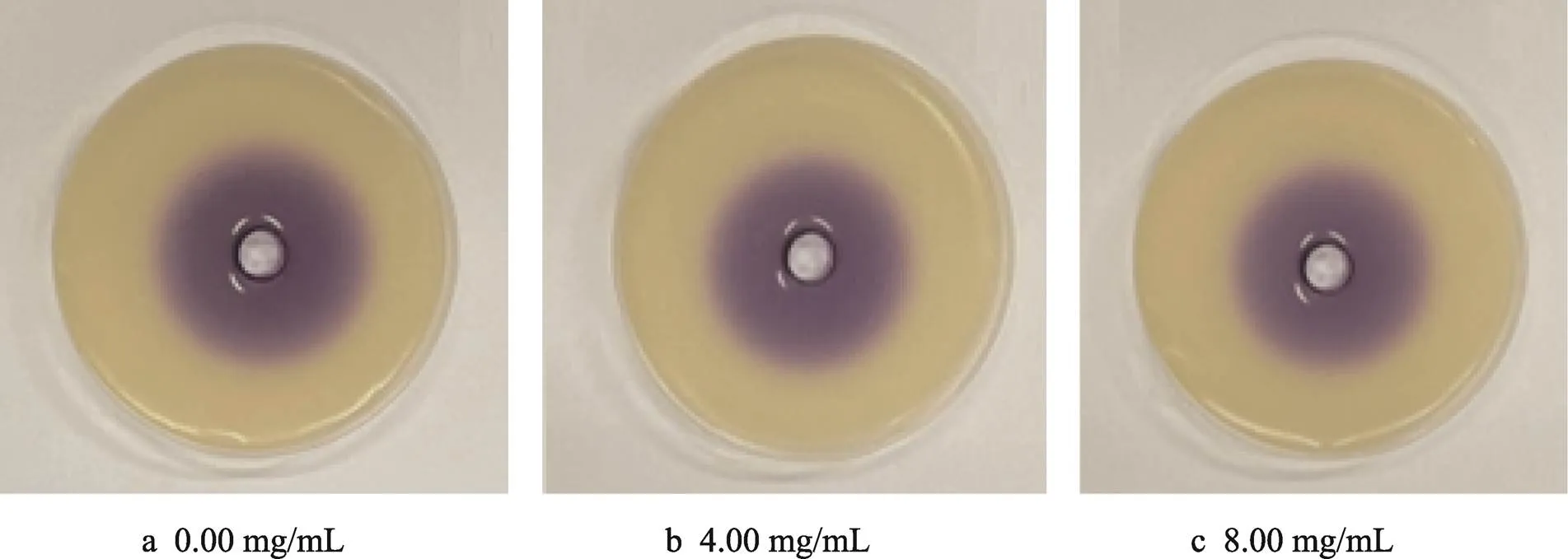
图5 TME对嗜水气单胞菌C4-HSL合成的影响
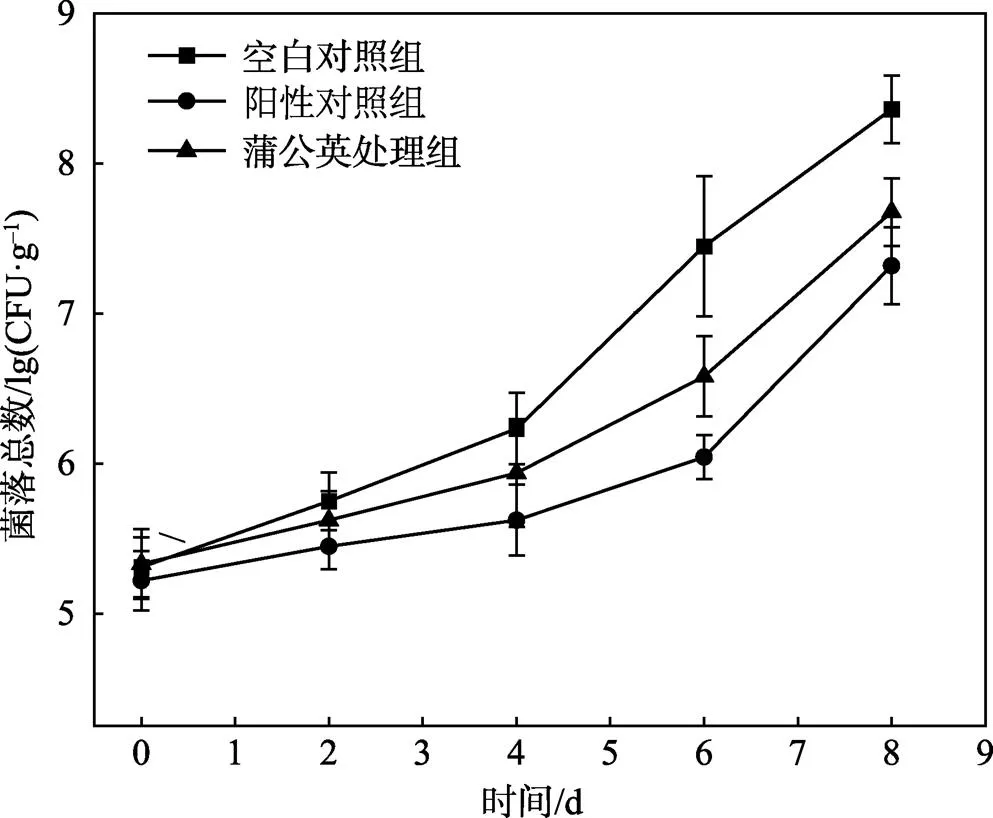
图6 TME对冷藏凡纳滨对虾菌落总数的影响
2.7 蒲公英提取物对凡纳滨对虾贮藏品质的影响
挥发性盐基氮(TVB-N)是反映水产品新鲜度的重要指标,新鲜水产品的TVB-N值可接受水平为300 mg/kg[26-27]。如图7a所示,空白对照组以及不同处理组的TVB-N值均随着贮藏时间的延长而逐渐上升;第6天时空白对照组的TVB-N含量为324.8 mg/kg,超过可接受范围。TME处理组样品的TVB-N值为245.5 mg/kg,显著低于空白对照组的(<0.05)。
透光良好的越冬水体、水中无大量浮游动物、水色又较深(透明度低于50cm)而溶氧仍大幅度下降时,就应当施肥。对一些长时间不能补充水或补水而水源营养盐含量极少的水体,在封冰后不久就应着手施肥。生物增氧施用化肥时,最好使用磷肥,少用或不用氮肥,避免氨氮升高,致鱼中毒。
样品的pH值在贮藏期间表现出先降低后增加的趋势(图7b)。这是因为在贮藏初期,对虾体内的糖原发生分解产生酸从而导致pH值的降低,而随贮藏时间的延长,蛋白质分解并产生碱性含氮物质,又使得pH值升高。与空白对照组相比,经过蒲公英提取物和阳性对照处理后,样品的pH值在后期升高缓慢。在贮藏第8天时,蒲公英提取物处理组和阳性对照组的pH值分别为7.19和7.18,显著低于空白对照组的pH值(7.43)(<0.05)。上述结果可能与添加群体感应抑制剂降低了细菌的蛋白酶活性从而引起蛋白质降解变慢有关,这与Wang等研究结果相一致[28]。
水产品贮藏过程中品质劣变可导致汁液流失,而流失的汁液为微生物的生长繁殖提供了有利条件[23],从而进一步加速水产品腐败。凡纳滨对虾汁液流失率均随着贮藏时间的延长而增高(图7c),在贮藏第8天,处理组样品的汁液流失率均低于对照组的。由图7d结果可知,在贮藏过程中,TME处理组及阳性对照组的感官评分下降较慢,表明其可以延缓冷藏凡纳滨对虾的品质劣变时间。在贮藏期内,感官评分的分值从大到小为阳性对照组、蒲公英处理组、空白对照组。在贮藏第8天时,空白对照组的感官评分降至6分以下,样品发生严重腐败并达到不可接受程度,而蒲公英处理组的样品在第8天时仍高于6分,延缓了凡纳滨对虾的品质劣变时间。
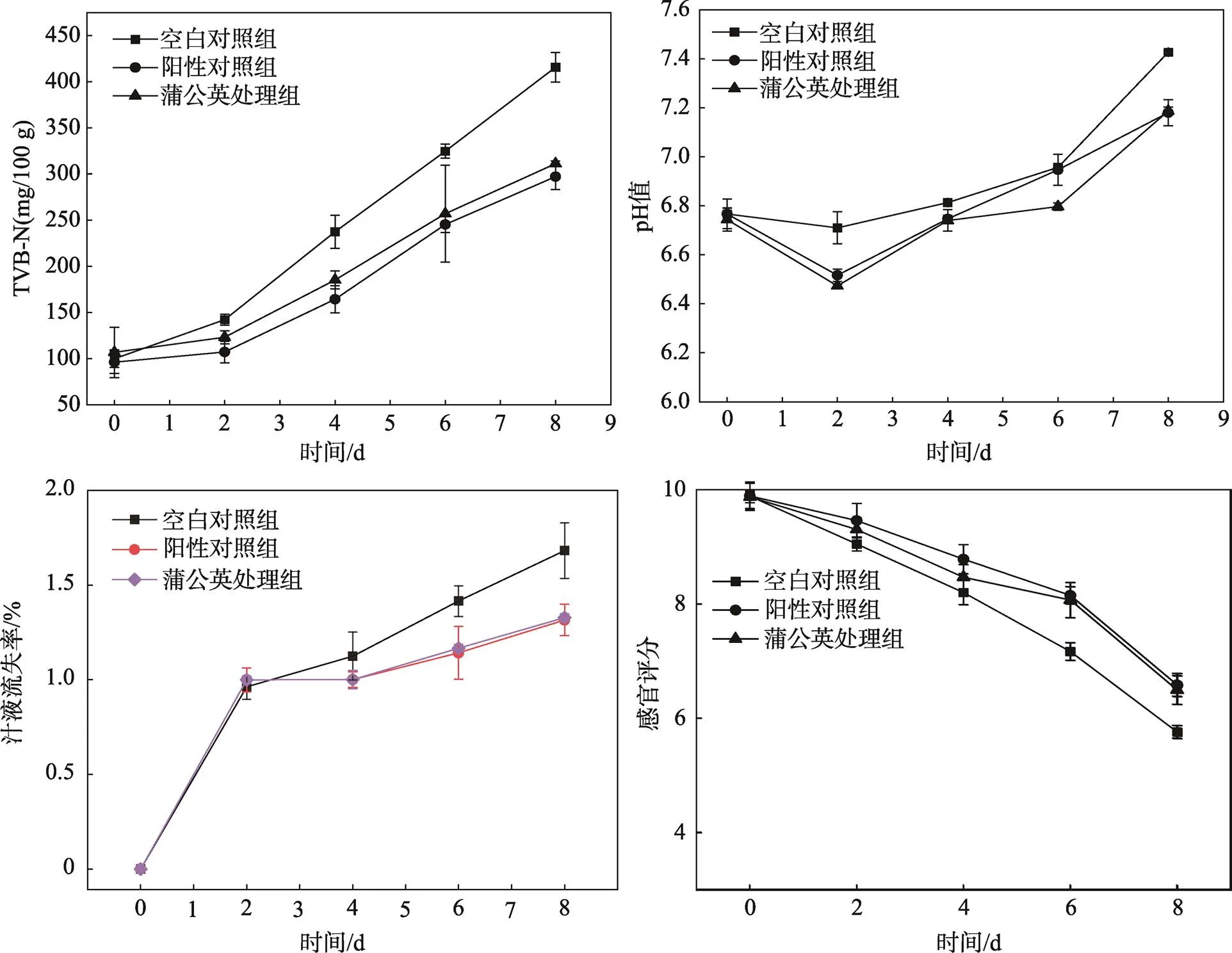
图7 TME对冷藏凡纳滨对虾贮藏品质的影响
2.8 对虾贮藏过程中AHLs含量变化
嗜水气单胞菌可以产生C4-HSL,启动自身QS系统,调控蛋白酶活性、群集运动迁移等,从而增加嗜水气单胞菌的致腐能力[29]。冷藏凡纳滨对虾贮藏过程中体内的AHLs含量变化如图8所示。在贮藏期间各处理组的AHLs含量显著低于空白对照组,且蒲公英提取物处理组的AHLs含量显著低于阳性对照组(<0.05)。在第8天时,蒲公英提取物处理组对AHLs产生的抑制率达到21.25%,而阳性对照组对AHLs产生的抑制率仅为11.36%。表明,蒲公英提取物延缓凡纳滨对虾的品质劣变可能与其阻碍了腐败菌之间的群体感应信号交流有关。
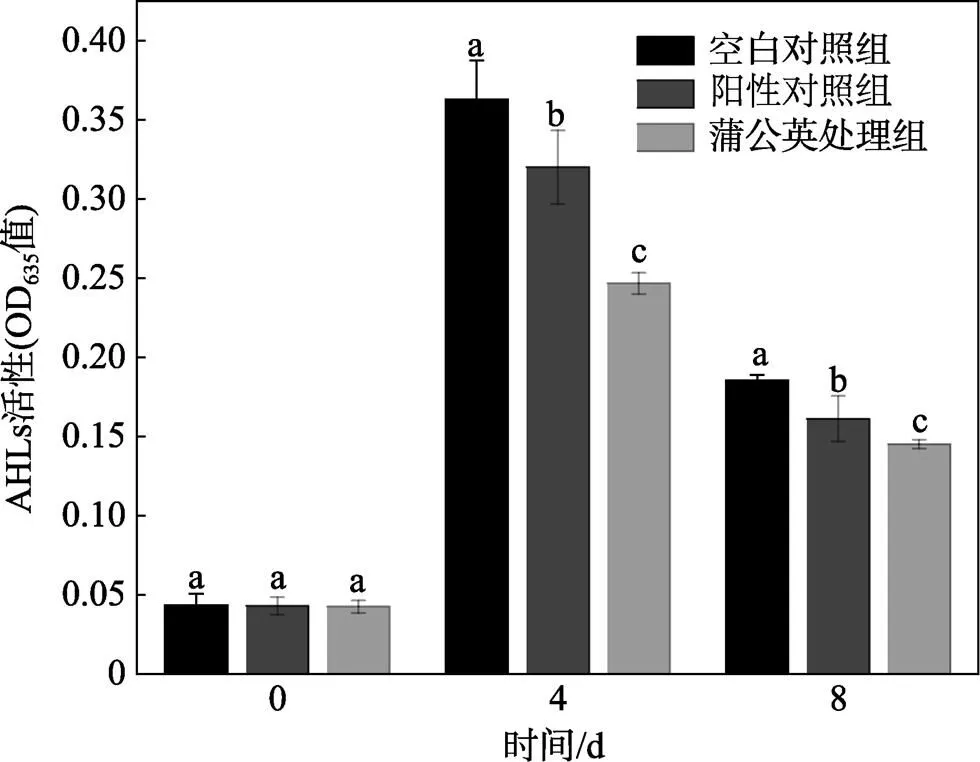
图8 冷藏凡纳滨对虾贮藏过程中AHLs相对含量的变化
3 结语
蒲公英提取物可显著抑制嗜水气单胞菌群集运动、蛋白酶活性和信号分子AHLs的产生,表现出了良好的群体感应抑制效果。
“那你的胳膊肯定会麻木,你的肌肉也会极度紧张,最后,你必须要到医院去治疗你这条胳膊……”一个同学的回答引得全班哄堂大笑。
蒲公英提取物可降低贮藏期间凡纳滨对虾的菌落总数、TVB-N含量和汁液流失率,维持较高的感官评分保持了对虾的新鲜度。蒲公英提取物可通过抑制腐败菌的信号分子产生从而调控腐败菌的QS系统,进而降低腐败菌的致腐能力,保持凡纳滨对虾的良好品质。因此,蒲公英提取物可作为群体感应抑制剂作用于腐败菌群体感应系统,可为开发以腐败菌群体感应为靶点的新型防腐剂奠定理论基础。
主站单元接收到数据后首先进行4位CRC校验,校验通过则将数据发送到上位机,校验失败将舍弃该组数据重新查询。如果重新查询三次依旧出错则使从站地址自增1跳过该从站,同时上报上位机。当某个从站从总线脱离可由主站通过查询超时判断,避免整个总线瘫痪,提高了RS-485总线的通信效率,实现了热拔插,增加了整个信号采集系统的可靠性和稳定性。
本文仅探究了蒲公英提取物对凡纳滨对虾嗜水气单胞菌群体感应的调控作用,而蒲公英提取物对水产品腐败菌菌群结构的调控、群体感应信号分子对菌群结构的影响,以及嗜水气单胞菌群体感应系统与其他腐败菌之间的作用关系与机制等仍待进一步研究。
[1] GARDE C, BJARNSHOLT T, GIVSKOV M, et al. Quorum Sensing Regulation in[J]. Journal of Molecular Biology, 2010, 396 (4): 849-857.
[2] TRUCHADO P, LARROSA M, TOMAS-BARBERAN F A, et al. Food Phytochemicals Act as Quorum Sensing Inhibitors Reducing Production and/or Degrading Autoinducers ofand[J]. Food Control, 2012, 24(1/2): 78-85.
[3] HENSE B A, SCHUSTER M. Core Principles of Bacterial Autoinducer Systems[J]. Microbiology and Molecular Biology Reviews, 2015, 79(1): 153-169.
[4] YONG Y C, WU X Y, SUN J Z, et al. Engineering Quorum Sensing Signaling offor Enhanced Wastewater Treatment and Electricity Harvest: a Review[J]. Chemosphere, 2015, 140: 18-25.
[5] GUO M, GAMBY S, ZHENG Y, SINTIM H O. Small Molecule Inhibitors of AI-2 Signaling in Bacteria: State-of-the-Art and Future Perspectives for Anti-Quorum Sensing Agents[J]. International Journal of Molecular Sciences, 2013, 14: 17694-17728.
[6] LOU Z, WANG H, TANG Y, et al. The Effect of Burdock Leaf Fraction on Adhesion, Biofilm Formation, Quorum Sensing and Virulence Factors of Pseudomonas Aeruginosa[J]. Journal of Applied Microbiology, 2017, 122(3): 615-624.
[7] DELAGO A, MANDABI A, MEIJLER, M M. Natural Quorum Sensing Inhibitors—Small Molecules, Big Messages[J]. Israel Journal of Chemistry, 2016, 56: 310-320.
[8] DHOWLAGHAR N, DHANANI T, PILLAI S S, et al. Accelerated Solvent Extraction of Red Onion Peel Extract and Its Antimicrobial, Antibiofilm, and Quorum-Sensing Inhibition Activities Againstand[J]. Food Bioscience, 2023, 53: 102649.
[9] KHIDHR R J, AHMED A A, GANJO A R, et al. Assessment of Toxicity, Anti-Quorum Sensing and Anti-Biofilm Production Effects ofExtract on Multi-Drug Resistant[J]. Journal of King Saud University-Science, 2023, 35(5): 102714.
[10] SUO A, HUA Z, WU C, et al. Effects of Ginkgolic Acid(C15:1)on Biofilm Formation, Pathogenic Factor Production and Quorum Sensing of[J]. Microbial Pathogen, 2022, 173: 105813.
[11] 聂文佳, 徐帅师, 张咏梅. 蒲公英有效成分及其药理作用研究进展[J]. 辽宁中医药大学学报, 2020, 22(7): 140-145.
NIE Wen-jia, XU Shuai-shi, ZHANG Yong-mei. Advances in the Study of Effective Components and Pharmacological Action of Dandelion[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2020, 22(7): 140-145.
[12] 于红雷, 韩云艳, 曾名湧, 等. 凡纳滨对虾源气单胞菌的分离鉴定及群体感应[J]. 生物加工过程, 2019, 17(3): 324-328.
YU Hong-lei, HAN Yun-yan, ZENG Ming-yong, et al. Identification and Quorum Sensing of Aeromonas from Litopenaeus Vannamei[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(3): 324-328.
[13] ADONIZIO A L. Anti-Quorum Sensing Agents from South Florida Medicinal Plants and Their Attenuation ofPathogenicity[D]. Miami: Florida International University, 2008.
[14] 潘玉荣, 张彩丽, 朱素芹, 等. 溴化呋喃酮对鳗弧菌群体感应调控行为的抑制研究[J]. 生物技术通报, 2017, 33(4): 231-237.
PAN Yu-rong, ZHANG Cai-li, ZHU Su-qin, et al. Inhibition of Brominated Furanone to Quorum Sensing Regulating Behaviors of[J]. Biotechnology Bulletin, 2017, 33(4): 231-237.
[15] KESHAVAN N D. Isolation and Characterization of Quorum Sensing Interfering Compounds Produced by[D]. Dallas: The University of Texas, 2006.
[16] GANESH P S, RAI V R. Evalution of Anti-Bacterial and Anti-Quorum Sensing Potential of Essential Oils Extracted by Supercritical CO2Menthod Against[J]. Journal of Essential Oil Bearing Plants, 2015, 18(2): 264-275.
[17] SACHERER P, DÉFAGO G, HAAS D. Extracellular Protease and Phospholipase C are Controlled by the Global Regulatory Gene gacA in the Biocontrol Strain Pseudomonas Fluorescens CHA0[J]. FEMS Microbiology Letters, 1994, 116(2): 155-160.
[18] BLANA V A, NYCHAS G J E. Presence of Quorum Sensing Signal Molecules in Minced Beef Stored under Various Temperature and Packaging Conditions[J]. International Journal of Food Microbiology, 2014, 173: 1-8.
[19] DUBERN J F, DIGGLE S P. Quorum Sensing by 2-Alkyl-4-Quinolones inand other Bacterial Species[J]. Molecular BioSystems, 2008, 4(9): 882-888.
[20] GB 4789.2—2022, 食品微生物学检验菌落总数测定[S].
GB 4789.2-2022, Microbiological Examination-Determination of Colony-Forming Units[S].
[21] GB 5009.228—2016, 食品安全国家标准食品中挥发性盐基氮的测定[S].
GB 5009.228-2016, National Food Safety Standards- Determination of TVB-N in Foods[S].
[22] 柏韵. 壳聚糖的制备及对中国对虾保鲜效果的影响[D]. 锦州: 锦州医科大学,2018
BAI Yun. Preparation of Chitosan and its Influence on the Effect of Chinese Shrimp[D]. Jinzhou: Jinzhou Medical University,2018.
[23] 岑剑伟, 蒋爱民, 李来好, 等. 高压静电场结合冰温技术对罗非鱼片贮藏期品质的影响[J]. 食品科学, 2016, 37(22): 282-288.
CEN Jian-wei, JIANG Ai-min, LI Lai-hao, et al. Effect of High Voltage Electrostatic Field Combined with Modified Atmosphere Packaging and Controlled Freezing-Point Storage on the Quality of Tilapia Fillet[J]. Food Science, 2016, 37(22): 282-288.
[24] RAI S, TYAGI A, NAVEEN KUMAR B T, et al. Isolation and Characterization oflytic Phage, and Evaluation of a Phage Cocktail AgainstContamination in Fish Fillet[J]. Food Control, 2023, 145: 109460.
[25] LI J, LIU H, WU P, et al. Quorum Sensing Signals Stimulate Biofilm Formation and Its Electroactivity for Chain Elongation: System Performance and Underlying Mechanisms[J]. Science of The Total Environment, 2023, 859(1): 160192.
[26] TAHIR H E, HASHIM S B H, KOMLA MAHUNUG, et al. Smart Films Fabricated from Natural Pigments for Measurement of Total Volatile Basic Nitrogen (TVB-N) Content of Meat for Freshness Evaluation: A Systematic Review[J]. Food Chemistry, 2022, 396: 133674.
[27] GB 10136—2015, 食品安全国家标准动物性水产制品[S].
GB 10136-2015, National Food Safety Standards for Animal Derived Aquatic Products[S].
[28] WANG YB, WANG YZ, CHEN J, et al. Screening and Preservation Application of Quorum Sensing Inhibitors ofandin Seafood Products[J]. LWT- Food Science and Technology, 2021, 149: 111749.
[29] TANHAY M H, ZAMANI H, SHAHANGIAN S S, et al. Effect of Curcumin on the Expression of ahyI/R Quorum Sensing Genes and some Associated Phenotypes in Pathogenic Aeromonas Hydrophila Fish Isolates[J]. World Journal of Microbiology & Biotechnology, 2020, 36(5): 70.
Effects ofExtract on Quorum Sensing System of Specific Spoilage Organism and Preservation of
LIU Tai-ge1, XU Teng-teng2, QIAN Yi-lin2, YAN Shi-jie1*, LIU Zun-ying2*
(1. College of Food Science and Bioengineering, Tianjin Agricultural University, Tianjin 300392, China; 2. College of Food Science and Engineering, Ocean University of China, Shandong Qingdao 266003, China)
The work aims to explore the inhibitory effect ofextracts (TME) on the quorum sensing (QS) system ofand the specific spoilage organism of, and explore the preservation effect of TME on the refrigerated. The quorum-sensing inhibitory activity of TME was investigated by using(CV026). The preservation effect of TME onand its inhibitory effect on the quorum sensing system ofwere measured at the subminimal inhibitory concentration. The total number of colonies, volatile base nitrogen (TVB-N), pH value, drip loss rate and sensory score ofduring storage were determined. The minimum inhibitory concentration (MIC) value of TME againstwas 32 mg/mL. At 1/4 MIC, TME significantly inhibited the production of quorum sensing signal molecules, and inhibited the mobility and protease activity of(0.05). TME significantly inhibited the decrease of sensory score and the increase of the total number of colonies, TVB-N, pH value and drip loss of(0.05). TME can reduce the spoilage ability of spoilage bacteria and effectively prolong the shelf life ofby regulating QS system of the bacteria.
extract;; quorum sensing inhibitor; preservation technology
TB484.3;S983
A
1001-3563(2023)23-0103-08
10.19554/j.cnki.1001-3563.2023.23.012
2023-04-25
国家重点研发计划(2021YFD2100504);国家自然科学基金(31972141)
责任编辑:曾钰婵

