探究原发灶减瘤术对肾细胞癌合并骨转移患者的生存获益
韩 超,王立东,张璐琛,王艺臻*
(1.青岛大学附属青岛市中心医院泌尿外科,山东青岛 266042;2.诸城慈海中西医结合医院外科,山东潍坊 262299)
肾细胞癌(renal cell carcinoma,RCC)占所有恶性肿瘤的3%,占原发性肾肿瘤的80%~85%,大约1/3 的患者存在转移性疾病[1]。肾细胞癌临床表现隐匿,有20%~30%的患者首诊时已出现转移[2],最常转移至肺、骨、肝、脑等。据报道骨转移发生在转移性肾癌中占比20%左右[3]。骨转移可导致骨相关事件的发生,可显著增加患者的致死率和降低患者的生活质量。减瘤性肾切除术是对转移性肾癌患者原发病灶进行切除的手术方式。在干扰素时代,减瘤性肾切除术联合干扰素免疫治疗转移性肾细胞癌患者可获得显著的生存益处[4]。这种益处在2 项随机对照试验中得到了证实[5,6]。目前,有少数研究报道了肾细胞癌合并肝转移的减瘤手术的有效性[7],对于肾细胞癌合并骨转移(RCC-BM)的有效性尚未有报道。因此,本研究基于SEER 数据库中充足的数据,旨在探究原发灶减瘤术对RCC-BM 患者的生存获益情况及RCC-BM患者的生存获益的独立预测因素。
1 材料和方法
1.1 病例来源
所有初诊RCC-BM 患者信息均通过SEER Stat 软件(Version8.3.6)获取自SEER 数据库。纳入标准:(1)病理诊断原发肿瘤为肾癌;(2)就诊时发生骨转移;(3)病理类型为肾透明细胞癌或乳头状肾细胞癌;(4)完整的临床病理资料、随访数据完整;(5)完整的肾部分切除或肾全切术信息。排除标准:(1)诊断来源信息不明的肿瘤;(2)基本信息缺失或信息不明,随访信息不明或缺失;(3)其他病理类型。
1.2 数据收集
人口统计学数据包括年龄、性别、种族、原发肿瘤位置、Grade 分级、病理类型、手术方式、T 分期、N 分期、原发肿瘤大小、原发肿瘤区域淋巴结清扫情况,远处转移部位、放化疗信息、生存状态、死亡原因和随访时间等。
1.3 研究方法
根据是否行原发灶切除及切除原发灶的手术方式分为未手术组,原发灶减瘤组,比较组间的基线差异,通过倾向性匹配分析,平衡减瘤组和未手术组的组间基线差异。通过Kaplan-Meier 法绘制生存曲线分析各组的生存情况。由于病理类型对预后的影响较为显著,所以通过Kaplan-Meier 法绘制生存曲线分析不同病理类型生存分析的差异。通过单变量和多变量Cox 比例风险回归模型分析与RCC-BM患者生存相关的预后影响因素。
1.4 统计学方法
结果终点包括总生存期(overall survival,OS)和癌症特异性生存期(cancer-specific survival,CSS)。OS 被定义为从切除肾癌原发灶直到任何原因死亡的时间,CSS 被定义为从切除原发灶直到因癌症死亡的间隔。生存分析采用Kaplan-Meier 方法进行,单因素分析采用log-rank 检验进行比较。P<0.1 的变量用于多因素分析。多因素Cox 比例风险回归模型用来确定独立预后因素,P<0.05 认为有统计学差异。所有分析均使用SPSS26.0软件以及R(4.0.3)统计软件进行。
2 结果
2.1 预后相关因素
最初通过SEER 数据库检索到总共85,568例患者。根据纳入和排除标准,纳入了607 例RCCBM 患者的数据。参与研究的患者特征如表1 所示。减瘤术组与非减瘤术组基线数据间存在差异,所以进行倾向性匹配分析,纳入134 例患者,如表2所示。
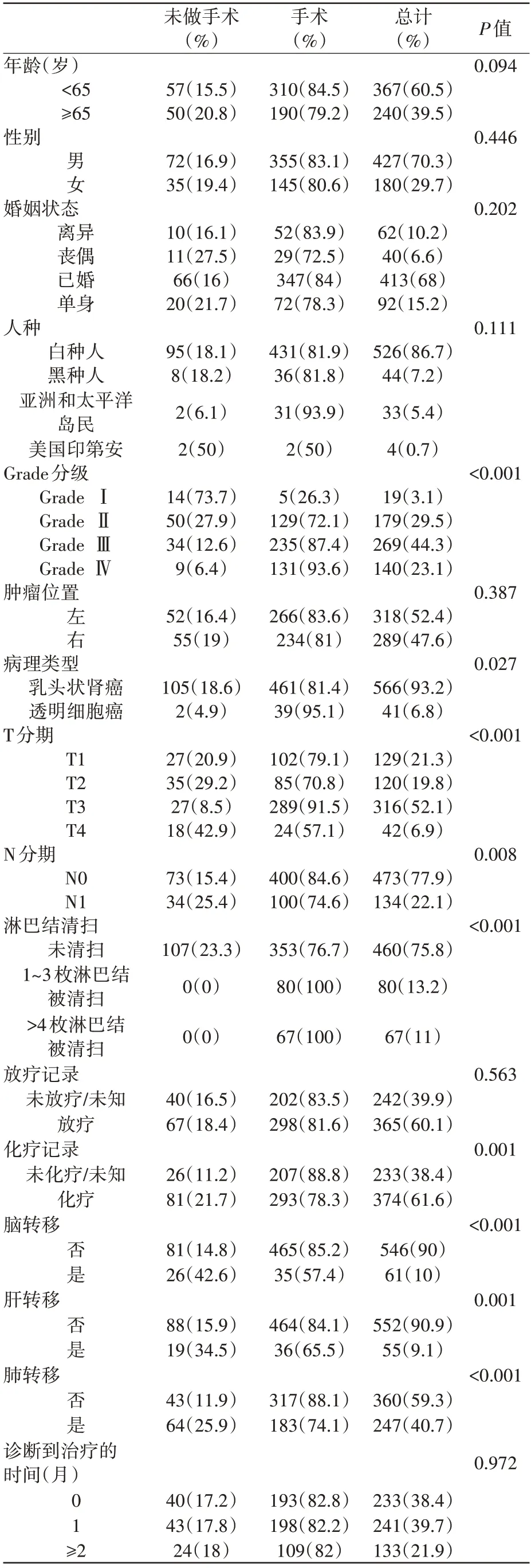
表1 匹配前纳入患者的基线信息(n=607)
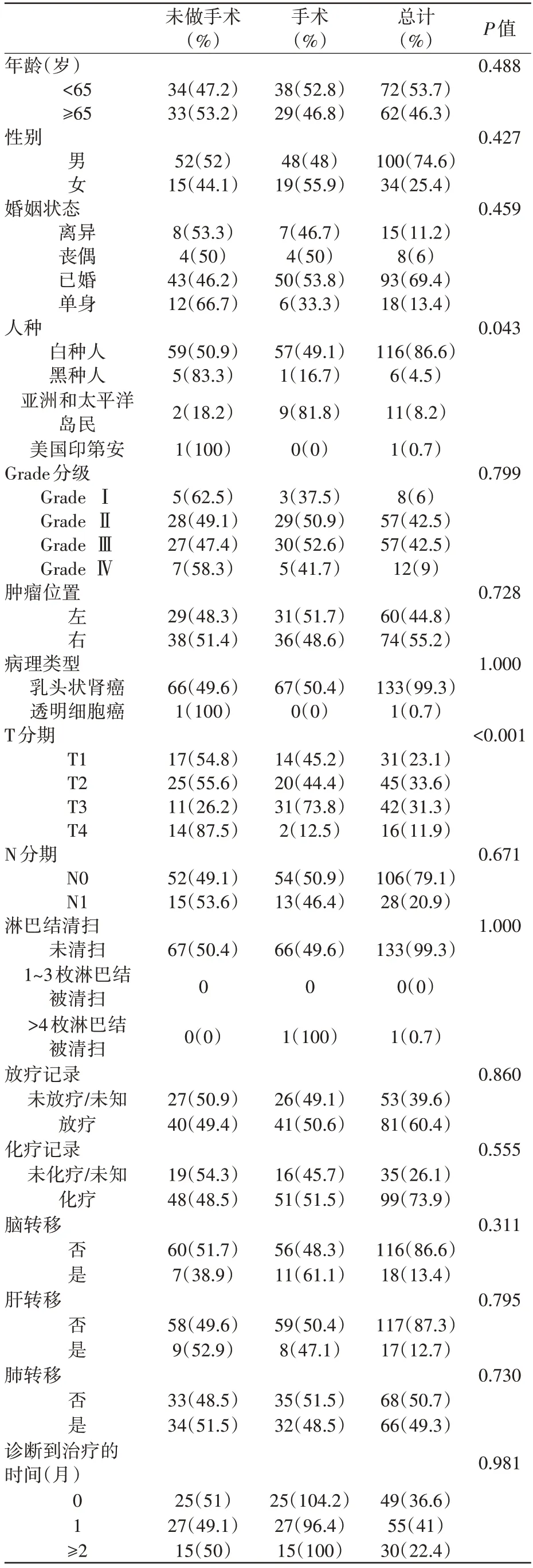
表2 匹配后纳入患者的基线资料(n=134)
基于匹配前数据,单因素Cox 分析结果表明(表3、表4):Grade 分级,肾癌病理类型,是否行减瘤手术,脑转移、肺转移是同时影响RCC-BM 患者总生存期(OS)和特异性生存期(CSS)的独立风险因素。
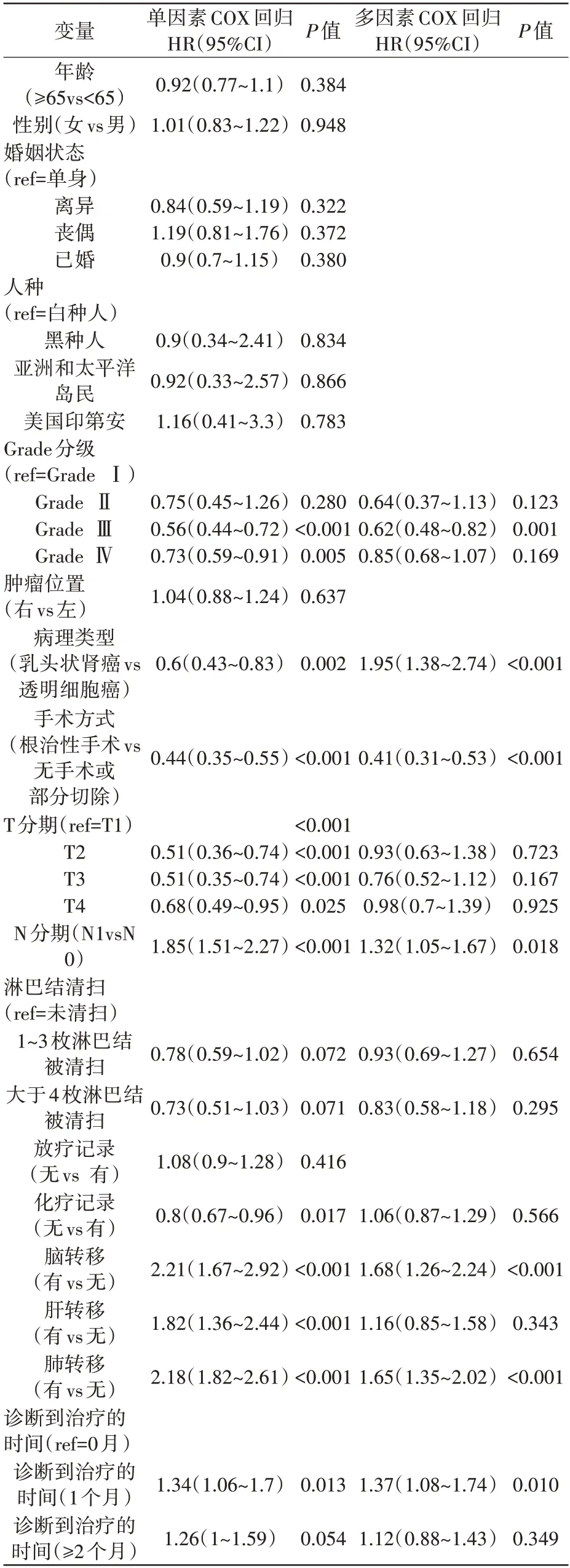
表3 匹配前数据OS影响因素的COX回归
2.2 生存分析
基于匹配后的数据,共纳入134 例肾癌合并骨转移患者,根治性切除组的1、3年OS 率分别为65.81%、35.90%;部分切除组的1、3年OS 率分别为40.60%、35.71%;未减瘤组的1、3年OS 率分别为40.10%、15.84%。减瘤组与未手术组OS 比较,差异有统计学意义(P<0.05)。
KM 生存曲线显示,在OS 和CSS 方面,与未行减瘤手术组的患者相比,减瘤手术组的患者预后明显较好(图1、2,封三)。同时,基于匹配前,未行减瘤手术、行肾部分切除减瘤术、行根治性切除术3组的亚组分析,在OS和CSS方面,肾部分切除减瘤术的生存预后优于根治切除术组及未行减瘤手术组(图3、4,封三)。对肾癌病理类型进行亚组分析,基于匹配前的数据,与肾透明细胞癌相比,乳头状肾癌的预后较差(图5、6,封三)。
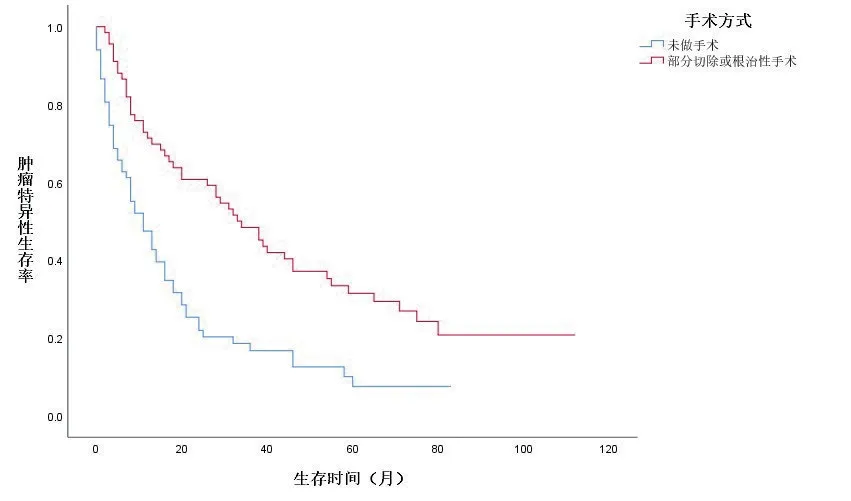
图1 匹配后数据的肿瘤特异性生存率
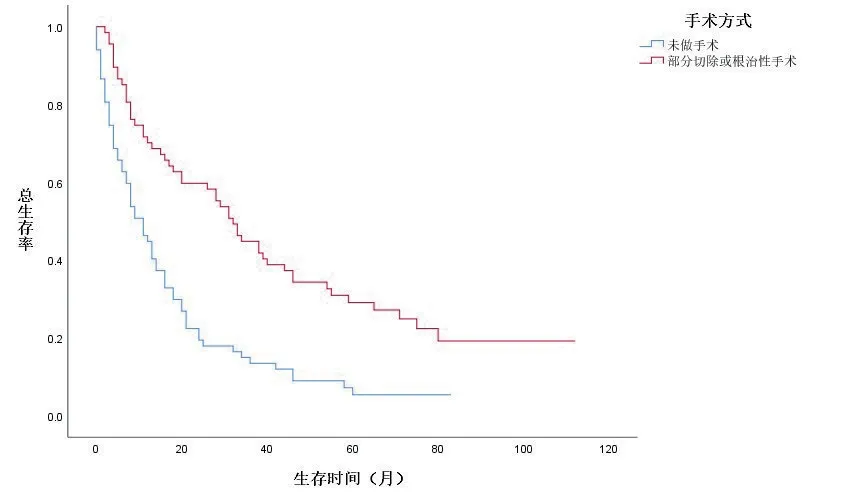
图2 匹配后数据的总生存率
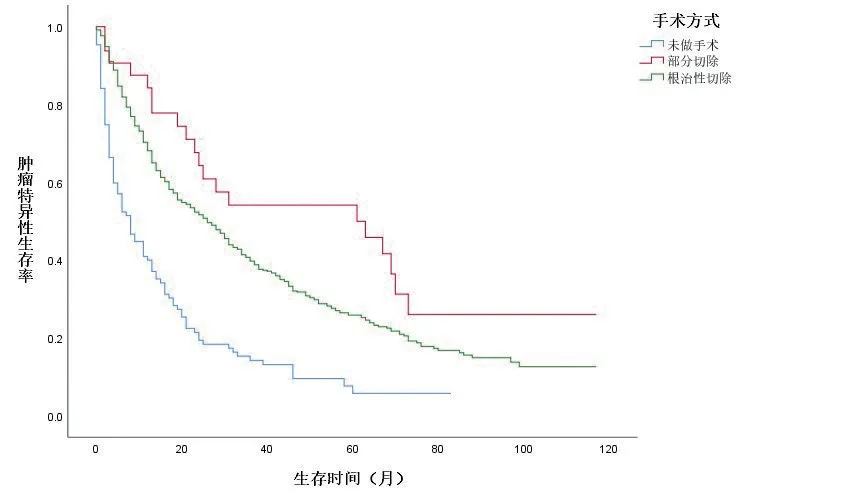
图3 匹配前数据的肿瘤特异性生存率

图5 匹配前数据的肿瘤特异性生存率
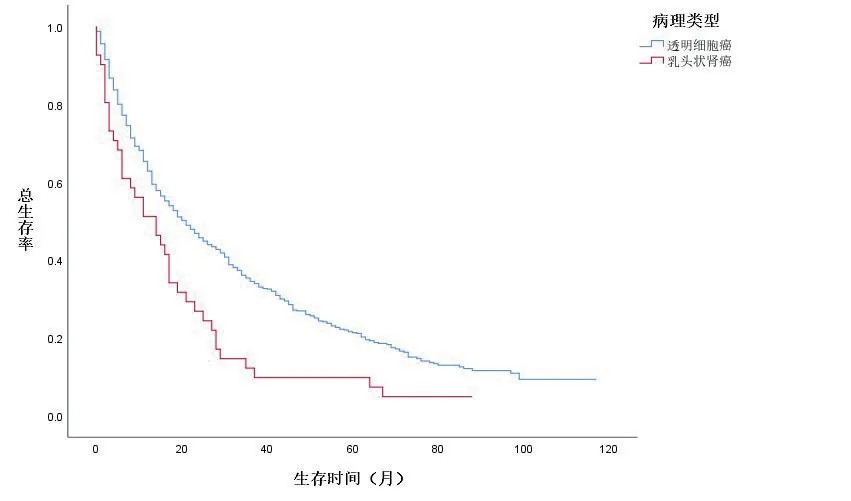
图6 匹配前数据的总生存率
3 讨论
肾癌的常见的转移部位包括肺(60%~75%),区域淋巴结(60%~65%),骨骼(39%~40%),肝脏(19%~40%)和脑(5%~7%)[8]。统计学上,骨是第三大最常见的转移部位。由于该疾病对化疗,放疗和免疫治疗的相对耐药性,对转移性疾病患者的治疗仍然是临床医生的挑战。目前大多数对肾癌转移的研究集中于肝转移等,较少涉及骨转移。晚期肾细胞癌患者中有30%~40% 发生骨转移[9,10]。因此,初步诊断时可能低估骨转移的发生率。对于肾癌合并骨转移的减瘤手术治疗,目前尚未有详细的研究报道,所以对于肾癌骨转移的研究应予以重视。
对于肾癌合并远处转移,原发灶是否切除一直是有争议的。目前对合并转移的肾细胞癌患者,仍建议全身治疗为主,尤其是目前多种靶向免疫治疗等治疗方案取得了相对较好的临床效果。在干扰素时代,减瘤手术联合干扰素免疫治疗转移性肾细胞癌患者可获得显著的生存益处。对原发灶行减瘤手术不仅可以降低肿瘤的负荷,且可以为患者在致命肿瘤负荷来临前争取系统性治疗的时间[5]。通过对原发灶的切除,不仅可以阻断促进转移灶生长的细胞因子的来源,并且可以减少肿瘤原发灶产生的免疫抑制因子,改善患者对系统性治疗的反应[11]。部分研究也提示减瘤性手术可以通过降低肿瘤总负荷从而通过降低来自原发灶的“自种植”而改变肿瘤的生物学行为[12]。减瘤手术通过去除原发灶降低生长因子水平,进而影响转移灶形成和发展所需要的血管内皮生长因子1受体的表达,从而干扰转移灶的发展[13]。
对于接受原发灶手术切除者,采用的手术方式主要为根治性肾切除术及肾部分切除术。关于手术方式的选择,笔者认为还是和肿瘤的大小密切相关。纳入分析的患者中,采取肾部分切除的患者,多为T1 肿瘤。在本研究中,通过K-M 生存曲线分析,实施肾部分切除的患者的预后要明显优于接受根治性切除术者。一方面,肿瘤较小,其肿瘤负荷较小,结合既往研究,肿瘤的大小与预后密切相关。另一方面,对于行肾部分切除术的患者,仍保留部分肾功能,这对人体是必要和有益的。本文的研究结果与既往研究结果在手术方式对预后影响方面是一致的,Krambeck 等[14]回顾性研究了420 例伴有远处转移肾癌的患者,研究结果提示,行肾部分切除的患者相对于根治性切除的患者,在1、3、5年的CSS 方面均获益。Lenis等[15]运用NCDB 数据库数据,在原发灶<4cm 的情况下,研究发现接受肾部分切除减瘤术相对于肾根治切除减瘤术的患者,预后更佳。郭博达等[16]研究中对于肾细胞癌合并肝转移的患者进行了研究,发现施行减瘤术的患者的预后要明显优于未实施减瘤术的患者。
肿瘤相关的病理特征也被发现与癌症患者的预后相关。肾透明细胞癌约占肾细胞癌70%。同时,乳头状肾细胞癌占肾细胞癌的10%~15%,是最常见的非透明细胞肾细胞癌[17,18]。因此我们在研究时只选取了透明细胞癌和乳头状癌的患者资料。已有研究报道指出,晚期或转移性乳头状肾癌的预后比透明细胞癌差[19]。有研究发现,乳头状肾细胞癌可能在某些亚组患者中预后较差:在45 岁以下的患者中,乳头状肾细胞癌患者的生存受益显著低于肾透明细胞癌患者;对于远处转移性肾细胞癌,乳头状肾细胞癌患者预后相对于肾透明细胞癌患者较差[20]。这可能是由于缺乏针对晚期乳头状肾癌的靶向治疗。这与本研究的研究结果类似。
本文基于SEER 数据库的数据进行分析,存在部分局限性。首先,数据库中缺乏患者一般身体状况的信息,如体重指数和合并症等。患有严重伴随疾病的患者往往预后不良。其次,外科医生的不同经验水平会影响患者的预后,并可能使结果产生偏差。第三,SEER数据库包含手术治疗和患者预后的信息,但缺乏术前肿瘤标志物、辅助全身和/或局部区域治疗等生物学特征的信息。因此,选择偏差的影响不能被控制。最后,手术适应证的控制,可切除性的主观定义,可能会在一定程度上影响研究的结果。本研究的结果显示,对于肾癌骨转移的患者,乳头状肾癌的预后较透明细胞癌差。同时,本研究所筛选的预后独立风险因素可提供一定的临床指导意义。肾癌骨转移患者中,减瘤性肾切除术是可考虑的治疗手段之一,可使患者受益。针对此类患者,在临床实践中是否行原发灶减瘤术应综合患者的一般情况、并发症、辅助治疗情况等多因素考虑。

