钙调神经磷酸酶在老年子宫内膜癌中的表达及其相关性分析
李建敏,高 萍,林维凤,张 艳
(高密市人民医院妇科,山东高密 261500)
子宫内膜癌是最常见的妇科恶性肿瘤之一,在过去10年中发病率每年上升约1.3%,主要发生在55~65岁之间的女性[1],研究显示老年女性的子宫内膜癌比年轻人的更具侵袭性,严重威胁女性健康[2]。因此,探索新的分子标志物并确定潜在的治疗靶点至关重要。钙调神经磷酸酶(calcineurin,CN)和下游信号通路在结直肠癌肿瘤和细胞系中被激活,抑制CN会降低肿瘤细胞的存活和增殖。此外CN与恶性肿瘤骨转移密切相关,在体内参与多种细胞功能调节[3]。然而,CN 表达在子宫内膜癌中的影响尚不完全清楚,仍有待进一步阐明。本研究检测了CN 在老年子宫内膜肿瘤组织中的表达,并探讨其与临床病理因素和预后的相关性,现报道如下。
1 资料与方法
1.1 临床资料
收集2015年3月—2021年12月高密市人民医院妇科收治的50 例老年子宫内膜癌患者作为观察组,组织类型:子宫内膜样腺癌44 例,浆液性乳头状腺癌6例。FIGO(国际妇产科联盟)子宫内膜癌分期:Ⅰ期28例,Ⅱ期6例,Ⅲ期11例,Ⅳ期5例。纳入标准:观察组所有患者均符合子宫内膜癌诊断标准,均经组织学检验确诊。所有患者均未接受任何术前治疗,包括化疗和放疗。
另选取50 例因子宫肌瘤切除的正常子宫内膜组织样本作为对照组。排除标准:合并严重感染性疾病的患者;合并其他恶性肿瘤的患者;严重肝肾功能不全的患者。本研究通过高密市人民医院伦理委员会审批(高医伦理2018-0010)。
1.2 研究方法
检测CN 在子宫内膜癌组织和正常子宫内膜组织中的表达。将各组织样本用10%中性福尔马林固定,石蜡包埋,制备成4μm厚切片。切片首先在65℃下孵育30min,然后在二甲苯中脱蜡,乙醇中水化。加入EDTA液和蒸馏水进行加压修复,进行苏木精-伊红(HE)染色。用PBS冲洗3次后,将切片在室温下暴露于小鼠抗钙调磷酸酶抗体1h。用PBS 冲洗3 次后,将切片在二抗中孵育30min。室温下将载玻片在显色底物3,3'-二氨基联苯胺中孵育,苏木精复染,脱水,吹干,封固。
CN 表达阳性的判断:根据CN 在免疫染色中的表达,评估阳性肿瘤细胞的比例,≥30%为表达阳性,<30%为表达阴性[4]。
记录患者的临床特征,包括年龄、FIGO 分期、分化程度、肌层浸润深度、淋巴结转移和远处转移。全部病例均完成随访,随访时间从患者手术时间开始截止到2022年3月。随访时记录总生存时间,总生存时间定义为从患者手术时间至死亡或随访截止时间。
1.3 统计学方法
应用SPSS18.0统计软件处理数据,组间的CN的阳性表达率的比较采用卡方检验,P<0.05 为差异有统计学意义。采用多因素Logistic 回归分析CN 阳性表达的影响因素。采用Kaplan-Meier 法分析CN 表达与预后的相关性,并用log-rank 检验进行比较。
2 结果
2.1 不同内膜组织标本中CN的表达
采用免疫组化法检测CN 在子宫内膜癌组织和正常子宫内膜组织中的表达,观察到CN主要表达于子宫内膜癌组织的细胞核中,细胞核中呈现棕褐色的颗粒,见图1A、1B(封二)。在正常子宫内膜组织中,部分腺体细胞核中可见CN 阳性表达,见图1C、1D(封二)。
2.2 CN 在正常子宫内膜组织和子宫内膜癌组织中的表达率的比较
比较对照组和子宫内膜癌组中CN的表达,表1 示,子宫内膜癌组的CN 阳性表达率显著高于对照组,差异有统计学意义(P<0.001)。
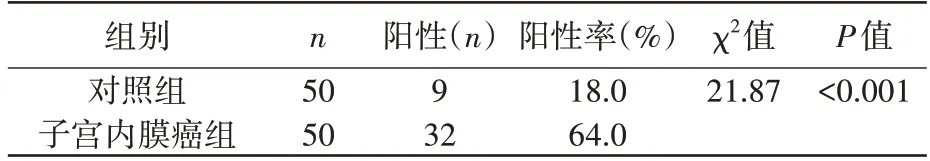
表1 CN在对照组和子宫内膜癌组中的阳性表达比较
2.3 CN表达与临床病理特征的关系
表2 示,子宫内膜癌组患者的临床病理特征中,不同病理类型、分化程度、是否合并转移的患者之间CN的阳性表达率差异均无统计学意义(P>0.05)。FIGO Ⅲ-Ⅳ期患者的CN阳性表达率显著高于FIGO Ⅰ-Ⅱ期患者(P<0.05)。肌层浸润深度>1/2 患者的CN 阳性表达率显著高于肌层浸润深度<1/2的患者(P<0.05)。
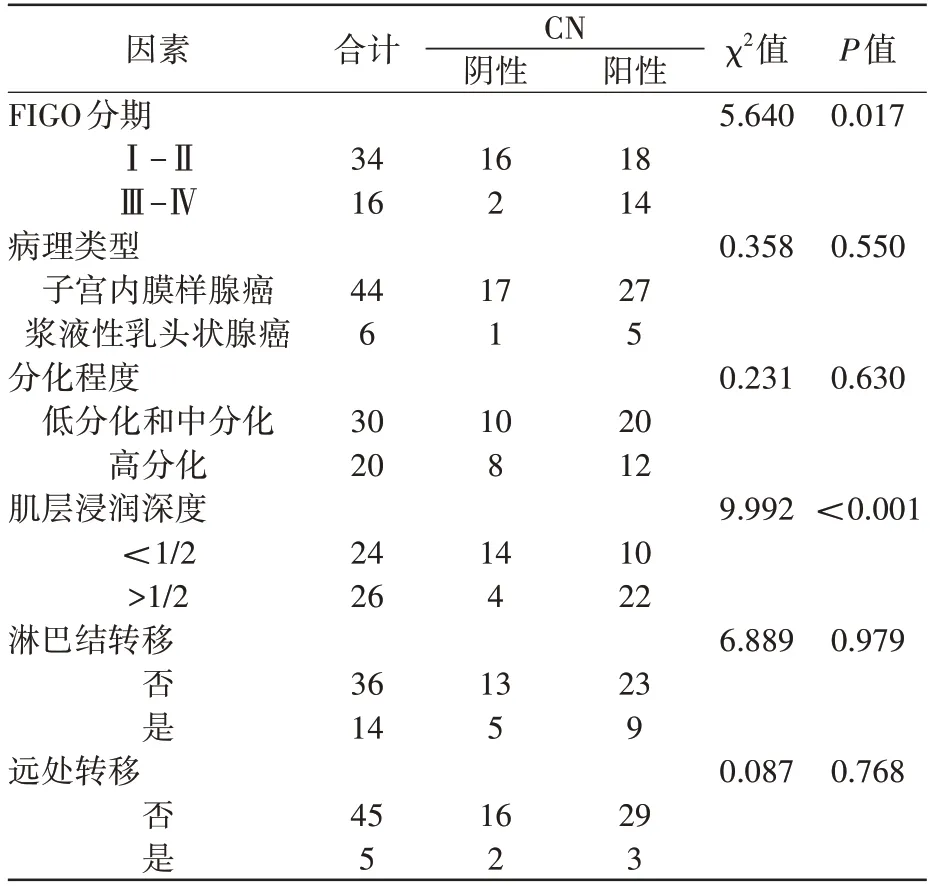
表2 子宫内膜癌患者中CN的表达
2.4 子宫内膜癌患者CN阳性的影响因素
以CN 是否阳性为因变量(赋值:否=0,是=1),以FIGO分期、肌层浸润深度为自变量,通过多因素Logistic 回归分析发现,患者FIGO 分期、肌层浸润深度是子宫内膜癌患者CN 阳性的独立影响因素(P<0.05),见表3。
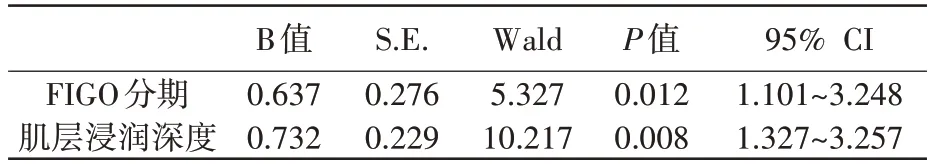
表3 子宫内膜癌患者CN阳性的多因素Logistic回归分析
2.5 CN的表达和子宫内膜癌患者预后的关系
KM 生存曲线(图2)显示,CN 阴性的子宫内膜癌患者平均生存时间为(73.86±1.89)个月,显著高于CN 阳性的子宫内膜癌患者(61.60±2.30)个月,Log Rank检验统计值为χ2=11.20(P<0.05)。
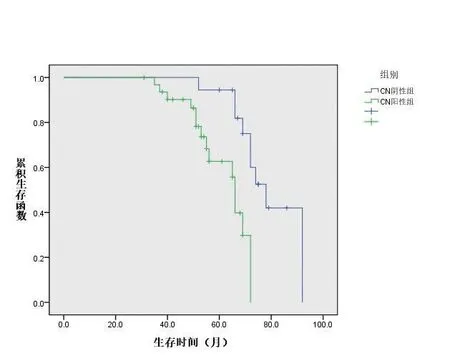
图2 子宫内膜癌患者的KM生存曲线
3 讨论
3.1 CN与子宫内膜癌
子宫内膜癌是女性常见的恶性肿瘤。已有研究逐渐探索子宫内膜癌的分子机制及其预后影响因素[5]。等级较高、晚期或非子宫内膜样组织学是高危子宫内膜癌的特点[6]。约15%~20%的子宫内膜癌患者存在高危疾病且预后较差[7]。尽管有新的抗肿瘤药物和更有效的联合治疗,据报道Ⅳ期子宫内膜癌患者的5年生存率约为17%[1,8],迫切需要研究潜在的分子标志物以改善子宫内膜癌患者的预后。
CN 是一种钙依赖性丝氨酸/苏氨酸磷酸酶,由2个亚基组成,钙调神经磷酸酶A(CNA)和钙调神经磷酸酶B(CNB),在免疫调节中发挥重要作用,如CN 抑制剂环孢素A 和他克莫司(FK506)作为免疫抑制剂在临床具有广阔的应用前景[9]。CN与钙调蛋白结合后被激活和随后的靶蛋白发生去磷酸化。此外,CN 底物还包括转录因子、参与细胞周期和凋亡的蛋白质、细胞骨架蛋白、膜通道和受体[10]。研究显示CN/NFAT 通路在乳腺癌中被激活,对乳腺癌细胞的存活和转移至关重要[11]。然而,CN在子宫内膜癌中的作用尚不清楚。
3.2 CN阳性表达与子宫内膜癌临床特征的关系
本研究表明,老年子宫内膜癌组织中CN的表达高于正常子宫内膜组织,提示CN在子宫内膜癌细胞中的表达上调,表明CN可能在肿瘤新生血管形成中发挥重要作用。本研究结果与其他研究结果一致,Eleni 等[12]研究显示钙调磷酸酶γ 催化亚基PPP3CC 通过miR-200c-3p 的调控影响上皮性卵巢癌细胞凋亡,这些结果表明CN与肿瘤的进展密切相关。
为了确定CN 表达在老年子宫内膜癌各种组织学亚型中的临床意义,本研究对患者的临床特征包括FIGO分期、病理类型、分化程度、肌层浸润深度、合并转移进行了单因素分析。结果显示,FIGO Ⅲ-Ⅳ期患者的CN 阳性表达率显著高于FIGO Ⅰ-Ⅱ期的患者(P<0.05)。肌层浸润深度>1/2患者的CN阳性表达率显著高于肌层浸润深度<1/2 的患者(P<0.05)。未发现CN 表达与其他临床或病理参数显著相关。多因素Logistic 回归分析结果显示FIGO分期、肌层浸润深度是子宫内膜癌患者CN阳性的独立影响因素。
3.3 CN与子宫内膜癌的预后
本研究采用KM 生存曲线分析CN 阳性表达对老年子宫内膜癌患者预后的影响,结果显示CN阴性的子宫内膜癌患者平均生存时间显著高于CN 阳性者。推测可能由于磷酸化是调节蛋白质功能的关键机制,CN 引起的蛋白质去磷酸化在肿瘤形成和进展中发挥重要作用,与肿瘤患者的预后密切相关[13]。
综上,老年子宫内膜癌组织中CN的表达与临床病理特征密切相关,包括FIGO分期和肌层浸润深度,检测CN的阳性表达对于评估老年子宫内膜癌的预后也具有临床价值。

