猪蓝耳病类NADC30 毒株的致病力及疫苗研究进展
◆作者:梁柏荣 伍思华 王俊杰 何景钱
◆单位:1.广东广垦畜牧集团股份有限公司;2.广东广垦畜牧工程研究院有限公司
猪蓝耳病又称猪繁殖与呼吸综合征(PRRS),是由猪蓝耳病病毒(PRRSV)引起的一种高接触性传染病,主要导致母猪流产、早产、产死胎、产木乃伊胎等繁殖障碍,以及仔猪和育肥猪的呼吸道症状。PRRSV NADC30 株是2008 年从美国爱荷华州一个发生呼吸道疾病的猪场的猪只中分离到的一种中等毒力的毒株(Brockmeier 等,2012),并随着2012 年我国河南省首次报道(C.Li 等,2016)后,近几年,国内陆续分离得到多株PRRSV NADC30-like (类NADC30)毒株,如JL580、CHsx1401、HNjz15、HNyc15、FJ1402、14LY01-FJ、HNhx 等(X.Li 等,2016;Liu 等,2017; Z. Sun 等,2016; L. Wang等,2018; Q. Zhang 等,2016; K.Zhao 等,2015a; Zhou 等,2015)。目前,PRRSV 类NADC30 毒株已广泛传播到中国至少18 个省市自治区,成为主要流行毒株之一(Y.Sun 等,2020)。在大量临床实践中,我们发现PRRSV 类NADC30 毒株使用商品化疫苗防控效果不佳,虽然病毒毒力不及高致病性蓝耳病病毒(HP-PRRSV),但母猪群小规模流产、育肥猪群呼吸道疾病等仍对猪场造成较高损失。因此,针对猪蓝耳病类NADC30 毒株致病力及免疫方面的研究尤为重要。
1 类NADC30 毒株的致病力研究
PRRSV NADC30 株是一种中等毒力的毒株,但由于高重组的特性,PRRSV 类NADC30 株田间病征从中低毒力到中高毒力不等。众多攻毒实验结果提示PRRSV 类NADC30 毒株毒力不如高致病性蓝耳毒株,但不同研究对于其毒力强度并不完全一致, 这可能是由于PRRSV NADC30 毒株在流行期间与本地野毒毒株、疫苗毒株重组后(Liu, Lai, 等,2022; Y. Sun 等,2020; H. Zhang 等,2019; Z.Zhang 等,2018, 2020; K. Zhao等,2015b),变异的类NADC30毒株结合本地毒株的部分基因出现的返强(Liu 等,2017;H.-M.Wang 等,2018; K. Zhao 等,2015b)或致弱。通过公开发表文献记录,将目前为止的攻毒实验关于致病力与基因进化方面内容进行整理,见表1。
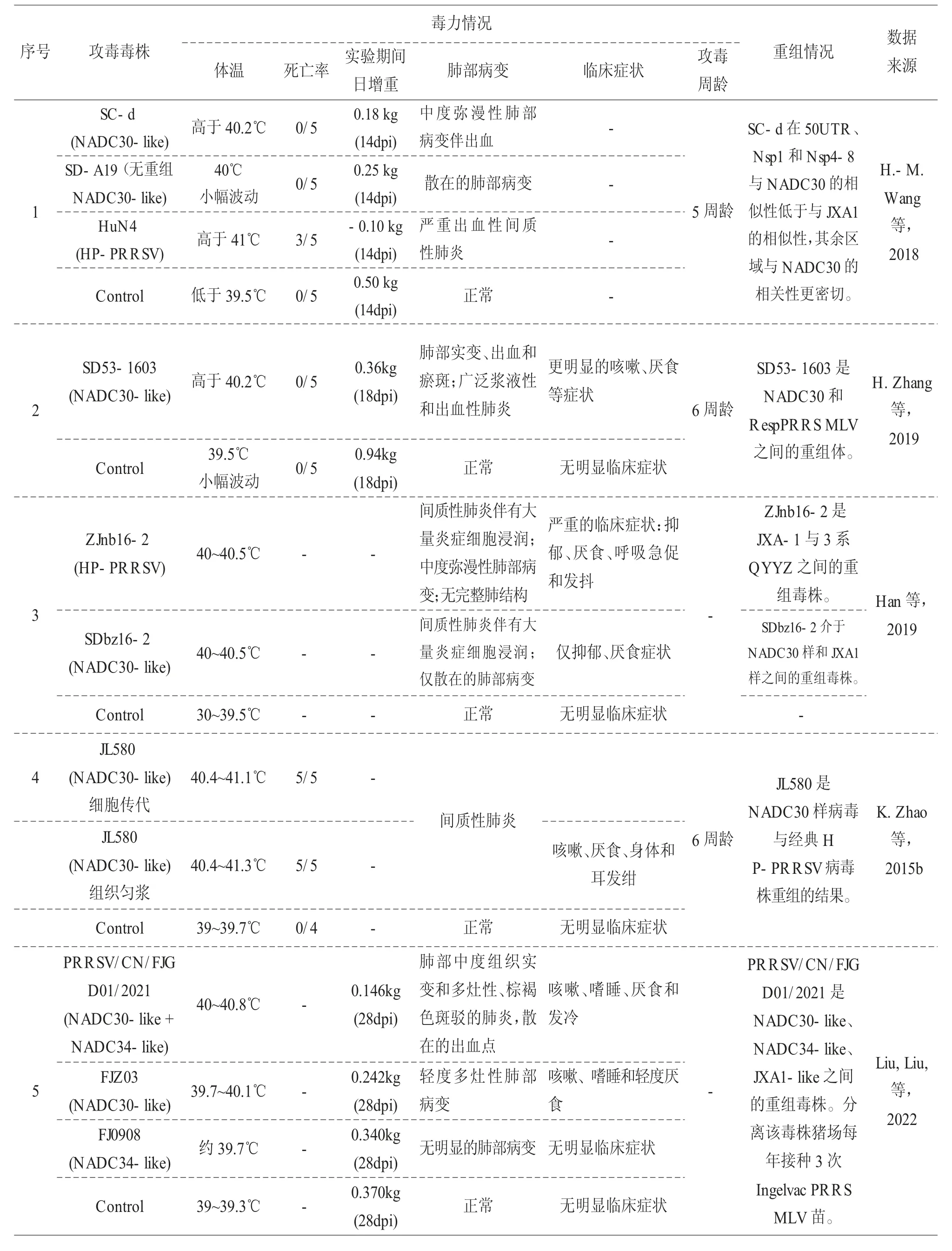
表1 PRRSV 类NADC30 毒株致病力相关攻毒实验
2 商品疫苗对类NADC30毒株保护力研究进展
疫苗接种是蓝耳病防控的基本和重要策略,PRRSV 改良活疫苗已被证实是预防保育猪和肥育猪经典蓝耳病及高致病性蓝耳病的有效措施(Allende等,2000)。但由于目前我国尚未上市针对PRRSV 类NADC30 毒株的商品化疫苗,市售疫苗缺乏足够的交叉保护(Chae, 2021;Díaz 等,2012),因此免疫防控PRRSV 类NADC30 毒株的效果并不理想。
但国内外陆续有开展商品化蓝耳疫苗对类NADC30 毒株的保护力研究,参考实验结果数据,即便同一商品疫苗在对从不同地区分离的 PRRSV 类NADC30 毒株在保护力上也存在差异。关于公开发表的市售蓝耳疫苗对类NADC30 毒株的保护力研究汇总于表2。

表2 市售蓝耳疫苗对类NADC30 毒株的攻毒保护实验

表2 市售蓝耳疫苗对类NADC30 毒株的攻毒保护实验(续)
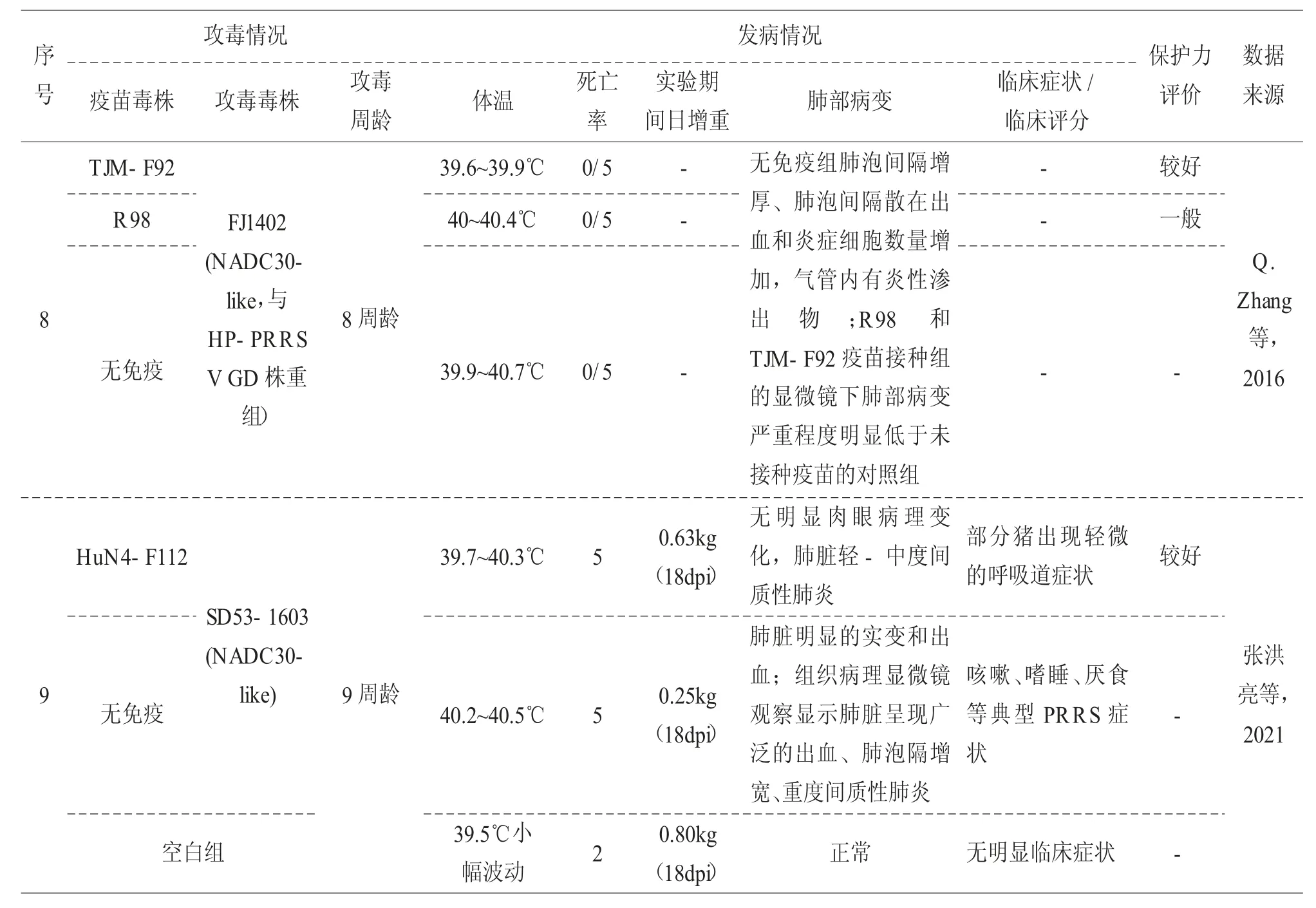
表2 市售蓝耳疫苗对类NADC30 毒株的攻毒保护实验(续)
3 类NADC30 毒株特异性疫苗研发进展
3.1 灭活疫苗
灭活疫苗具有运输储存方便和生物安全风险较低的特点。郭宝清等(1996) 利用PRRSV CH-1a 株制成油乳剂灭活苗,进一步使用该灭活苗对3 月龄的仔猪进行免疫,证明CH-1a 株疫苗可产生较长时间的保护,免疫效果较理想(郭宝清等,2000);但也有研究表明灭活疫苗不能有效保护仔猪(Nilubol 等,2004)。目前国内田间蓝耳灭活苗的免疫常搭配活毒使用,多为首免使用减毒活苗,二免起使用灭活苗;或在蓝耳爆发场或阳性不稳定场通过直接免疫灭活苗达到控制疫情的作用。灭活苗抗原含量高,通过搭配活毒的方式可有效调动机体免疫记忆效应,实现较好的防控效果。
李福泉等(2021)以PRRSV类NADC30 毒株(SY 株)为基础,选取ISA201VG 和ISA70VG两种佐剂分别制备灭活疫苗对比免疫效果,进行二免后的攻毒保护实验表明,ISA201VG 佐剂制得灭活苗效果相对较好,但实验中PRRSV 类NADC30 毒株(SY 株)导致严重抗体依赖增强效应,无法获得理想的免疫保护效果。
Choi 等(2022)利用反向遗传操作获得一株含野毒(KU-PRRSV-2020002株 ,PRRSV-2 型谱系1)GP5 基因的低糖基化嵌合病毒 vCSL1-GP5-N33D 毒株,并将其制备成为灭活疫苗用于免疫蓝耳阳性猪场, 实验表明vCSL1-GP5-N33D 疫苗免疫组的中和抗体是未免疫组的2 倍,实现了≥3(log2)的平均中和抗体滴度,60%的猪的抗体滴度≥5(log2)。
3.2 改良活疫苗
虽然蓝耳弱毒疫苗对遗传差异较大的异源毒株所产生的保护能力有限 (Labarque 等,2003,2004),同时有潜在散毒隐患,但其产生的同源免疫效果好,具备诱导机体产生较灭活苗更强的免疫力如免疫保护期较长、同时诱导细胞免疫和体液免疫等优点。因此,弱毒活疫苗仍是目前预防PRRS 最常用的疫苗。
H. Zhang 等 (2022) 将PRRSV 类NADC30 毒株(SD株)连续传代125 代,获得减毒毒株SD-R 制备成疫苗。攻毒保护实验表明,接种SD-R 株疫苗的仔猪与攻毒对照组相比,病毒复制水平明显更低、体重显著增多、病理损伤也更轻。
Cao 等(2022)将PRRSV 类NADC30 毒株(ZJqz21 株)的全基因组分段进行反转录,并通过引入酶切位点的连接得到包含完整PRRSV 基因的cDNA 序列,最后利用反向遗传手段获得拯救病毒PRRSV ZJqz 株。通过攻毒实验表明,拯救病毒ZJqz株与亲本病毒ZJqz21 株具有相似的致病性,为进一步研究类NADC30 毒株的致病机制和开发改良活病毒疫苗奠定了基础。
N.Chen 等(2021)基于30种具有代表性的中国PRRSV 分离株设计并合成了编码所有包膜蛋白的PRRSV2 型ORF2-6基因(ORF2-6-CON)的共有序列,并嵌合入无致病力的HP-PRRSV JSTZ1712-12 株骨架 , 获 得 嵌 合 毒 株rJS-ORF2-6-CON 株。攻毒保护试验表明,rJS-ORF2-6-CON 株对仔猪不致病, 与商业HP-PRRS 改良活病毒(MLV)疫苗相比,rJS-ORF2-6-CON 对PRRSV 类NADC30 强毒毒株具有更好的交叉保护作用。
J.Li 等(2022)在N.Chen 等(2021) 研究的基础上,将ORF2-4 和ORF5-6 基因分别嵌入无致病力的 HP-PRRSV JSTZ1712-12 株骨架并通过反向遗传得到重组毒株,攻毒保护试验表明两株分别嵌入ORF2-4基因和ORF5-6 基因的拯救毒株能诱导异源nAb,但仅提供有限的交叉免疫,保护力不如之前研究中涵盖ORF2-6 基因的重组毒株(rJS-ORF2-6-CON)。
3.3 重组疫苗
目前蓝耳病的防控很大程度上依赖于减毒疫苗或灭活疫苗的免疫(Nan 等,2017)。除经典的减毒活苗、灭活苗的研制外,针对PRRSV 类NADC30 毒株的各种新型疫苗也取得了显著的进展。
Cui 等(2019)利用PRRSV GP5 序列构建了阳离子脂质体DNA 镶嵌疫苗GP5-Mosaic,免疫实验数据表明GP5-Mosaic 疫苗可诱导产生包含PRRSV NADC30 毒株在内的多种毒株的交叉反应性细胞反应和中和抗体。
L. Li 等(2022)通过反向遗传技术在 HP-PRRSVHuN4-F112 株为骨架加入经典猪瘟病毒(CSV)E2 蛋白的基因序列获得rPRRSV-E2 株,在已证实rPRRSV-E2 对 HP-PRRSV 和CSV 均有充足保护力的基础上(Gao 等,2018),将其免疫仔猪后使用PRRSV 类NADC30 毒株(ZJqz21 株)进行攻毒实验,实验结果表明rPRRSV-E2 株可大幅减少仔猪的临床症状并减少了病毒复制和排毒量。
J. Zhao 等(2022)以猪伪狂犬病毒(PRV)XJ 株为基础,敲除gE/gI/TK 后加入 PRRSV 类NADC30 毒株(CHSCDJY-2019株)的GP5 蛋白序列和M 蛋白序列,通过反向遗传技术获得rPRV-NC56 重组病毒。利用引入的2A 自切肽,rPRV-NC56 病毒在复制过程中可将源自PRSSV的GP5 蛋白和M 蛋白分离并最终组装形成PRRSV 病毒样颗粒。通过小鼠的攻毒保护实验,rPRV-NC56 除可提供对PRV 充足的保护力外,还可产生对PRRSV 类NADC30 毒株SCNJ-2016 株≥2(log2)的中和抗体滴度、对PRRSV 类NADC30毒株SCNJ-2019 株≥3(log2)的中和抗体滴度。
4 小结与展望
各地分离得到的PRRSV 类NADC30 毒株在毒力上表现出中低毒力至中高毒力不等,可能与该PRRSV 类NADC30 毒株的遗传背景有关。在类NADC30 毒株高重组特性的基础上,田间使用HP-PRRSV 的减毒疫苗成为类NADC30 毒株重组强毒力基因的来源。 这体现在与HP-PRRSV 有基因交流的类NADC30 毒株均表现出更强的致病力 (Han 等,2019; Liu, 等,2022; Liu 等,2017; H.-M. Wang等,2018; X. Wang 等,2022;Q.Zhang 等,2016; K. Zhao 等,2015b)。这为国内流行逐渐扩大的PRRSV 类NADC30 毒株、类NADC34 毒株在疫苗防控上提出了新的挑战。
迄今为止,尽管有各种商业疫苗可用,但有效控制PRRSV感染仍然是全球养猪业面临的难题。在控制PRRSV 感染的措施中,弱毒活疫苗因其对同源病毒的保护效果而被许多国家普遍接受(Charerntantanakul, 2012;Zuckermann 等,2007)。参考本文整理关于类NADC30 毒株市售疫苗攻毒保护实验数据,绝大多数市售疫苗对类NADC30 毒株虽有一定程度的保护,但仍无法提供令人满意的保护效果。这与PRRSV 异源毒株保护力差异较大(Chae, 2021;Díaz 等,2012;Labarque 等,2003, 2004),而市售疫苗缺乏足够的交叉保护有关。值得关注的是,部分研究表明 HP-PRRSV 减毒疫苗如TJM-F92 株、HuN4-F112 株针对部分PRRSV 类NADC30 毒株表现出了相对较好的保护力(张洪亮等,2021;H.Zhang 等,2018;Q.Zhang 等,2016),这是攻毒毒株遗传背景的原因还是疫苗毒株异源保护力的原因仍需进行更深入研究。在尚无商品化PRRSV类NADC30 株疫苗可选用的背景下,利用商品疫苗主动重组驯化本地/ 本场类NADC30 株以提高商品苗与流行株间的同源性似乎是一种选择,但其安全性与可行性仍需进一步研究。
针对PRRSV 类NADC30 毒株开发的疫苗显然是控制类NADC30 毒株流行的有效手段。活病毒疫苗具有同源免疫效果好,具备诱导机体产生较灭活苗更强的免疫力如免疫保护期较长、同时诱导细胞免疫和体液免疫等优点,是目前PRRSV 类NADC30 毒株疫苗研发的趋势。同时,除了传统的传代致弱手段获取减毒毒株 (H. Zhang 等,2022)外,大部分研究利用了反向遗传技术对PRRSV 进行编辑获取改良毒株或加入外源基因获得多价或多联疫苗(Cao 等,2022;N.Chen 等,2021;J. Li 等,2022;L.Li 等,2022)。随着分子生物学技术的发展,PRRSV 类NADC30 毒株相关的DNA 疫苗(Cui 等,2019)、伪狂犬载体重组疫苗(J.Zhao 等,2022)等研究也陆续出现,包括PRRSV 病毒拯救手段在内的各种新型疫苗研究在2020 年后有了大量增加的趋势。
尽管各类研究逐渐丰富,但目前而言,如何针对流行PRRSV类NADC30 毒株进行有效防控仍是一项难题。国内已有养殖集团采用市售疫苗或特定流行毒株对集团内所有猪场进行PRRSV 主动感染,将场内流行的PRRSV 通过疫苗或血清驯化为单一的、特定的、可控的毒株再进行免疫防控或净化(曹玉美等,2016;孙龙等,2017;伍少钦等,2018)。此外,国内大集团针对PRRSV 类NADC30 毒株、类NADC34 毒株较成功的防控方案多为使用商品化减毒疫苗进行首免后,再委托疫苗厂家针对本集团内部流行毒株生产定制灭活苗用于常规免疫。该方案同源免疫保护最佳,但由于定制疫苗生产成本高昂,并非国内大多养殖公司、猪场可参照使用。基于流行的多种 PRRSV 类NADC30 毒株均已与本地流行毒株发生重组,有条件的猪场根据本场毒株测序并分析基因进化情况,可针对毒株遗传来源选取同源性相对接近的商品疫苗以提高保护力,可能是目前尚无PRRSV NADC30 株疫苗的情况下较好的选择。

