超声引导下射频消融治疗甲状腺微小乳头状癌术后吸收率的影响因素分析
贾筱夏 常 莹 侯文颖 符 颖 张会单 杨敬春
(首都医科大学宣武医院超声诊断科, 北京 100053)
在过去的40年中,甲状腺肿瘤的主流治疗方式由甲状腺全切除术,辅以放射性碘治疗和甲状腺激素抑制治疗的模式[1]逐渐转变为对低风险乳头状甲状腺癌患者进行主动监测或选择甲状腺部分切除术[2-4]。近年来,超声引导下射频消融(radiofrequency ablation,RFA)作为一种能够破坏甲状腺结节而无需进行甲状腺手术的更简单的治疗方案受到越来越多的关注,在治疗甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)方面的有效性和安全性也被多项研究[5-9]证实。RFA的基本原理是在超声引导下通过射频针引入高频交流电引起组织坏死和纤维化,最终发生凝血坏死,病变组织周围的中性粒细胞释放水解酶,使坏死组织细胞溶解液化,被巨噬细胞、淋巴细胞等包裹吞噬,最后被机体吸收[7],与传统治疗方式相比,RFA治疗PTMC的主要优势是总体并发症的发生率较低[10]以及甲状腺激素替代治疗的需求很小[11]。RFA治疗已被证明是低复发风险且不适合或拒绝手术治疗的PTMC患者的安全有效的治疗方法,具有出色的长期效果[1, 12-13]。然而,关于RFA治疗甲状腺结节的疗效及影响因素的研究通常以体积减小百分率(volume reduction ratio,VRR)≥50%作为治疗有效的标准,缺乏对结节整体吸收率的评估和长期随访[14-16]。本研究对患者进行了18个月的长期随访,以结节达到100% VRR作为观测终点,对结节吸收率相关影响因素进行了系统的研究,明确了RFA治疗PTMC的长期有效性以及RFA术后吸收率的相关影响因素,为PTMC患者接受RFA治疗的风险评估提供了依据。
1 对象与方法
1.1 研究对象
2020年12月至2022年3月期间在首都医科大学宣武医院接受RFA治疗甲状腺结节的患者符合以下条件者。纳入本研究的四个标准包括基于细针抽吸细胞学(fine needle aspiration, FNA)确认结节的性质(2017版FNA Bethesda报告系统)、结节的最大直径小于1 cm、没有甲状腺手术治疗史及术前化学药物治疗或放射治疗史、没有远处转移的证据。本研究获得首都医科大学宣武医院机构评审委员会的批准(文件批号:[2020]055)。获得所有患者的书面知情同意。
1.2 RFA术前评估
RFA手术治疗前,所有受试者均接受二维超声、彩色多普勒超声、超声造影(contrast-enhanced ultrasound, CEUS)检查,以及实验室检查、FNA细胞学和临床检查,并进行评估。二维超声、CEUS和FNA均使用Philip超声诊断仪(U-Elite, Philips公司,荷兰)和L12-5线性阵列换能器。在 RFA之前即使用US评估结节位置和超声征象(边缘、形状、囊性成分、回声、钙化、血管形成)和3个正交直径(最大上下直径、最大左右直径和最大前后直径)。使用以下等式计算结节体积:V=abcπ/6(V:体积,a:最大上下直径,b 和 c:其他垂直直径)。实验室检查包括甲状腺功能测试(游离三碘甲状腺原氨酸、游离甲状腺素、三碘甲状腺原氨酸、甲状腺素和促甲状腺激素)、全血细胞计数、凝血试验(凝血酶原时间、活化的部分凝血活酶时间)、乙肝五项(乙肝表面抗原、乙肝表面抗体、乙肝e抗原、乙肝e抗体、乙肝核心抗体)、感染三项(丙肝抗体、艾滋病抗体和梅毒抗体)和降钙素。桥本甲状腺炎的诊断基于甲状腺抗原(甲状腺过氧化物酶和甲状腺球蛋白)血清抗体阳性。结节体积、RFA的时间和功率以中位数分组。
1.3 RFA程序
RFA由同一位经验丰富的医师在实时超声的引导下完成,在消融过程中使用迈德S-1500射频治疗仪和18G内部冷却单极射频针(均购自美国迈德医疗公司)。超声造影剂为六氟化硫(SonoVueR, Bracco公司, 意大利),5 mL 0.9%(质量分数)氯化钠注射液(以下简称生理盐水)稀释,经肘正中静脉团注2.4 mL。患者在心电监护下取仰卧颈部后屈过伸位,常规消毒、铺洞巾,超声引导下用2%(质量分数)利多卡因局部麻醉皮肤穿刺点至甲状腺包膜。以2%的(质量分数)利多卡因生理盐水等比例混合液形成“液体隔离带”,保护周围组织。应用经峡部穿刺入路法,电极针通过峡部刺入一侧甲状腺的目标结节内,通过移动治疗技术由深至浅进行消融,直至结节完全被热消融产生的强回声所覆盖。消融后,每位患者根据RFA治疗情况在医院观察 1~2 h。
1.4 RFA术后评估
在行RFA治疗后,所有患者术后第1、3、6、9、12、18个月进行返院随访,使用2D-US和CEUS复查甲状腺彩超及甲状腺功能检查。仪器采用Philips超声诊断仪和L12-5线性阵列换能器,造影剂采用SonoVue,配置时以5 mL生理盐水溶解并振荡摇匀,每次经肘静脉团注2.4 mL造影剂混悬液,而后推注5 mL生理盐水。随访观察结节大小、体积及血供的变化情况、评价结节相关症状的改善、注意有无并发症出现等。彩超复查结节大小、血供情况、是否残留存活部分结节。并对症状及体征改善情况进行评分。结节体积缩小通过VRR进行评估:VRR=(治疗前体积-随访时体积)/治疗前体积×100%。
1.5 统计学方法
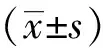
2 结果
2.1 RFA随访结果
对56例PTMC患者,共64个结节进行了随访评估,所有患者在RFA后18个月内达到100%VRR(其中1例比较典型的患者病灶射频消融治疗前和治疗后即刻以及1个月和3个月的造影图像对比治疗效果图详见图 1),患者的平均年龄为(43.98±11.94)岁,术后12个月结节平均体积从(1.96±1.29) mL下降至(0.01±0.03) mL,术后18个月所有结节完全消失,结节体积呈明显缩小趋势(P<0.001),详见表1。术后1、3、6、12、18个月随访时结节的平均VRR为61.43%±18.88%、87.86%±12.51%、96.62%±6.86%、99.70%±1.09%、100%。随访期间,没有患者出现复发或转移。
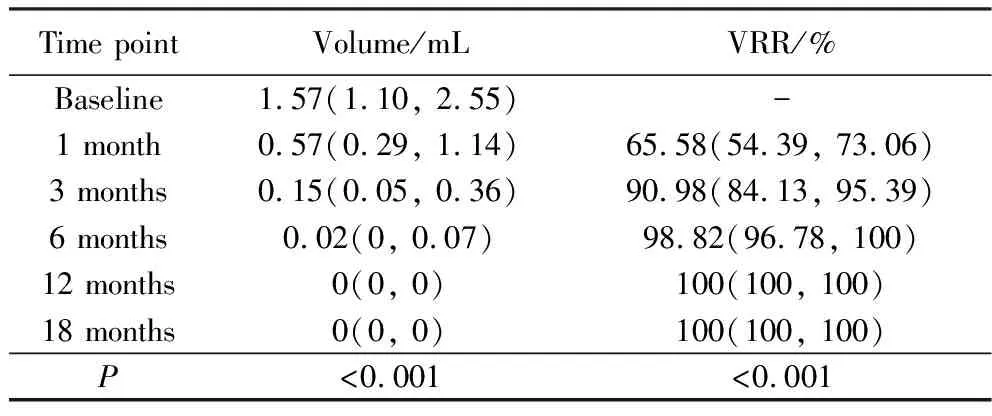
表1 RFA后结节随访期间体积的变化Tab.1 Change in nodule volume after RFA and at each follow-up M(P25, P75)
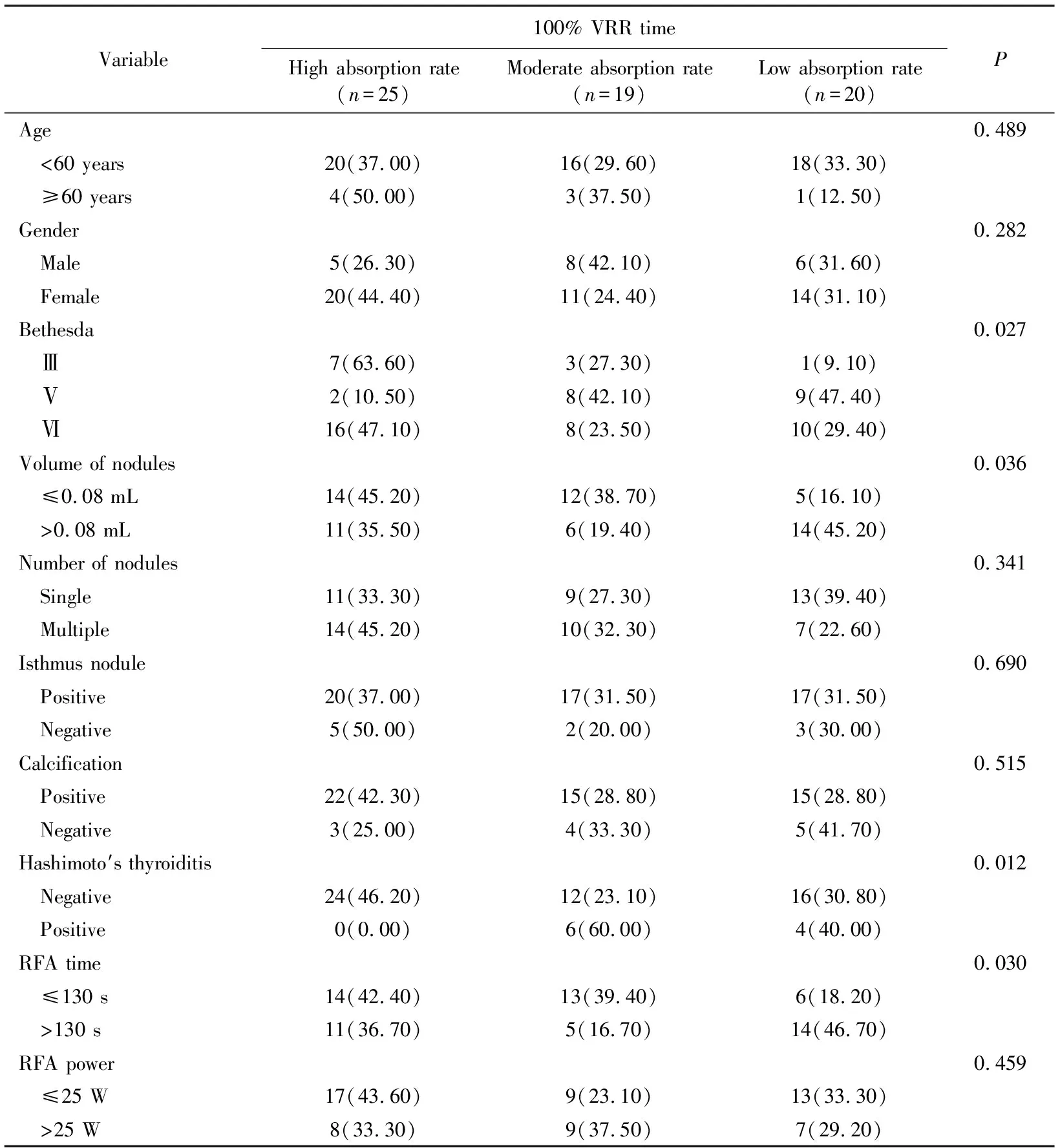
表2 RFA治疗PTMC术后吸收率的单因素分析 Tab.2 Univariate correlation factor analysis for absorption rate of RFA in PTMC n(%)
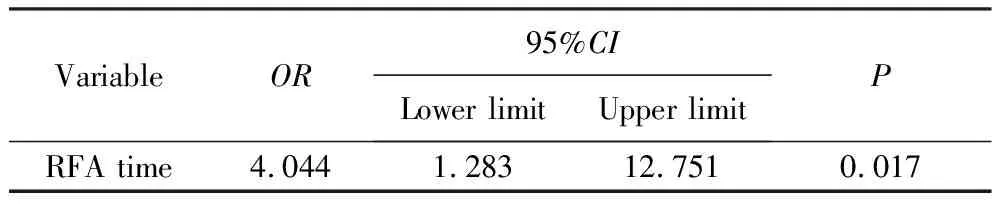
表3 RFA治疗PTMC术后吸收率的Logistic分析Tab.3 Logistic analysis for absorption rate of RFA in PTMC

图1 RFA治疗1例59岁的男性患者的甲状腺左叶实性结节Fig.1 Radiofrequency ablation treatment of solid nodule in the left thyroid of a 59-year-old man
2.2 影响吸收率相关因素分析
为了对患者吸收率的相关影响因素进行分析(表 2),根据患者RFA术后结节达到100% VRR的时间进行分组,结节达到100% VRR的时间小于3个月的患者被认为是高吸收率组,结节达到100%VRR的时间大于12个月的患者被认为是低吸收率组,其他患者则被认为是中等吸收率组。
不同病理类型PTMC的吸收率分析显示,Bethesda Ⅲ(细胞非典型病变)结节RFA术后出现高吸收率的比例明显高于Bethesda Ⅴ(疑似恶性肿瘤)和Ⅵ(恶性)结节(63.6%vs10.5%vs47.1%,P=0.027),低吸收率比例则明显低于Bethesda Ⅴ(疑似恶性)和Ⅵ(恶性)结节(9.1%vs47.4%vs29.4%,P=0.027)。与对照组相比,RFA前结节体积小于0.08 mL的PTMC患者,吸收率低的患者较少(16.1%vs45.2%,P=0.036),吸收率高的患者较多(45.2%vs35.5%,P=0.036)。桥本甲状腺炎患者中PTMC患者吸收率高的比例明显低于对照组(0%vs46.2%,P=0.012)。此外,RFA持续时间也与PTMC患者的吸收率有关,当RFA时间大于130 s时,低吸收率比例显著增加(46.7%vs18.2%,P=0.03),而RFA时间小于130 s与高吸收率相关(42.4%vs36.7%,P=0.03)。
根据甲状腺结节RFA术后的病灶吸收情况对患者吸收率相关的危险因素进行分析(表 3),结节达到100%VRR时间大于12个月的患者被认为是吸收不良,将单因素分析中具有统计学意义的结节体积、RFA时长、Bethesda分级和桥本甲状腺炎纳入二元Logistic回归,结果显示RFA时长是甲状腺结节RFA术后吸收率的独立影响因素。
3 讨论
使用超声引导RFA治疗良性和恶性甲状腺疾病越来越受到关注。RFA可以作为甲状腺良性结节的首选治疗方法,也可用于治疗拒绝二次手术或高手术风险的复发性甲状腺癌患者[17-20]。然而,关于RFA治疗PTMC的术后吸收率的影响因素缺乏长期随访和系统评估,本研究以结节达到100% VRR的时间作为分组依据,对结节吸收率相关的超声和病理特征进行了系统的研究,结果证实PTMC患者的结节体积、RFA时长、Bethesda分级以及是否患有桥本甲状腺炎影响RFA术后的吸收率,为RFA治疗甲状腺结节的吸收率评估提供了简单、有效的新标志物。
本研究结果对不同Bethesda Ⅲ/Ⅴ/Ⅵ结节的RFA术后吸收率进行了对比分析。目前多项研究[21-24]证实Bethesda Ⅴ与Bethesda Ⅵ结节的预后和基因特征接近一致,本研究也显示 Bethesda Ⅴ级结节的术后吸收情况与Bethesda Ⅵ结节相近,不同的是,本研究结果中,与Bethesda Ⅵ级结节相比,Bethesda Ⅴ级结节表现出更高比例的术后吸收不良,可能与样本量相对较小有关。Bethesda Ⅲ结节患者由于病理结果的不确定性,在治疗选择上面临很大困难[25],这进一步导致缺乏关于RFA在这些患者中的安全性和有效性的研究报告。一项研究[26]显示RFA成功治疗了6名患者的Bethesda Ⅲ/Ⅳ 结节,其中2例为甲状腺切除术后复发结节,结果显示,没有患者出现出血或粘连等并发症。另一项样本量为 178 名患者的研究[27]显示,良性(Bethesda Ⅱ)和不确定(Bethesda Ⅲ/Ⅳ)队列具有相似的甲状腺结节VRR和结节再生率。本研究结果显示,Bethesda Ⅲ 结节经 RFA 治疗后获得高吸收率的患者数量高于 Bethesda Ⅴ/Ⅵ 结节。提示RFA不仅是Bethesda Ⅲ结节患者安全有效的治疗方式,与Bethesda Ⅴ/Ⅵ 结节相比,Bethesda Ⅲ结节患者经RFA治疗后可以获得更大的获益,为Bethesda Ⅲ结节的临床治疗方案的选择提供了依据。
桥本甲状腺炎的主要特征是淋巴细胞浸润、纤维化和甲状腺实质萎缩[28],与甲状腺肿瘤关系密切,大约1/3的甲状腺肿瘤病例伴有桥本甲状腺炎[29-30],可能与桥本甲状腺炎患者的组织学和血供特征以及特殊的免疫微环境相关[31-32]。本研究结果显示,桥本甲状腺炎患者在前3个月的吸收率明显低于对照组,但是在接下来的随访过程中吸收率与对照组逐渐接近。有关文献[33-34]显示桥本甲状腺炎患者接受RFA的治疗效果和安全性与其他患者差异无统计学意义。也有研究[35]显示,RFA术后一周时,伴有桥本甲状腺炎的PTMC患者结节体积小于其他PTMC患者,认为桥本甲状腺炎时甲状腺供血的增加可能加速炎症和水肿的吸收。这些研究的结果的不同可能与桥本甲状腺炎的纤维化程度不同有关,样本量和不同人群的选择也影响了RFA疗效的评估。桥本甲状腺炎的RFA术后吸收率的关系需要进一步研究,细化患者的疾病进展程度和免疫特征可能有助于结果的完善。
对多发结节和单发结节患者的吸收率进行了分析,结果显示多发结节患者出现吸收不良的比例略低于单发结节患者(22.6%vs39.4%),出现这种差异的原因可能是多发结节的平均体积更小,两者之间的差异没有统计学意义。同一个患者的多个结节之间的吸收率可能存在相互影响,完善统计模型有助于获得更加准确的结果。
这项研究存在一些局限性。首先,这是一项回顾性研究,相关结果需要随机对照试验的进一步验证。其次,本研究为单中心研究,所有RFA治疗由同一名经验丰富的操作者完成,这可能导致选择偏倚。最后,由于随访数据不完整,最初入组的患者中仅有35%被纳入分析,其中8例患者为多发结节,结节的吸收率可能存在内部相关性。在未来的工作中将通过增加随机对照试验和采用更加复杂的统计模型解决上述问题。尽管存在这些局限性,本研究系统分析RFA治疗后甲状腺结节吸收率的相关影响因素,此项研究可能有助于理解结节的超声和病理特征与RFA术后吸收率的关系,为RFA治疗甲状腺结节的术后吸收情况评估提供新的标志物。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明贾筱夏:提出研究思路,设计研究方案,分析数据,撰写论文;常莹、侯文颖、符颖、张会单:采集、分析数据;杨敬春:总体把关,审定论文。

