超微血流成像和彩色多谱勒血流显像在乳腺BI-RADS 4类微小结节中的临床应用
于腾飞 殷 露 田道然,3 宋海曼 尹子毅 张 巍 何 文*
(1.首都医科大学附属北京天坛医院超声科, 北京 100070;2.首都医科大学附属北京天坛医院乳腺外科,北京 100070;3.北京市大兴区人民医院超声科, 北京 102600)
肿瘤间质微血管的生成对肿瘤生长、转移起到非常重要的作用,已有研究[1-2]报道,彩色多普勒超声联合二维灰阶超声可提高乳腺癌病变的诊断率。常规超声筛查的主要局限性是阳性预测值低,存在大量假阳性结果,导致不必要的活检或短期随访[3]。近些年兴起的超微血管成像(superb microvascular imaging,SMI)技术通过识别血流和组织运动产生的噪声,采用自适应的计算方法来显示真实的血流信息,该技术具有显示极低速血流信息、更高的空间分辨率、极少的运动伪像及高帧频成像等优势,理论上较传统彩色多普勒血流显像(color Doppler flow imaging, CDFI)更易检测出低速微小血流,并且无须造影剂。乳腺微小癌为癌灶直径≤1 cm的乳腺癌[4],因其症状不典型、体积小,成为临床诊断的难点。本研究探讨单独应用CDFI、联合应用CDFI和SMI(CDFI+SMI)两种方式在乳腺影像学报告和数据系统(breast imaging reporting and data system,BI-RADS)分级为4类的微小结节中血流检出的差异,并与超声造影(contrast-enhanced ultrasound, CEUS)结果进行对照分析,评价3种方法在乳腺微小结节良恶性诊断中的应用价值。
1 对象与方法
1.1 研究对象
前瞻性纳入2019年1月至2023年3月首都医科大学附属北京天坛医院的215例诊断为BI-RADS 4类乳腺微小结节患者。患者均为女性。纳入标准: ①患者年龄≥18周岁;②超声图像采用二维(two dimensional,2D)、CDFI、SMI及CEUS记录;③结节最大直径≤1 cm;④由5年以上临床经验的超声主治医师判读报告为BI-RADS 4类结节;⑤病理诊断明确。排除标准: ①伴发乳腺异物,如隆胸材料等;②妊娠期或哺乳期妇女;③已接受化学治疗或放射性治疗;④图像模糊、颜色溢出等。其中50例患者因合并其他疾病,抗病毒治疗,组织学、血清学及/或2D和彩色多普勒血流模式成像扫描结果不合格而被排除。最终纳入165例乳腺BI-RADS 4类微小结节进行分析。所有患者均在我院行乳腺肿块穿刺活检或者外科手术且有明确的病理结果。本研究经首都医科大学附属北京天坛医院伦理委员会审批通过(伦理审批号为:KY2022-033-02),患者均签署知情同意书。
1.2 仪器与方法
1.2.1 仪器
采用日本东芝(Toshiba)Aplio 500、 Aplio i900型号2种彩色超声诊断仪,所用探头型号为M12L。病例图像只选用有结节的图像,且结节形态边界可识别。
1.2.2 检查方法
患者仰卧位,充分暴露两侧乳房及腋窝,先使用二维阵列超声波探头进行2D扫描,再进行CDFI、SMI检查:调节取样框大小使其包含结节及其周边1 cm的范围,调节彩色增益至恰好抑制噪声为宜,观察肿块周围或内部有无明显的血流迹象。由5年以上临床经验的超声主治医师报告为BI-RADS 4类的患者,建议进一步行CEUS检查,并签署知情同意书。超声造影检查机械指数为0.06,调节增益使图像清晰,经肘静脉快速团注4.8 mL超声造影剂声诺维(Sono Vue)混悬液,随后推注5 mL 0.9%(质量分数)氯化钠注射液冲管,在病灶最大切面及血供丰富切面观察动态灌注过程,之后动态扫查。在1周内进行穿刺活检或者择期行外科手术,乳腺活检采用16 g或18 g穿刺针(巴德马格纳姆,GA公司,美国)。所有活检标本均由病理学医生检查。所有病理学医生均有6年以上工作经验。如病理报告存在多种诊断结果的结合,以较严重的诊断结果为准。
1.2.3 Adler分级
以Adler分级[5]定量评价结节内血流。0级:肿块内未发现血流信号;I级,少量血流,1至2个点状或细短棒状血流血管;Ⅱ级,中等量血流,3至4个点状或1支较长血管,长度接近或超过肿块半径;Ⅲ级,较多血流,5个以上点状或2支以上较长血管。
1.2.4 CEUS观察结节灌注
主要观察以下9个特征,包括:造影剂的增强强度(低增强、等增强、高增强)、增强顺序(向心、非向心)、造影前后病灶范围变化(难以区分、缩小、不变、扩大)、增强的均匀性(均匀、不均匀)、灌注缺损区(有、无)、增强后的形态情况(规则、不规则)、增强后的边界情况(清晰、不清晰)、增强后蟹足征(有、无)及穿支血管征(有、无)。
1.3 统计学方法
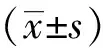
以病理结果为金标准,计算CDFI、CFDI+SMI、CEUS的诊断效能(灵敏度、特异度、阳性预测值、阴性预测值、准确率),绘制ROC曲线,获得曲线下面积(area under the curve, AUC)。
2 结果
2.1 良、恶性乳腺结节患者一般资料及病理类型分布
165例结节中病理诊断为良性组有125例(75.8%),年龄21~86[38.00(30.25,52.00)])岁,结节最大径0.31~1.00 [0.81(0.66,0.98)]cm;病理恶性组40例(24.2%),年龄38~78(54.33±11.31)岁,结节最大径 0.42~1.00[0.88(0.72,0.88)]cm。恶性结节患者平均患病年龄大于良性结节患者;良、恶性组患者的结节最大径差异无统计学意义(表1)。165例病灶的病理类型分布见表2。
表1 良、恶性乳腺结节患者一般资料比较Tab.1 Comparison of general data of patients with benign and malignant breast nodules
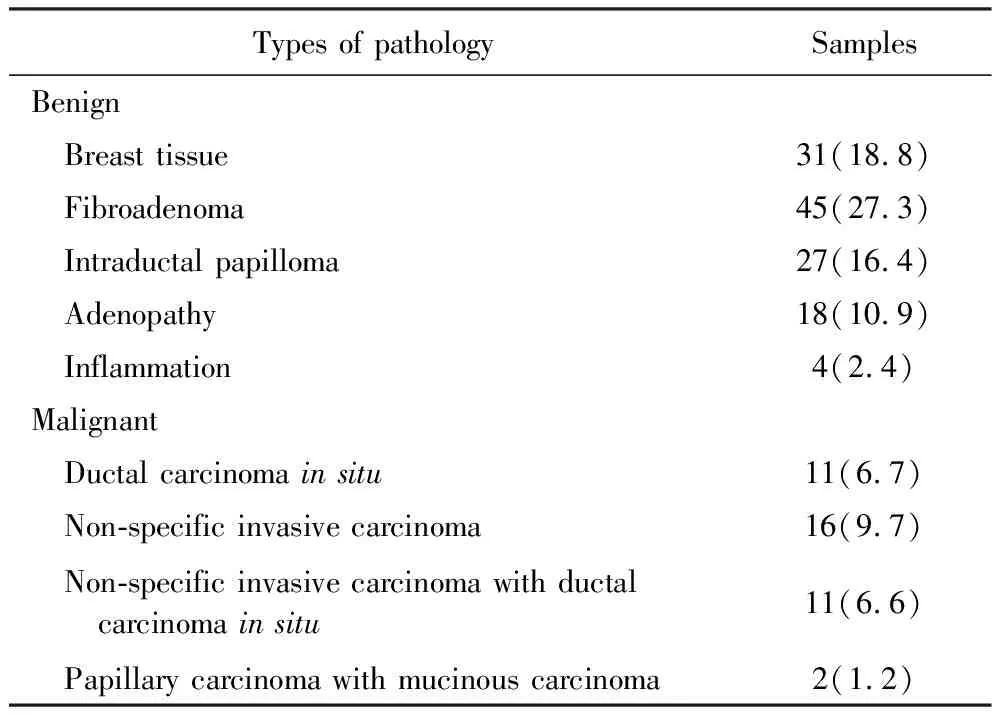
表2 165例病灶的病理类型
2.2 不同病理类型乳腺结节的CDFI、SMI分级
CDFI和SMI两种方法对乳腺微小结节血流检出能力不同,CDFI对165例病灶的血流显示率为47.3%(78/165),SMI的显示率为83.6%(138/165)。
CDFI未能检测出血流评级为0级的87例病灶中,有28例病灶SMI也未能检测出血流(良性26例,恶性2例),另59例病灶SMI检出I级或Ⅱ级血流(良性50例,恶性9例),详见表3。

表3 不同病理类型乳腺结节的CDFI、SMI分级Tab.3 CDFI and SMI classification of breast nodules in different pathological types n(%)
2.3 CDFI、CDFI+SMI及CEUS诊断乳腺BI-RADS 4类微小结节的效能
CDFI组,“Adler分级<Ⅰ级”与“Adler分级>Ⅰ级”区分良恶性的差异具有统计学意义;CDFI+SIM组,“CDFI Adler分级<Ⅰ级且SMI Adler分级<Ⅱ级”与“CDFI Adler分级≥Ⅰ级或SMI Adler分级≥Ⅱ级”区分良恶性的差异具有统计学意义;CEUS组,“9个特征中符合1个及以下”与“9个特征中符合2个及以上”区分良恶性的差异具有统计学意义(表4)。绘制CDFI、SMI诊断乳腺微小癌的ROC曲线,计算约登指数,获得诊断阈值。CDFI组以Adler分级≥I级为诊断标准, CDFI+SMI组以CDFI Adler分级≥I级或SMI Adler分级≥Ⅱ级为诊断标准,CEUS组以符合高增强、向心性、造影后病灶范围扩大、不均匀增强、有灌注缺损区、增强后形态不规则、增强后边界不清晰、增强后有蟹足征或穿支血管征9个特征中2个或2个以上为诊断恶性标准。3种血流显像方法诊断乳腺微小癌差异有统计学意义(P=0.031),CEUS与CDFI、CDFI+SMI诊断乳腺微小癌差异有统计学意义(P=0.043,P=0.012),而CDFI、CDFI+SMI两组间诊断乳腺微小癌差异无统计学意义(P=0.622)。3者诊断乳腺微小癌的灵敏度分别为72.5%、87.5%、72.5%,特异度分别为60.8%、59.2%、82.4%,准确性分别为63.6%、66.1%、80.0%,AUC分别为0.665、0.771、0.772(图1,表5)。
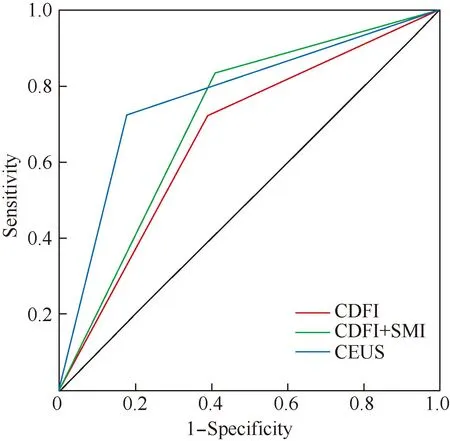
图1 CDFI、CDFI+SMI及CEUS诊断乳腺微小癌的ROC曲线Fig.1 ROC curves of CDFI, CDFI+ SMI and CEUS for the diagnosis of microcarcinoma of the breast
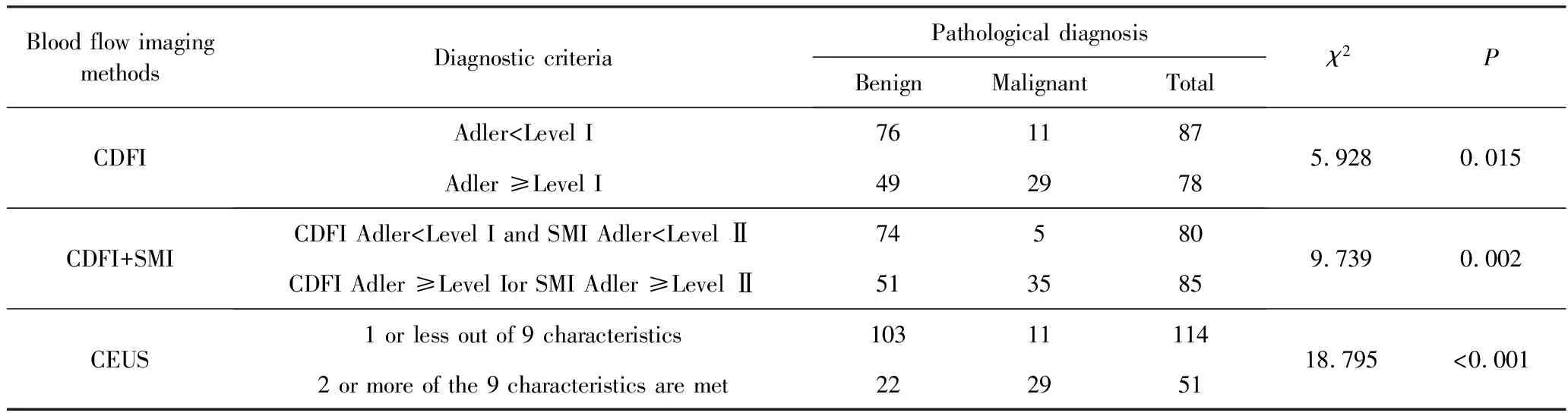
表4 CDFI、CDFI+SMI及CEUS不同等级对应乳腺微小结节比例Tab.4 The proportion of micronodules in the corresponding breasts of different grades of CDFI, CDFI+SMI,CEUS

表5 CDFI、CDFI+SMI及CEUS三种血流显像方法对乳腺微小结节的诊断价值Tab.5 Diagnostic value of CDFI, CDFI+SMI,CEUS in the diagnosis of micronodules of the breast
2.4 不同病理分型的乳腺微小结节典型图像
乳腺微小纤维腺瘤1例(图2)。女性,39岁,超声提示右乳低回声结节,边界清晰,形态规则,内多发强回声点,后方可见声影(图2A)。CDFI示Adler 0级血流(图2B), SMI显示I级血流(图2C);CEUS显示结节均匀低强化,未见明显血流信号(图3D)。
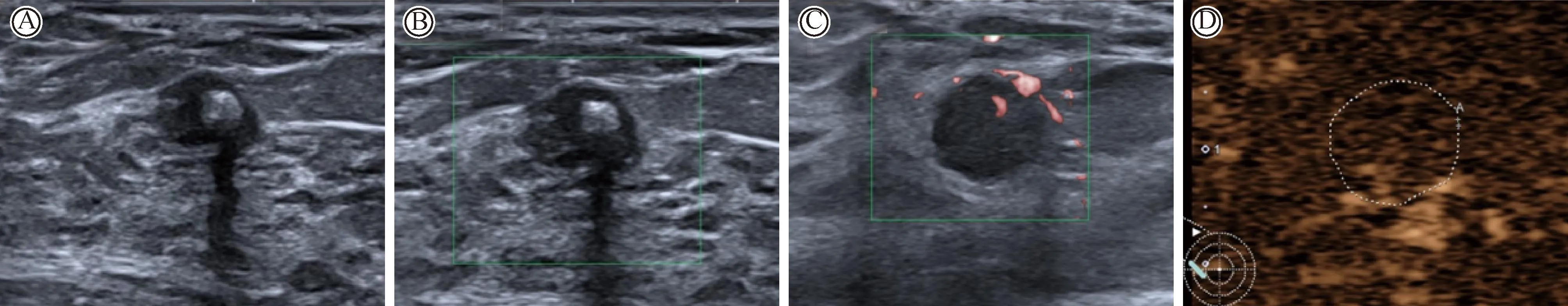
图2 1例乳腺微小纤维腺瘤的超声图像(女性,39岁)Fig.2 A case of fibroadenoma in breast(Female, 39 years old)

图3 1例乳腺微小腺病的超声图像(女性,53岁)Fig.3 A case of adenopathy in breast(Female, 53 years old)
乳腺微小腺病1例(图3)。女性,53岁,超声提示右乳低回声结节,边界不清,形态不规则,分叶浅(图3A)。CDFI示Adler 0级血流(图3B)。SMI显示0级血流(图2C)。CEUS显示结节呈均匀低强化,与常规检查范围相比无明显变化(图3D)。
乳腺炎性病变1例(图4)。女性,29岁。超声提示左乳低回声结节,边界不清,形态不规则,内部回声区不规则(图4A)。CDFI示Adler I级血流(图4B)。SMI示I级血流(图4C)。CEUS显示结节均匀增强,并与周围腺体组织同步增强和消退。
图4 1例乳腺微小炎性结节的超声图像(女性,29岁)Fig.4 A case of inflammatory lesion in breast(Female, 29 years old)
乳腺浸润性癌1例(图5)。女性,62岁。超声提示左乳低回声结节,边界不清,形态不规则,纵横比>1,部分切面可见成角形状,结节周围可见高回声晕(图5A)。CDFI示Adler Ⅱ级血流(图5B)。SMI示Ⅲ级血流(图5C)。CEUS示结节不均匀且高度强化,较常规检查范围增大,强化后形态不规则,可见“蟹足征”、“穿通血管征”(图5D)。

图5 1例乳腺微小浸润性癌的超声图像(女性,62岁)Fig.5 A case of invasive carcinoma in breast(Female, 62 years old)
3 讨论
由于乳腺BI-RADS 4类结节诊断的良恶性跨度较大,其诊断方法一直是目前研究的热点[6]。其恶性率可能为2%~95%,病理结果良性率可达50.2%[7],尤其是乳腺微小结节,由于恶性特征不明显,低速血流信号显示受限,更容易出现高估或者低估诊断,而CEUS或穿刺则会增加患者的有创诊断及不必要的诊疗费用。对于微小乳腺癌而言,由于其体积较小,相应的其供血的血管管径也较小,影像学检查症状不典型,是临床上超声、磁共振及钼靶诊断的难点[8]。本文研究纳入的病例均为BI-RADS 4类、最大径≤1 cm的肿块,其体积小。鉴于乳腺癌作为富血供的恶性肿瘤,其内血管分支及数量一般远多于良性肿块[9-10]。因此,准确诊断及鉴别乳腺结节内的微血流信号特征对治疗决策有重要的临床意义。
CDFI 临床使用方便、快捷、经济,是评估肿瘤血供的常用检查手段,也是乳腺微小结节的首选检查方法,其特征表现是病灶内出现高阻力的彩色血流,该征象对诊断BI-RADS 4类结节的良恶性诊断灵敏度高。但传统CDFI 信噪比低,在应用壁滤波消除组织运动伪像的同时对微血流会一并滤除。SMI技术在鉴别乳腺结节的良恶性病变方面具有较高的灵敏度和特异度,对于SMI的乳腺结节血管特征,灵敏度和特异度分别为0.74 (95%CI: 0.61~0.84)和0.80 (95%CI: 0.76~0.84)[11]。但是应用SMI 对乳腺BI-RADS 4类微小结节的研究报道不多,或者病例数过少,或者缺乏与 CDFI 及CEUS的比较。
本文研究在对乳腺微小结节的血流检测中发现SMI对乳腺微小结节的血流显示率明显高于CDFI,即SMI可显示更加丰富的血流信号。SMI可显示流速在1 cm/s、管径 0.1 mm 以内的低速微小血管,呈现更加真实的血流信息。应用SMI技术后,乳腺微小结节的血流显示比例从单纯采用CDFI的47.3%提高到联合应用SMI后的83.6%, CDFI+SMI联合应用后检出乳腺微小恶性结节的灵敏度提高,进一步显示了微小结节内的低速血流,有助于鉴别良、恶性质。CEUS作为微灌注显像技术能更清楚地显示乳腺结节微血管分布,但其为有创检查、需要使用造影剂,且同一时间只能观察一个切面。本文研究中发现,相较于单纯应用CDFI, CDFI+SMI联合与CEUS都提高了对乳腺微小结节的诊断有效率,且较有创的CEUS, CDFI+SMI联合应用灵敏度更高,意味着诊断BI-RADS 4类结节时,可以有效地进一步鉴别其性质。本研究显示,CDFI+SMI联合应用后,乳腺微小癌的血流信号明显比乳腺微小纤维腺瘤、乳腺微小腺病、及乳腺微小炎性灶的血流信号多,与CEUS的微血流灌注无明显差异。
本文研究提示,超声检查发现BI-RADS 分级为4类的乳腺微小结节,中青年女性可以定期复查、进行随访,年长患者建议积极干预、行穿刺活检明确性质。
本文研究的局限性:各病理类型样本不均衡是研究的局限性之一,病例中良性结节偏多。但这是与实际检查情况和肿瘤发生发展的特点相一致的,尤其是在乳腺微小结节中,大多情况是恶性结节的数量明显少于良性结节,故本文研究采用了目前样本。
综上所述,联合应用CDFI和SMI在临床推广方面具有良好潜力,有利于更详尽地指导临床治疗,减轻患者痛苦,降低超声医师工作强度。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明于腾飞:提出研究思路,设计研究方案,撰写论文;殷露、田道然:参与论文设计,文献检索及分析;宋海曼:临床数据采集,资料分析;尹子毅、张巍、何文:总体把关,审定论文。

