海绵负载Co-B催化剂催化硼氢化钠水解制氢性能研究
刘 啸,谢 镭,邓霁峰,时 雨,郑 捷
(1.江苏集萃分子工程研究院有限公司,江苏苏州 215500;2.北京大学化学与分子工程学院,北京 100091)
能源和环境问题已成为全球性关注的两大焦点问题,为了解决能源危机和缓解环境污染,寻求可持续的、清洁高效的新能源体系迫在眉睫。作为能量储存与转化器件的氢燃料电池以其能量密度高、能量转化效率高、清洁无污染等诸多优点受到了广泛的关注和研究。其中,储氢是氢燃料电池应用的关键技术。硼氢化钠水解制氢是一种高效的现场制氢技术,具有理论储氢密度高、制得的氢气纯度高、反应条件温和容易控制等优势,非常适用于中小型燃料电池的供氢。
硼氢化钠水解制氢反应如下:
硼氢化钠水解反应的催化剂主要有两类:一类是贵金属催化剂,如Pt 基[1]、Ru 基[2]、Pd 基[3]催化剂等;另一类是非贵金属催化剂。非贵金属催化剂已可以做到与贵金属催化剂活性相当,且成本低廉,因此对非贵金属催化剂的研究更加广泛。SCHLESINGER等[4]研究了多种金属氯化物对硼氢化钠水解的催化效果,发现氯化钴的催化性能最好,进一步研究发现钴盐的作用归因于在反应初始阶段形成的Co-B 结构,Co-B 催化剂因此被用作硼氢化钠水解制氢的常用催化剂。
为了便于催化剂重复利用,通常将催化剂负载于多孔载体上。多孔载体可以提高催化剂的比表面积,使催化剂分散更均匀,同时可以减缓催化剂的团聚失活现象。常用的硼氢化钠水解制氢催化剂的载体有TiO2[5]、γ-Al2O3[6]和泡沫镍[7]等。聚乙烯醇缩甲醛(PVFM)海绵作为一种多孔材料,相比传统的金属氧化物等载体更具优势:一方面PVFM 海绵质量更轻,有利于提高制氢装置整体的质量储氢密度;另一方面PVFM 海绵表面带有含氧基团,这些含氧基团能够与过渡金属通过化学键形成较强的连接,从而抑制活性组分在反应过程中由于气体和液体的冲刷造成的脱落,能够长时间保持高活性。本文通过浸渍-还原法制备了PVFM 负载的Co-B/PVFM 催化剂,探究了不同反应条件对其催化硼氢化钠水解制氢性能的影响,并在连续式反应装置中考察了Co-B/PVFM催化剂的实际应用潜力。
1 实验部分
1.1 实验原料
六水合氯化钴(CoCl2·6H2O,分析纯),硼氢化钠(NaBH4,分析纯),氢氧化钠(NaOH,分析纯),PVFM海绵(圆柱状,直径为13 mm,高度为15 mm)。
1.2 催化剂的制备
称取19.29 g CoCl2·6H2O置于烧杯中,加入200 mL去离子水溶解,放入100 块PVFM 海绵于上述溶液中,反复挤压,使海绵充分浸渍并吸收CoCl2溶液后放入烘箱中加热至120 ℃充分干燥。称取21.03 g NaBH4置于烧杯中,加入400 mL 去离子水溶解,将干燥后的PVFM海绵放入上述NaBH4溶液中充分还原,直至没有气泡产生为止。将还原后的PVFM 海绵用去离子水充分洗涤并挤压2~3次,即得到PVFM海绵负载的Co-B催化剂,将其命名为Co-B/PVFM。
1.3 载体和催化剂的表征
物相分析:采用Bruker D8 ADVANCE 型X 射线衍射仪(XRD)测试PVFM海绵和催化剂的物相。以Cu作为光管灯丝,发射源为Kα,测试电压为40 kV,电流为40 mA。
表面形貌分析:采用Hitachi S-4800型扫描电子显微镜(SEM)观察PVFM 海绵和催化剂的表面形貌。
催化剂表面元素化学态表征:利用Scientific ESCALAB 250Xi 型X射线光电子能谱(XPS)分析所制备Co-B/PVFM 催化剂中Co 和B 元素所处的化学态。
1.4 催化剂的性能评价
采用间歇式反应装置考察Co-B/PVFM 催化剂的反应活性,反应装置如图1所示。以250 mL 的三口烧瓶作为反应器,将烧瓶底部浸入恒温水浴锅中。右侧瓶口插入温度计来测量溶液温度;中间瓶口接入导气管,将反应产生的氢气经过干燥管干燥后引入质量流量计,在线检测氢气的瞬时产量及累计产量;左侧瓶口为加料口,首先在烧瓶中加入一定体积的NaBH4和NaOH 溶液,然后加入3 块Co-B/PVFM 催化剂,迅速塞紧橡胶塞,开始计时,质量流量计每隔1 s记录1次流量数据。

图1 间歇式实验装置示意图Fig.1 Schematic diagram of batch experimental apparatus
2 结果与讨论
2.1 载体和催化剂的表征
原始的PVFM 海绵呈天蓝色,如图2a 所示。当负载Co-B 后,催化剂表面变成均一的灰黑色,如图2b 所示,这表明Co-B 在海绵载体上负载十分均匀。此外,从图2c 的催化剂剖面图中可以看出,Co-B主要负载在海绵载体的表面几层,在海绵内部的负载量较少。

图2 PVFM海绵(a)、Co-B/PVFM催化剂(b)及催化剂剖面(c)的光学图片Fig.2 Optical images of PVFM sponge(a),Co-B/PVFM catalyst(b) and catalyst profile(c)
图3是PVFM海绵和Co-B/PVFM催化剂的XRD谱图。从图3 可以看出,相比于PVFM 载体,Co-B/PVFM 催化剂的谱图在2θ=44°处出现较宽的弥散峰,这是非晶态合金的特征衍射峰,说明催化剂具有典型的非晶态结构;此外,在2θ=35°处出现的峰则归属于CoB的特征峰[8],这表明Co-B是晶态和非晶态共存的状态。
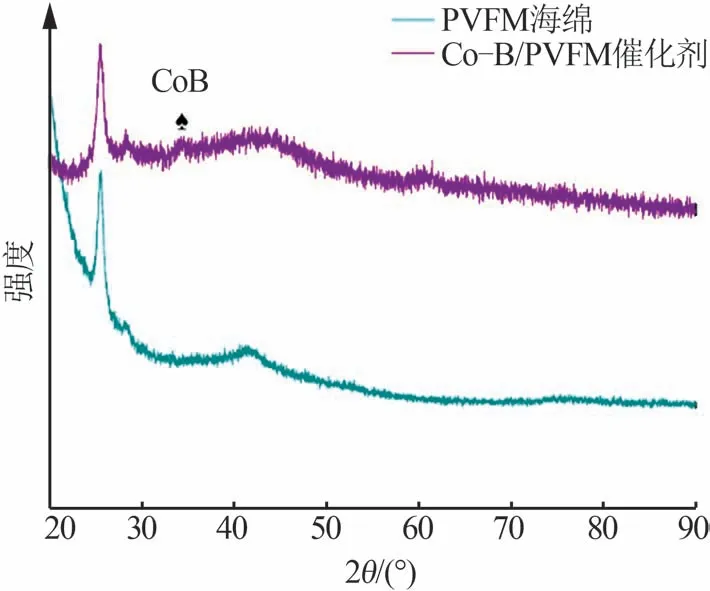
图3 PVFM海绵和Co-B/PVFM催化剂的XRD谱图Fig.3 XRD patterns of PVFM sponge and Co-B/PVFM catalyst
采用XPS对Co-B/PVFM催化剂进行了表征,结果如图4 所示。图4a 是对Co 2p谱带进行分峰拟合的结果,其中在781.2 eV 和797.3 eV 处的峰分别对应2P3/2和2P1/2谱带中Co2+的峰[CoO 或Co(OH)2,因二者结合能相近,通过XPS 难以区分],同时在786.9 eV和803.3 eV两处为典型的二价钴卫星峰[9]。值得注意的是,Co 2p XPS谱图中并没有出现元素态钴(Co0)的特征峰。图4b是B 1s的谱带,在192.0 eV处的峰对应为氧化态硼(B3+)的峰,谱带中同样没有出现元素态硼(B0)的特征峰[10]。以上结果说明在催化剂表层中Co和B主要以氧化态存在,这可能是催化剂暴露于大气环境中导致的。

图4 Co-B/PVFM催化剂的XPS谱图Fig.4 XPS spectra of Co-B/PVFM catalyst
图5展示了PVFM海绵和Co-B/PVFM催化剂在不同分辨率下的SEM 照片。由图5a、c、e 可知,PVFM 海绵呈现出典型的纤维状三维网络结构,且纤维表面较为光滑。由图5b、d、f 可知,当负载了Co-B 后,PVFM 海绵的网络结构并没有被堵塞,而是在纤维的表面呈现粗糙多孔的Co-B涂层。Co-B呈片层状团簇在PVFM 纤维上均匀负载,且不仅负载在表层纤维,也在内部几层均匀负载。PVFM 海绵的多孔网络结构,抑制了Co-B 活性组分的团聚,有利于维持催化剂高催化活性。

图5 PVFM海绵(a,c,e)和Co-B/PVFM催化剂(b,d,f)的SEM照片Fig.5 SEM images of(a,c,e) PVFM sponge and(b,d,f) Co-B/PVFM catalyst
2.2 反应条件对Co-B/PVFM催化剂催化性能的影响
2.2.1 NaBH4浓度的影响
在室温下,固定NaOH 浓度为1.0 mol/L,溶液中NaBH4的总量为0.03 mol,考察了不同NaBH4浓度对Co-B/PVFM 催化剂催化NaBH4水解制氢性能的影响,结果如图6所示。从图6可以看出,制氢速率随着NaBH4浓度的增加而增大。此外,NaBH4的转化率随着NaBH4浓度的增加先逐渐增大随后略有降低,在NaBH4浓度为2.5 mol/L时,对应的制氢体积为2.558 L,此时转化率最大为95.5%(0.03 mol NaBH4对应的理论反应产氢量应是2.678 L)。
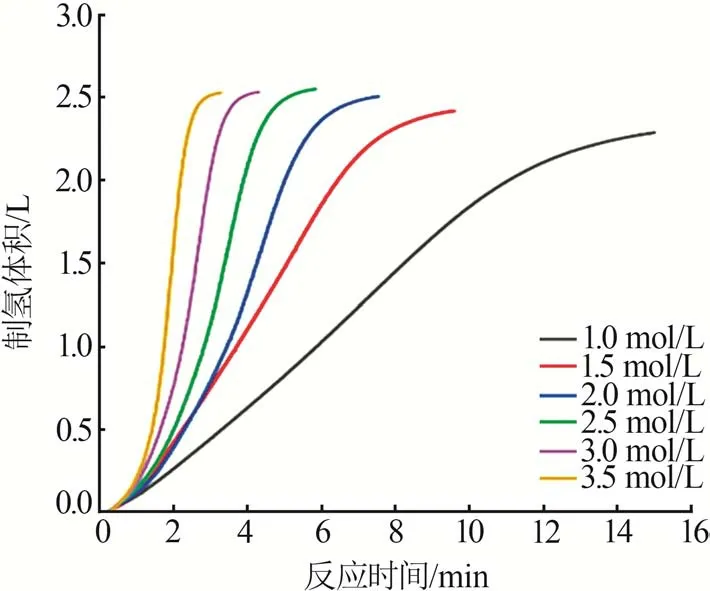
图6 不同NaBH4浓度下的水解制氢曲线Fig.6 Hydrolysis hydrogen production curves under different NaBH4 concentrations
金属催化剂催化NaBH4水解的过程通常可以分为以下几个步骤[11-12]:
随着NaBH4浓度的升高,与活性位点接触的BH4-的量增多,制氢速率也随之升高。在之前的研究中,有些催化剂催化NaBH4水解的制氢速率会随着NaBH4浓度的增加先增大后减小[13-15],这是因为当NaBH4浓度过高时,反应中会有更多的水被消耗,导致溶液的黏度增大,影响活性位点与水分子的接触[16],造成制氢速率降低。PVFM 海绵由于具有非常良好的吸水性,显著提高了活性位点与水分子的接触几率,因此,即使在高NaBH4浓度下也具有优异的催化活性。
2.2.2 NaOH浓度的影响
即使在没有催化剂的作用下,NaBH4也会缓慢自发水解放出氢气,但为了提高NaBH4溶液的稳定性,需要在NaBH4溶液中加入一定量的NaOH 作为稳定剂。
在室温下,固定NaBH4浓度为1.0 mol/L,溶液体积为30 mL,考察了不同NaOH 浓度对Co-B/PVFM催化剂催化NaBH4水解制氢性能的影响,结果如图7所示。从图7可以看出,制氢速率随着NaOH浓度的增加先增大后减小,当NaOH 浓度为2.0 mol/L 时制氢速率最大。
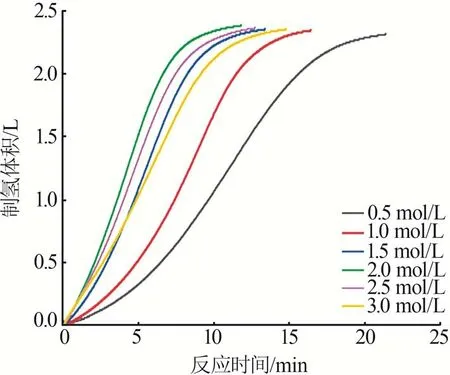
图7 不同NaOH浓度下的水解制氢曲线Fig.7 Hydrolysis hydrogen production curves under different NaOH concentrations
从上述金属催化剂催化NaBH4水解的步骤中可以看出OH-参与了NaBH4的水解反应,当NaOH浓度较低时,升高NaOH 的浓度有利于促进水解反应的进行。然而当NaOH浓度过高时,OH-和BH4-在催化剂表面会产生竞争吸附,过多的OH-占据活性位点会影响BH4-与活性位点的作用[17]。此外,水解反应的副产物NaBO2在碱性条件下溶解度变低,大量的NaBO2聚集会覆盖催化剂的活性位点,抑制NaBH4的水解[18],从而降低制氢速率。
2.2.3 反应温度的影响
固 定NaBH4浓 度 为1.5 mol/L,NaOH 浓 度 为1.0 mol/L,溶液体积为20 mL,将水浴温度分别设置为30、35、40、45 ℃,考察了反应温度对Co-B/PVFM催化剂催化NaBH4水解制氢性能的影响,结果如图8a所示。从图8a可以看出,制氢速率随着反应温度的升高而增大。温度的升高使得溶液中BH4-的扩散速度加快,与催化剂活性位点接触的概率增加,同时反应产物氢气和NaBO2也能够更快速地从活性位点上脱附;此外,温度的升高使得NaBO2的溶解度增大,从而降低了NaBO2因析出后覆盖催化剂的活性位点而对制氢速率产生的抑制作用。此外,从图8a还可以看出,氢气的生成量随反应时间延长基本上呈线性增加,这表明Co-B/PVFM 催化剂催化NaBH4水解制氢反应为0级反应。
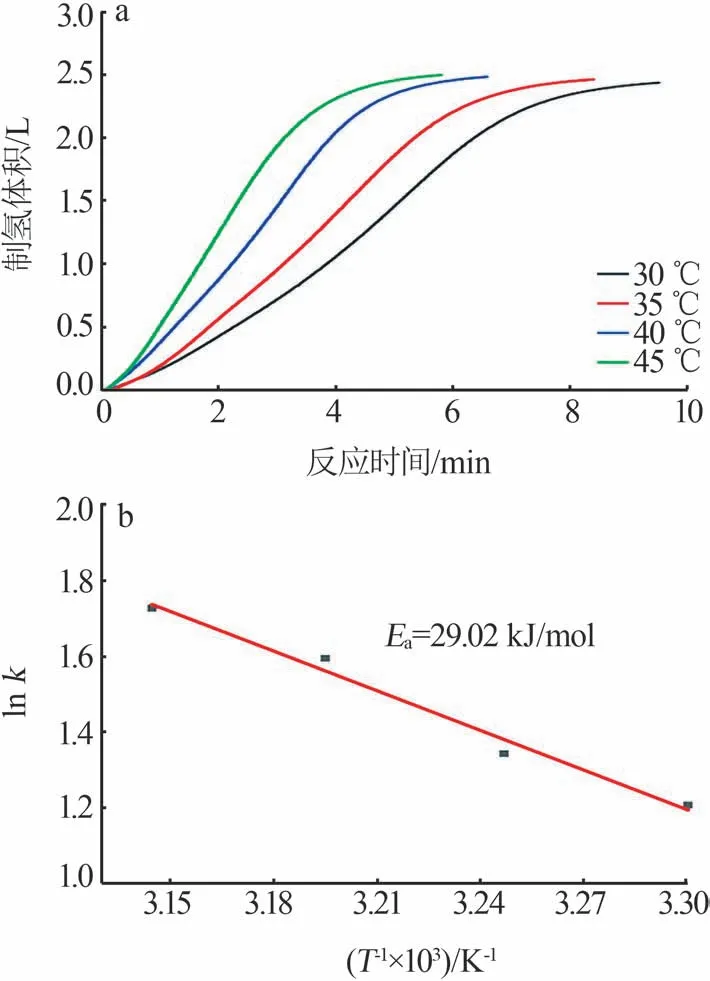
图8 不同反应温度下的水解制氢曲线(a)和反应的Arrhenius曲线(b)Fig.8 Hydrolysis hydrogen production curves under different reaction temperatures(a) and Arrhenius plot for hydrogen generation reaction(b)
通过Arrhenius 方程可以计算NaBH4水解反应的表观活化能:
式中:k为速率常数,L/(min·g);A为指前因子;Ea为活化能,kJ/mol;R为摩尔气体常数,其值为8.314 J/(min·K);T为反应温度,K。如图8b所示,以lnk对1/T×103作图,通过线性拟合可以得出反应的动力学方程为lnk=-3 490.7/T+12.714,根据拟合直线的斜率可以计算出反应的Ea是29.02 kJ/mol,这一值低于绝大部分的Co 基催化剂[19-22],这说明Co-B/PVFM 催化剂对于NaBH4水解制氢具有优异的催化活性,基于PVFM海绵载体的诸多优点,该催化剂在制氢领域有非常好的应用前景。
2.3 Co-B/PVFM催化剂实际应用潜力考察
在实际应用中催化剂催化NaBH4水解为燃料电池供氢是在连续式反应器中进行的,通常将负载型催化剂填充于固定床或半固定床反应器中,通过控制溶液中NaBH4的浓度及进料速率来控制制氢的速率。为了考察Co-B/PVFM 催化剂催化NaBH4水解为燃料电池持续供氢的实际应用潜力,在连续式反应装置中进行了测试,反应装置的结构如图9a 所示。原料罐溶液中NaBH4的质量分数为11.0%,NaOH 的质量分数为3.0%,反应器中装填有Co-B/PVFM 催化剂,通过蠕动泵将原料液以一定的速率输送至反应器底部,与催化剂接触开始反应,经过一定的停留时间后反应后的原料液到达反应器上部并排入废液罐,反应产生的气体经过气液分离后引入质量流量计,在线检测氢气的瞬时产量及累计产量。
连续反应器的制氢速率曲线如图9b 所示,Co-B/PVFM 催化剂的响应时间很短,随着原料液的加入,初始制氢速率迅速升高,并在3 min左右达到平稳状态。经过100 min的反应,累积产生氢气体积为1 201 L,制氢速率基本稳定,没有发生明显衰减,平均制氢速率为12.0 L/min。假设燃料电池的工作电压为0.7 V,这一速率可以为1 kW 的燃料电池供应氢气,这说明Co-B/PVFM 催化剂催化NaBH4水解制氢具有极大的实际应用潜力。
3 结论
采用浸渍-还原法制备了PVFM 海绵负载的Co-B/PVFM 催化剂,考察了NaBH4浓度、NaOH浓度及反应温度等参数对其催化NaBH4水解制氢性能的影响。结果表明:1)制氢速率随NaBH4浓度的升高而增大;2)制氢速率随NaOH 浓度的升高先增大后减小,在NaOH 浓度为2.0 mol/L 时制氢速率达到最大;3)制氢速率随反应温度的升高而增大,反应活化能为29.02 kJ/mol;4)在连续式反应装置中,Co-B/PVFM 催化剂催化NaBH4水解制氢速率可达12.0 L/min,可为1 kW的燃料电池供应氢气,催化活性持续100 min没有发生衰减,具有极大的实际应用潜力。

