‘法兰西’西梅多酚组分鉴定及抗氧化活性评价
尼格尔热依·亚迪卡尔,朱璇,冯作山,王国王,康洁,王晨
(1新疆农业大学食品科学与药学学院,乌鲁木齐 830052;2新疆果品采后科学与技术重点实验室,乌鲁木齐 830052)
0 引言
‘法兰西’西梅具有较强的抗逆性、耐贮运性、果品品质优良[1],硬度低质软,口感酸甜较适合鲜食[2],同时化学成分复杂,主要为多酚、花青素、膳食纤维等[3]。其中多酚类化合物分为游离酚和结合酚[4],具有显著的生物活性,被广泛应用于食品、医药、日化产品等方面[5]。研究发现,西梅具有预防骨质疏松症及骨质流失[6],减少动脉粥样硬化的病变区域[7],减轻认知障碍[8],抑制高胆固醇血症[9],改善肝功能[10],润肠通便[11]等功效,其中的抗氧化物质还可延缓机体和大脑衰老[12]。西梅在国内外被广泛栽培,中国新疆伊犁地区种植西梅达333.33 hm2,年产量5000 t[13]。目前关于检测西梅果实的抗氧化活性的报道甚少,本研究以伊犁地区‘法兰西’西梅为原料,采用福林酚法测多酚含量,并用超高效液相色谱-质谱法对其化学成分进行鉴定,并探讨西梅各部位的体外抗氧化活性,以期为全方位开发利用西梅的药食两用价值提供理论依据。
1 材料与方法
1.1 材料与仪器
‘法兰西’西梅取自新疆伊犁地区伊宁县西梅种植地,没食子酸、福林酚(P824172-500 mL)购自上海源叶生物科技有限责任公司,碳酸钠购自天津市致远化学试剂有限责任公司,乙酸乙酯、浓盐酸、丙酮、碳酸钠及正己烷购自天津市百世化工有限公司,氢氧化钠、甲醇购自天津市致远化学试剂有限公司,且以上试剂均为分析纯。
T6 新世纪紫外分光光度计(上海美谱达仪器有限公司)、BSA124S电子天平(赛多利斯科学仪器北京有限公司)、SF-TDL-40D 离心机(上海菲恰尔分析仪器有限公司)、RE-52 系列旋转蒸发器(上海亚荣生化仪器厂)、ACQUTY UPLC超高效液相色谱仪(上海伍丰科学仪器有限公司)。
1.2 实验方法
1.2.1 西梅的预处理选无腐烂、无伤害、完整的果实,将其洗净、沥干、去核,果皮与果肉分离,置于-40℃冰箱内冷冻,备用。
1.2.2 游离酚的提取参照Adom 等[14]的方法,根据实验条件稍作修改。准确称取西梅各部位25 g于15 mL离心管中,加入50 mL 80%冷冻丙酮溶液,冰浴均质(第1 次2 min、第2 次1 min、第3 次0.6 min,每次间隔2 min)后,于3500 r/min 离心10 min,取上清液。残渣重复提取2次,合并上清液,抽滤后于45℃旋转蒸干,用超纯水定容至25 mL。过0.45 μm 有机滤膜后贮于-40℃条件下保存备用。
1.2.3 结合酚的提取收集游离酚提取后的残渣,加入20 mL 2 mol/L NaOH 溶液,避光搅拌消化1.5 h,再用浓盐酸调pH 2 左右。加入正己烷20 mL,搅拌10 min后离心,除去脂肪层,重复去脂2次。加入20 mL乙酸乙酯并充分搅拌提取10 min,3500 r/min离心后取上清液,重复提取5 次,合并上清液,抽滤后于45℃旋转蒸干,用超纯水定容至10 mL。过0.45 μm有机滤膜后贮于-40℃备用。
1.2.4 含量的测定
(1)没食子酸标准曲线绘制。没食子酸的标准溶液配制参考孙志猛等[15]的方法,并进行测定。称取没食子酸标准品0.0110 g,用蒸馏水溶解并定容至100 mL,得浓度为0.11 mg/mL的标准液。吸取没食子酸标准溶液配成0、1.76、2.64、3.52、4.4、5.28 mg/mL 置于25 mL的棕色容量瓶中,加蒸馏水至12 mL,加入福林酚试剂1 mL,混匀,在0.5~8 min内加入了3 mL 20%的Na2CO3溶液,充分混合后定容,30℃避光放置0.5 h,以不加标准液的6.0 mL蒸馏水为空白对照,760 nm下测定吸光值,每个样品平行测定3 次。以多酚质量浓度为横坐标、吸光度为纵坐标绘制标准曲线,得到标准曲线回归方程y=0.1173x+0.0057(R2=0.9993),根据该回归方程计算待检样品中酚类物质的含量。
(2)西梅果皮、果肉及肉皮中游离酚和结合酚含量测定。采用Folin-酚法,取400 μL提取液(可作适当稀释)并用去离子水补至1 mL,后续操作同标准曲线的制备。结果按式(1)计算,以每100 g 样品中所含的没食子酸当量表示,以鲜质量计。每个样品做3组平行,结果表示为。
式(1)中,M为西梅样品中多酚的含量(mg/g),n为样品稀释倍数,c为西梅多酚含量标准曲线中根据所测吸光值得出的西梅多酚溶液质量浓度(mg/mL),v为西梅样品定容的体积(mL),m为西梅样品的质量(g)。
1.2.5 西梅各部位多酚组分鉴定精密称取西梅各部位游离酚及结合酚提取物,配制为1 mg/mL的甲醇溶液,用0.22 μm微孔滤膜过滤,备用。
(1)色谱条件。色谱柱XBridge BEH Shield RP C18(2.5 μm,2.1 mm×100 mm),进样量为2 μL,柱温30℃,流动相为乙腈(A)-0.1%甲酸/水(B),分离条件为:0~3 min,2%~15%A;3~6 min,15%~16%A;6~26 min,16%~23%A;26~30 min,23%A;30~32 min,23%~42%A;32~34 min,42%~43%A;34~36 min,43%~100%A。测定波长为全波长扫描,流速为200 μL/min。
(2)质谱条件。在负电场作用的电喷雾电离(ESI)离子化条件下,喷雾电压3.8 kV,雾化气(N2)流量40 psi,辅助气体流量10 psi,离子源温度350℃,毛细管温度350℃,阶梯归一化碰撞能量设为30、50、70 eV,质谱扫描范围为100~1500m/z,碎片离子扫描范围为50~1500m/z。
1.2.6 抗氧化活性的测定
(1)样品的制备。将6种样品用蒸馏水稀释成5个不同浓度梯度(0.2、0.4、0.6、0.8、1.0 mg/mL)。
(2)总还原力的测定(FRAP法)。参考张纪宁等[16]的方法,在波长700 nm 处测定吸光度,最后进行平行实验,以相同浓度的维生素C为对照组。
(3)超氧阴离子自由基清除能力。参考王亚君等[17]的方法,在波长320 nm处测定吸光度。最后进行平行实验,以相同浓度的维生素C 为对照组,按式(2)计算。
式(2)中,Ax1为样品溶液与Tris-HCl 缓冲溶液、邻苯三酚溶液和HCl溶液混合后的吸光度,Ax2为样品溶液与Tris-HCl 缓冲溶液、蒸馏水和HCl 溶液混合后的吸光度,Ax0为样品溶剂与Tris-HCl缓冲溶液、邻苯三酚溶液和HCl溶液混合后的吸光度。
(4)·OH 羟基自由基清除能力(Fenton 法)。参考齐泊霖等[18]的方法,在波长510 nm处测得吸光值。最后进行平行实验,以相同浓度的维生素C为对照组,按式(3)计算。
式(3)中,Ay1为样品溶液与FeSO4、水杨酸乙醇溶液和H2O2溶液混合反应后的吸光值,Ay2为样品溶液与FeSO4、水杨酸乙醇溶液和蒸馏水混合反应后的吸光值,Ay0为样品溶剂与FeSO4、水杨酸乙醇溶液和H2O2溶液混合反应后的吸光值。
(5)DPPH 自由基清除能力。参考齐泊霖等[18]的方法,在波长517 nm 处吸光值。最后进行平行实验,以相同浓度的维生素C为对照组,按式(4)计算。
式(4)中,Az1为样品溶液与DPPH 工作液的吸光值,Az2为样品溶液与乙醇溶液的吸光值,Az0为样品溶剂与DPPH工作液的吸光值。
1.2.7 数据处理 每组实验至少重复3 次,采用Xcalibur、Origin、MestReNova、SPSS 等软件进行数据的处理及分析。
2 结果与分析
2.1 西梅各部位游离酚、结合酚含量
由表1 可见,西梅果皮中游离酚[(313.54±6.88)mg GAE/100 g]和结合酚[(97.92±0.36)mg GAE/100 g]含量均高于果肉及肉皮,且游离酚含量是结合酚的3倍以上,说明游离态是其多酚主要存在形式。
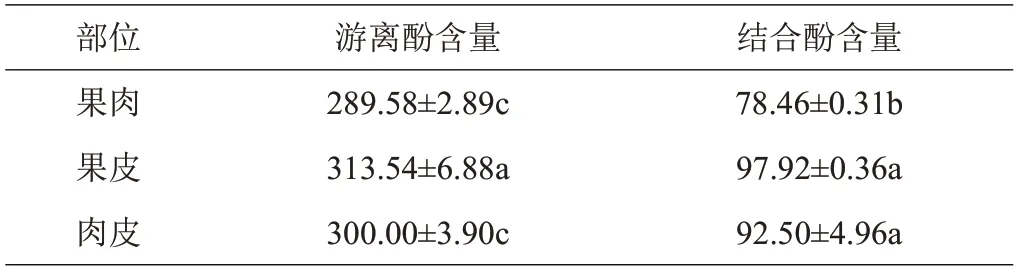
表1 西梅提取液的游离酚及结合酚的含量 mg GAE/100 g
2.2 西梅各部位组分鉴定
2.2.1 西梅果皮结合酚参照“1.2.5”项下条件,采集西梅果皮结合酚的质谱数据,分析其总离子流,正、负总离子流及HPLC图如图1所示。
图1 西梅果皮结合酚总离子流图
化合物1保留时间为58.79 min时的二级质谱(图2)给出了m/z297的分子离子峰[M-H]-,表明其相对分子质量为464.376,推测其元素组成为C21H20O12,[M-H]-的理论值为297.35,实测值为297.24,误差为0.11 mmu,对应的二级谱图中出现在m/z177.09 的[M-H]-,m/z163.11的[M-H-Glc-Gal]-碎片离子,结合相关文献[19],推测该化合物为槲皮素-O-葡萄糖苷。
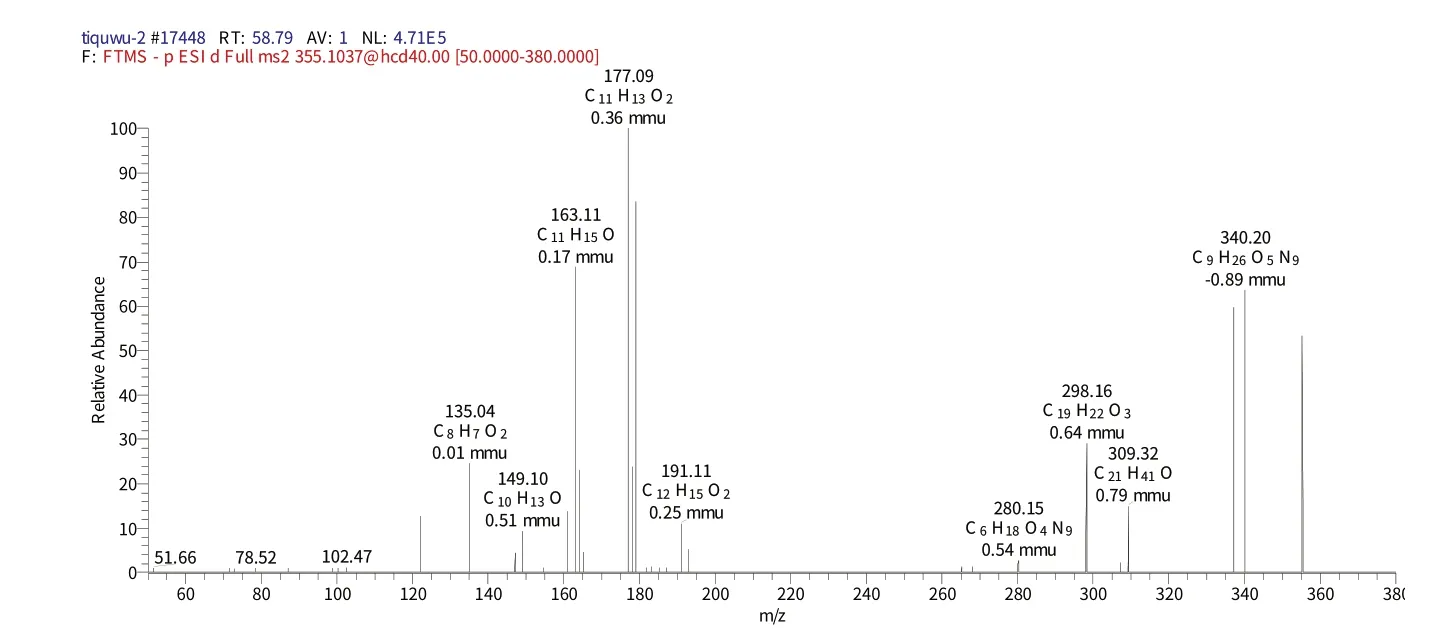
图2 化合物1保留时间58.79 min的二级图谱
化合物2 保留时间为3.91 min 时的二级质谱(图3)给出了m/z163的分子离子峰[M-H]-,表明其相对分子质量为180,推测其元素组成为C9H6O3,[M-H]-的理论值为163.060,实测值为163.0611,误差为0.11 mmu,对应的二级谱图中出现在m/z145.050 的[M-H]-、m/z119.049[M-H]-碎片离子,结合相关文献[20],推测该化合物为草酸。
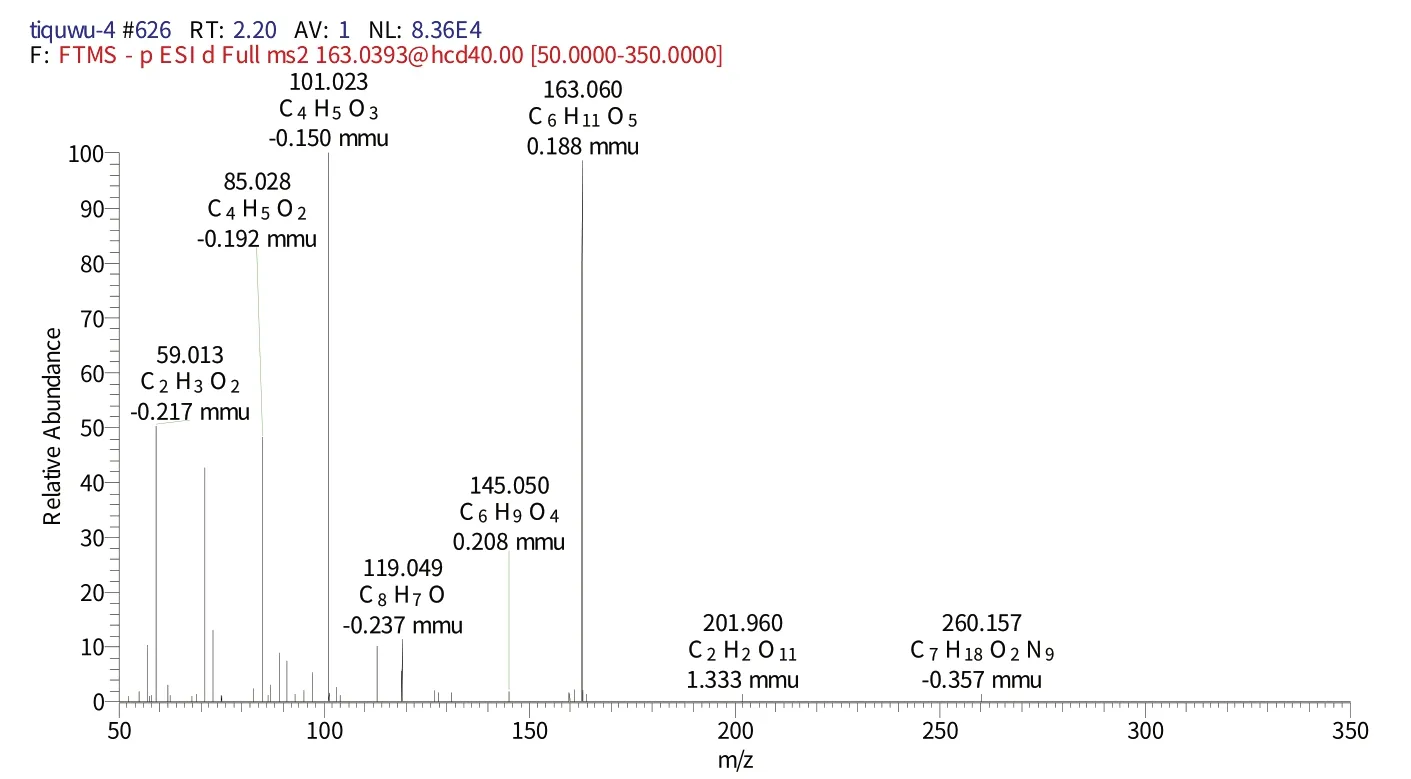
图3 化合物2保留时间3.91 min的二级图谱
化合物3 保留时间为1.86 min 时的一级质谱(图4)给出了m/z133的分子离子峰[M-H]-,表明其相对分子质量为150.087,推测其元素组成为C4H6O6,[M-H]-的理论值为133.01340,实测值为133.01321,误差为0.19 mmu,对应的二级谱图中出现在m/z115.00256 的[M-H]-、m/z133.04964[M-H]-碎片离子,结合相关文献[20],推测该化合物为酒石酸。
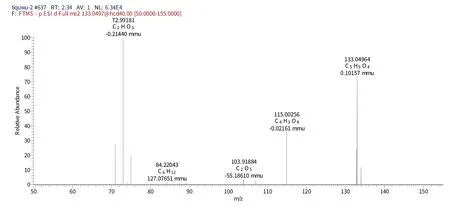
图4 化合物3保留时间1.86 min的一级图谱
2.2.2 西梅果肉结合酚参照“1.2.5”项下条件,采集西梅果肉结合酚的质谱数据,分析其总离子流,正、负总离子流及HPLC图如图5所示。
图5 西梅果肉结合酚总离子流图
化合物4 保留时间为17.06 min时的二级质谱(图6),给出了m/z179的分子离子峰[M-H]-,表明其相对分子质量为180,推测其元素组成为C9H8O4,[M-H]-的理论值为179.03432,实测值为179.03394,误差为0.38 mmu,对应的二级谱图中出现在m/z179.03394的[M-H]-、m/z135.04413[M-H-CO2]-碎片离子,结合相关文献[21],推测该化合物为咖啡酸。
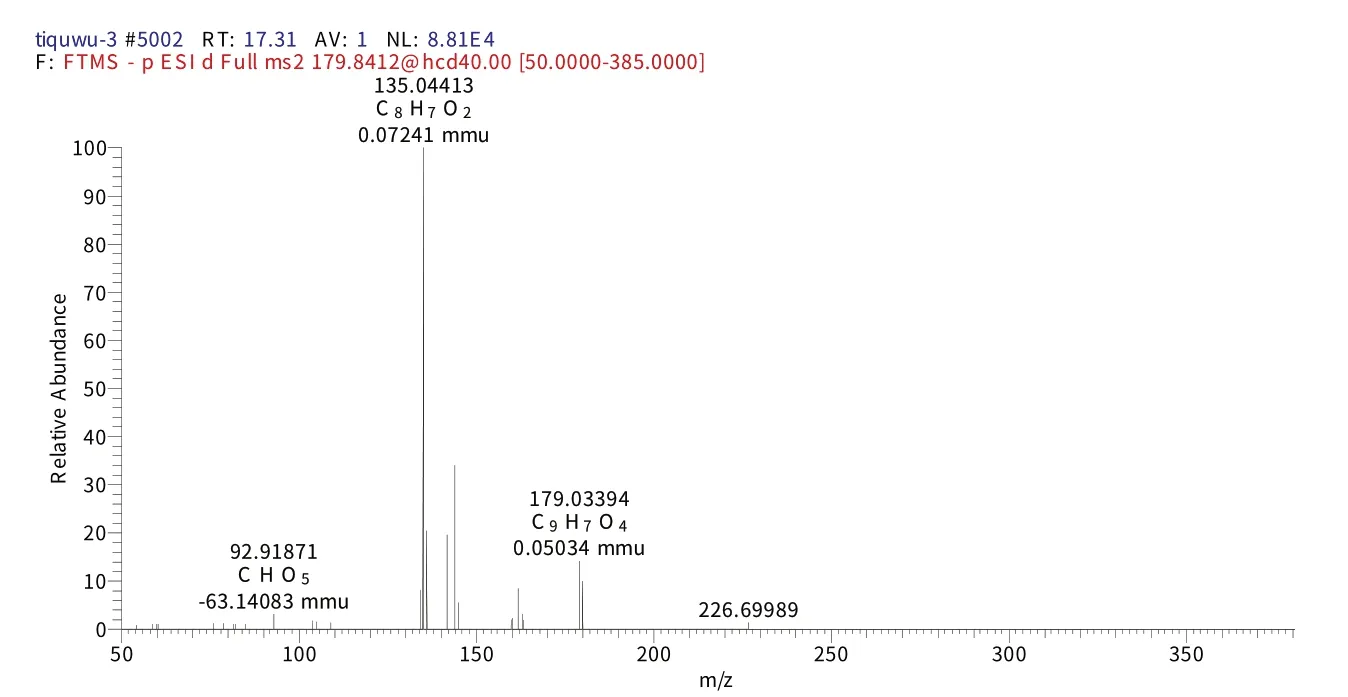
图6 化合物4保留时间17.06 min的二级图谱
化合物5 保留时间为2.40 min 时的二级质谱(图7)给出了m/z131的分子离子峰[M-H]-,表明其相对分子质量为134.087,推测其元素组成为C4H6O5,[M-H]-的理论值为131.02113,实测值为131.01315,误差为0.3898 mmu,对应的二级谱图中出现在m/z87.0435的[M-H]-、m/z115.00252[M-H]-碎片离子,结合相关文献[20],推测该化合物为L-苹果酸。
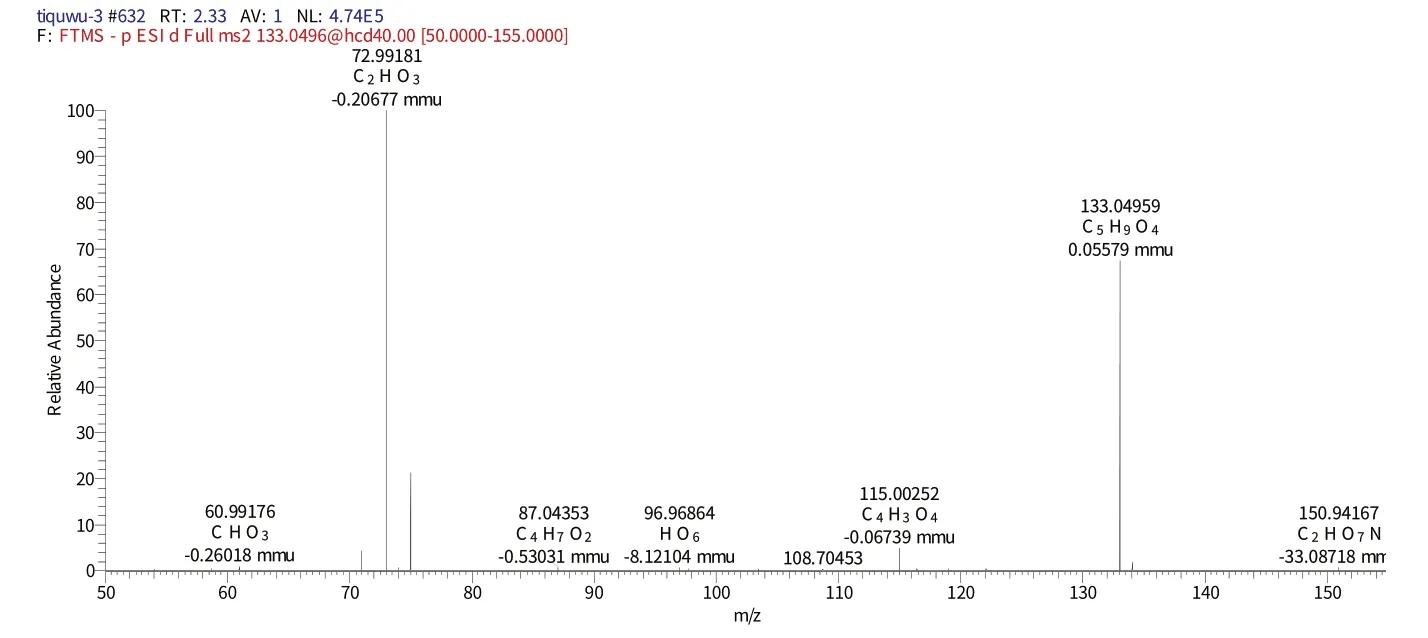
图7 化合物5保留时间2.40 min的二级图谱
2.2.3 西梅果皮游离酚参照“1.2.5”项下条件,采集西梅果皮游离酚的质谱数据,分析其总离子流,正、负总离子流及HPLC图如图8所示。
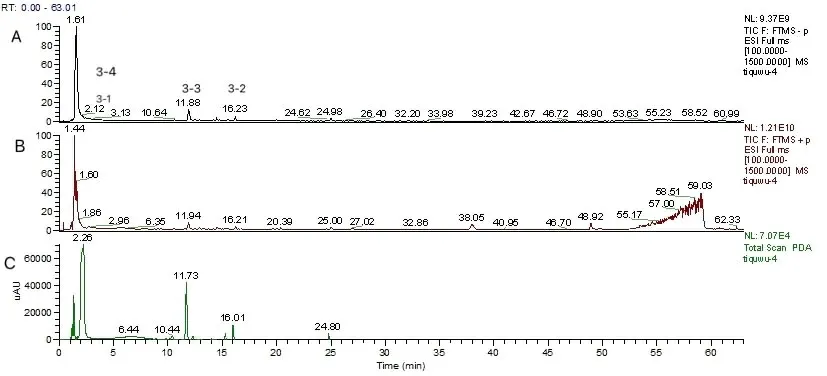
图8 西梅果皮游离酚总离子流图
化合物6 保留时间为2.30 min 时的二级质谱(图9)给出了m/z191的分子离子峰[M-H]-,表明其相对分子质量为192.16700,推测其元素组成为C7H12O6,[MH]-的理论值为191.05300,实测值为191.05337,误差为0.37 mmu,对应的二级谱图中出现在m/z173.04488的[M-H]-、m/z127.03891[M-H]-中伴随着咖啡酸特征碎片离子,结合相关文献[22]推测该化合物为奎尼酸。
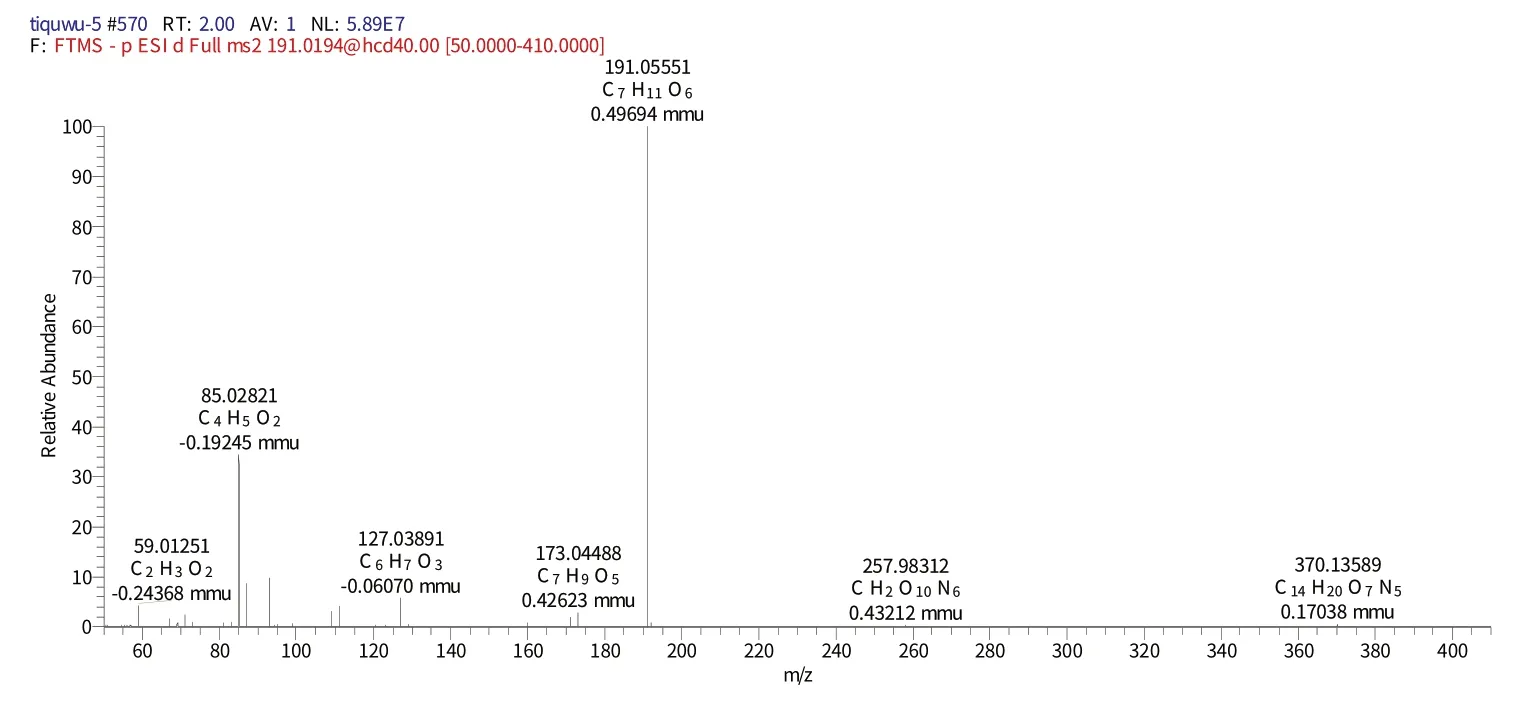
图9 化合物6保留时间2.30 min的二级图谱
化合物7 保留时间为16.23 min时的二级质谱(图10)给出了m/z163 的分子离子峰[M-H]-,表明其相对分子质量为170.120,推测其元素组成为C7H6O5,[MH]-的理论值为163.03892,实测值为163.03880,误差为0.12 mmu,对应的二级谱图中出现在m/z121.02848的[M-H]-、m/z147.04407[M-H-CO2]-中失去碎片离子,结合相关文献[23]推测该化合物为没食子酸。
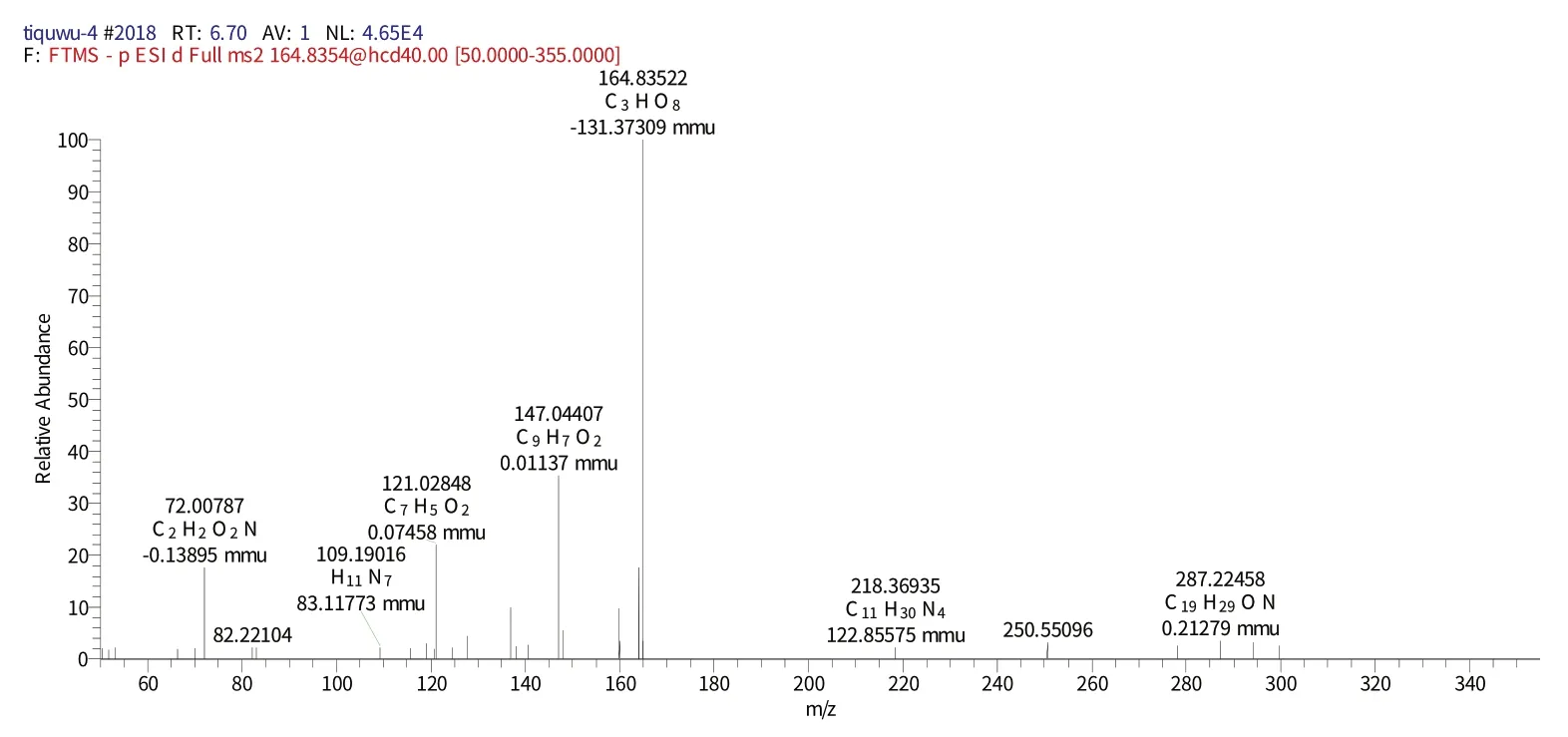
图10 化合物7保留时间16.23 min的二级图谱
化合物8 保留时间为11.08 min 时的二级质谱(图11)给出了m/z163的分子离子峰[M-H]-,表明其相对分子质量为180,推测其元素组成为C9H6O3,[M-H]-的理论值为163.060,实测值为163.0611,误差为0.11 mmu,对应的二级谱图中出现在m/z145.050 的[M-H]-、m/z119.049[M-H]-碎片离子,结合相关文献[20]推测该化合物为草酸。
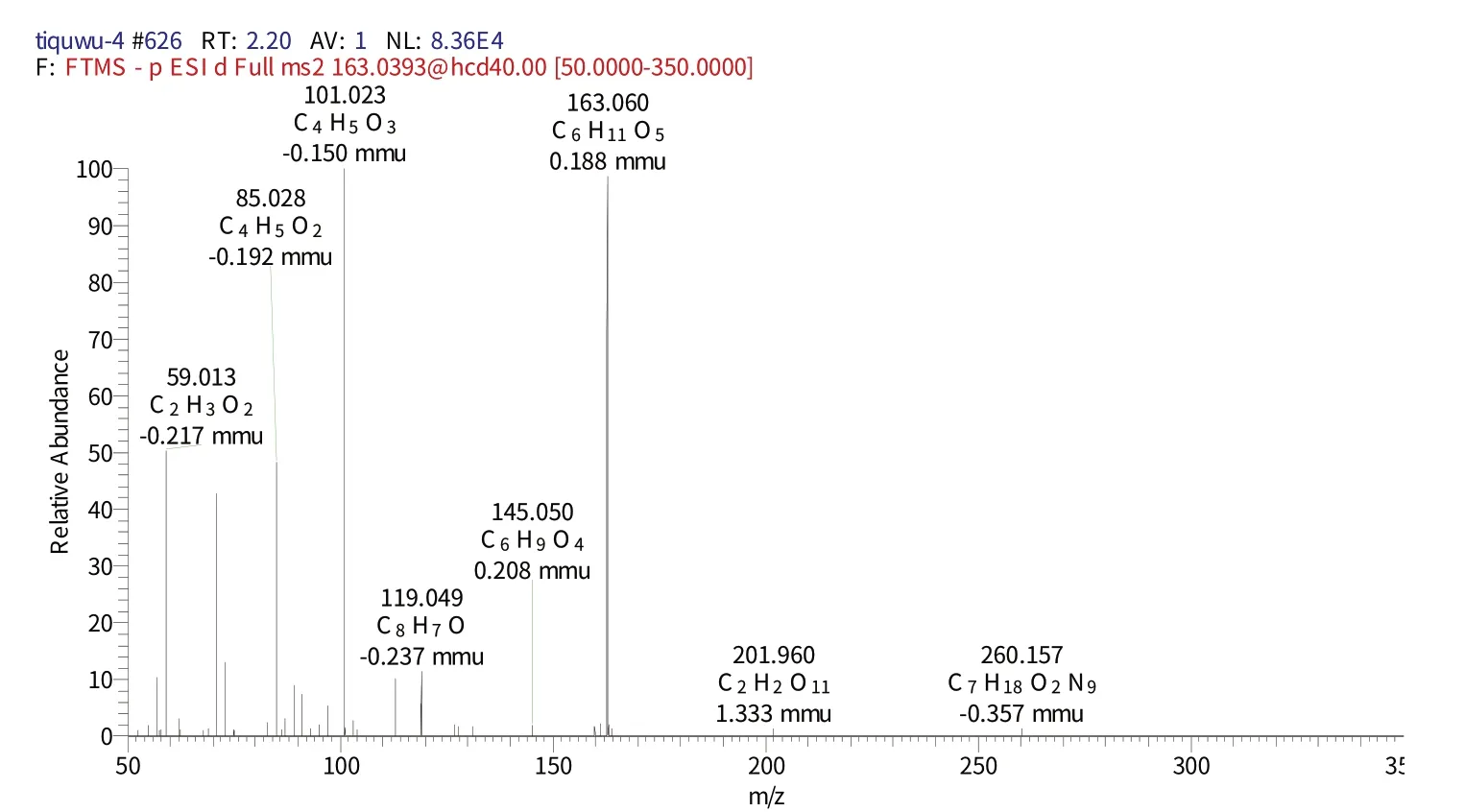
图11 化合物8保留时间11.08 min的二级图谱
化合物9 保留时间为2.40 min 时的二级质谱(图12)给出了m/z131 的分子离子峰[M-H]-,表明其相对分子质量为134.087,推测其元素组成为C4H6O5,[MH]-的理论值为131.02113,实测值为131.01315,误差为0.3898 mmu,对应的二级谱图中出现在m/z87.0435的[M-H]-、m/z115.00252[M-H]-碎片离子,结合相关文献[20]推测该化合物为L-苹果酸。
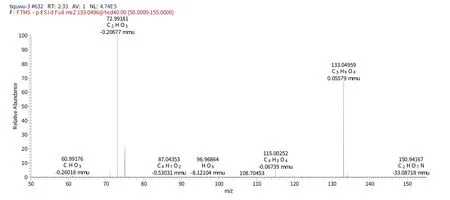
图12 化合物9保留时间2.40 min的二级图谱
2.2.4 西梅果肉游离酚参照“1.2.5”项下条件,采集西梅果肉游离酚的质谱数据,分析其总离子流,正、负总离子流及HPLC图如图13所示。
图13 西梅果肉游离酚总离子流图
化合物10 保留时间为2.30 min时的一级质谱(图14),给出了m/z191的分子离子峰[M-H]-,表明其相对分子质量为152.147,推测其元素组成为C8H8O3,[MH]-的理论值为191.05610,实测值为191.05547,误差为0.13 mmu,对应的二级谱图中出现在m/z85.02821 的[M-H]-、m/z191.05550[M-H]-碎片离子,结合相关文献[21]推测该化合物为香草醛。
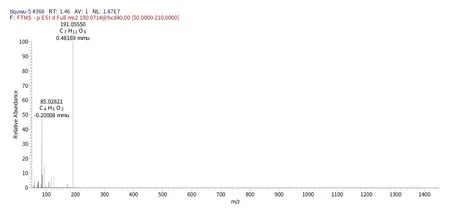
图14 化合物10保留时间2.30 min的二级图谱
化合物11 保留时间为57.07 min 时的一级质谱(图15)给出了m/z205的分子离子峰[M-H]-,表明其相对分子质量为290.268,推测其元素组成为C15H14O6,[M-H]-的理论值为205.0855,实测值为205.0850,误差为0.05 mmu,对应的二级谱图中出现在m/z159.04428的[M-H]-、m/z203.03441[M-H-CO2]-中碎片离子,结合相关文献[24]推测该化合物为(+)儿茶素。
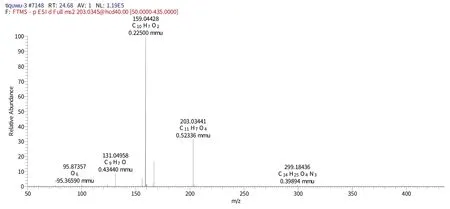
图15 化合物11保留时间57.07 min的二级图谱
2.3 西梅各部位抗氧化活性评价
2.3.1 西梅各部位游离酚及结合酚总还原力的评价从图16 可以看出,随溶液浓度的增加,西梅果肉、果皮、肉皮游离酚和结合酚的还原能力提高。在浓度1.0 mg/mL 时,果肉、果皮、肉皮中的游离酚和结合酚的还原力均比维生素C 小,其中总还原力最强的是果皮游离酚。
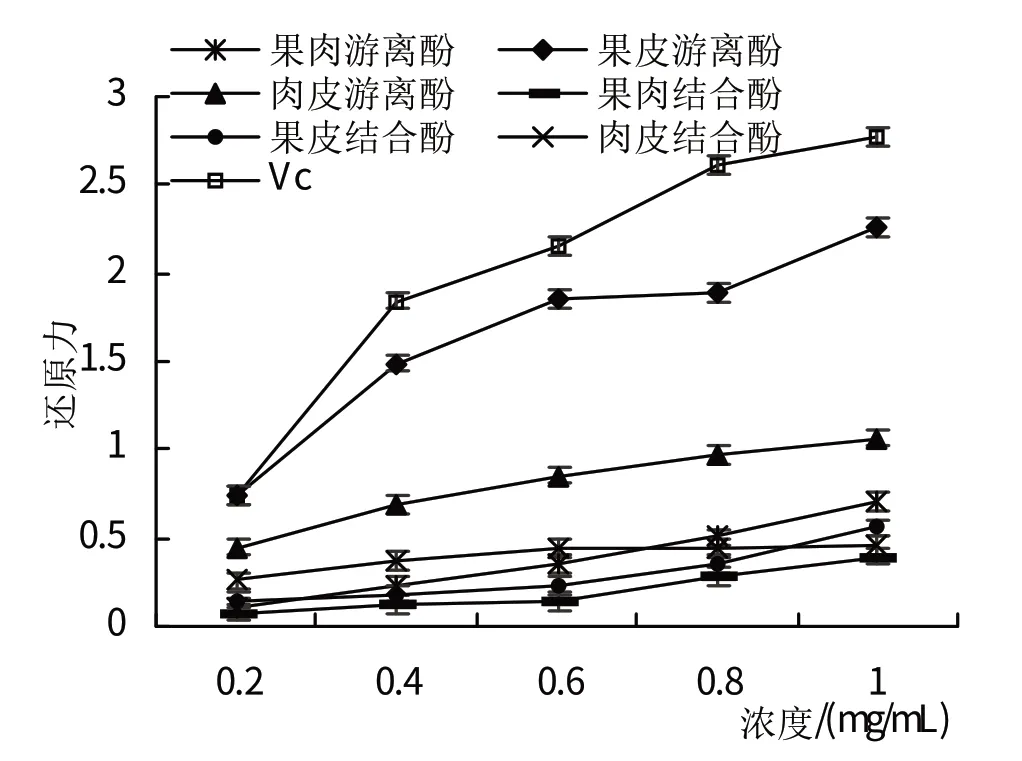
图16 西梅各部位游离酚及结合酚的总还原力
2.3.2 西梅各部位游离酚及结合酚对超氧阴离子自由基的清除作用从图17 可以看出,西梅果肉、果皮、肉皮游离酚及结合酚对超氧阴离子自由基的清除率随浓度升高不断增强,且随着浓度的升高与维生素C的清除率越来越接近。西梅果肉游离酚清除率回归方程为y=48.9x+19.96(R2=0.9228),清除效果IC50为0.61 mg/mL;结合酚清除率回归方程为y=32.33x+23.06(R2=0.9873),清除效果IC50为0.83 mg/mL。西梅果皮游离酚清除率回归方程为y=69.09x+9.01(R2=0.9866),清除效果IC50为0.59 mg/mL;结合酚清除率回归方程为y=34.23x+24.99(R2=0.9535),清除效果IC50为0.73 mg/mL。西梅肉皮游离酚清除率回归方程为y=59.6x+8.73(R2=0.9842),清除效果IC50为0.69 mg/mL;结合酚清除率回归方程为y=50.61x+13.24(R2=0.9588),清除效果IC50为0.73 mg/mL。其中,超氧阴离子清除能力最强的是果皮游离酚。
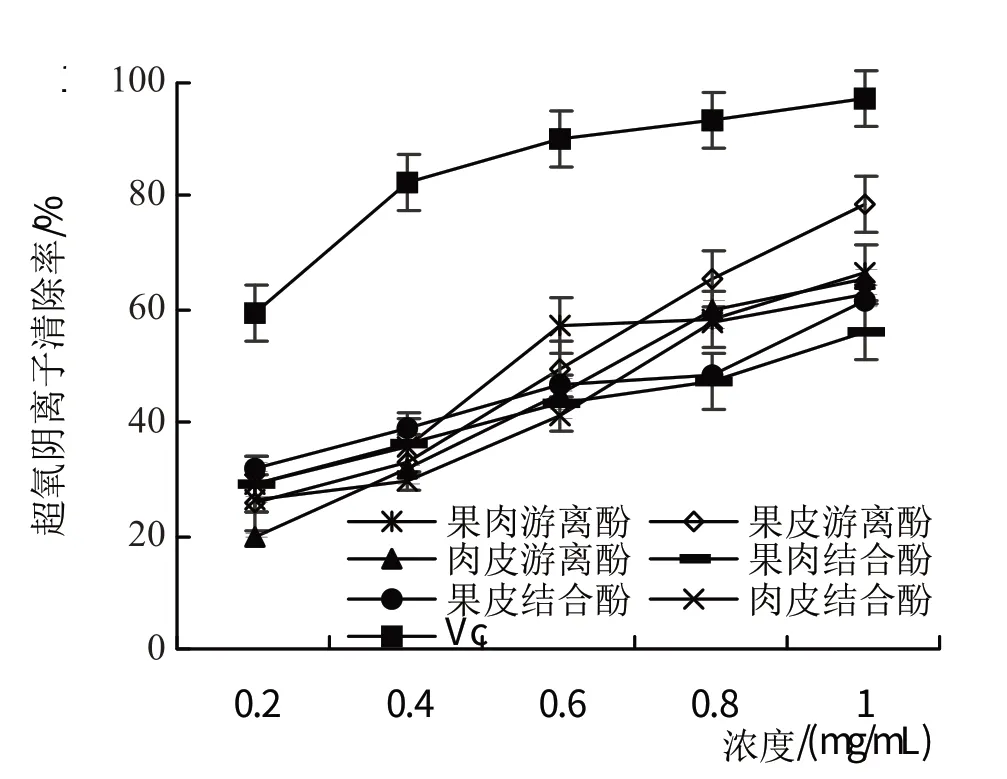
图17 西梅各部位游离酚及结合酚对超氧阴离子自由基的清除作用
2.3.3 西梅各部位游离酚及结合酚对·OH羟基自由基的清除作用从图18 可以看出,·OH 自由基的清除率随着游离酚及结合酚浓度升高而升高。西梅果肉游离酚清除率回归方程为y=51.37x+39.23(R2=0.861),清除效果IC50为0.21 mg/mL;结合酚清除率回归方程为y=70.48x-5.93(R2=0.9719),清除效果IC50为0.79 mg/mL。西梅皮游离酚清除率回归方程为y=46.03x+20.12(R2=0.9961),清除效果IC50为0.65 mg/mL;结合酚清除率回归方程为y=52.96x-5.92(R2=0.9342),清除效果IC50为1.05 mg/mL。西梅肉皮游离酚清除率回归方程为y=49.38x+45.56(R2=0.9406),清除效果IC50为0.09 mg/mL;结合酚清除率回归方程为y=54.61x-5.81(R2=0.9682),清除效果IC50为1.02 mg/mL。其中,羟基清除能力最强的是肉皮游离酚。
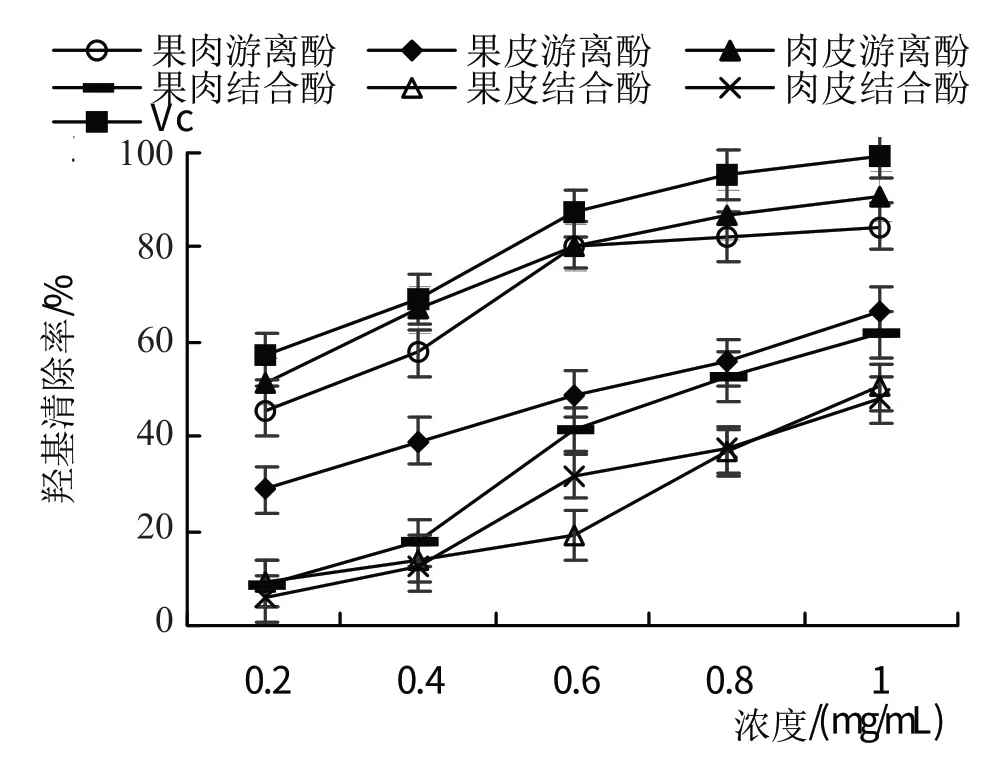
图18 西梅各部位游离酚及结合酚对·OH自由基的清除作用
2.3.4 西梅各部位游离酚及结合酚对DPPH 自由基的清除作用从图19 可以看出,游离酚及结合酚浓度越高,DPPH 清除率越强,表明DPPH 的清除率与溶液浓度呈正有关。西梅果肉游离酚清除率回归方程为y=64.5x+18.5(R2=0.988),清除效果IC50为0.49 mg/mL;结合酚清除率回归方程为y=74.03x-9.55(R2=0.9904),清除效果IC50为0.80 mg/mL。西梅果皮游离酚清除率回归方程为y=84.16x+4.16(R2=0.9642),清除效果IC50为0.54 mg/mL;结合酚清除率回归方程为y=63.56x-10.2(R2=0.9828),清除效果IC50为0.95 mg/mL。西梅肉皮游离酚清除率回归方程为y=57.47x+29.31(R2=0.9849),清除效果IC50为0.36 mg/mL;结合酚清除率回归方程为y=55.08x+1.35(R2=0.9976),清除效果IC50为0.88 mg/mL。其中,DPPH清除能力最强的是肉皮游离酚。
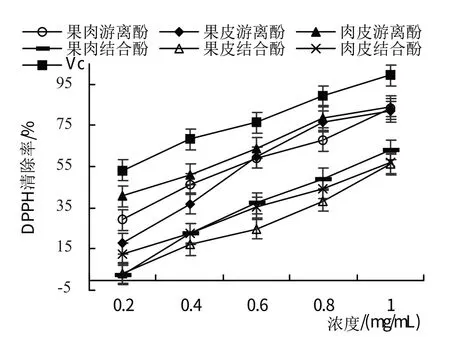
图19 西梅各部位游离酚及结合酚对DPPH自由基的清除作用
3 结论
本研究得到‘法兰西’西梅果皮游离酚和结合酚的多酚含量高于果肉及肉皮。通过对ESI 正、负离子模式下的质谱信息及元素组成分析,共鉴定了9 种化合物,果皮结合酚中有槲皮素-O-葡萄糖、草酸、酒石酸,果肉结合酚中有咖啡酸、L-苹果酸,果皮游离酚中有奎尼酸、没食子酸、草酸、L-苹果酸,果肉游离酚中有香草醛、(+)儿茶素。其中果肉结合酚与游离酚中的咖啡酸是共有成分,果肉结合酚与果皮游离酚中的L-苹果酸是共有成分,果皮结合酚与游离酚中的草酸是共有成分。说明各部位多酚成分有交叉,基本明确了西梅的多酚化学组成。同时,还发现‘法兰西’西梅多酚具有一定的还原力、超氧阴离子自由基、羟基自由基和DPPH 自由基清除能力,说明其具有一定的抗氧化活性。其中西梅果皮抗氧化性最强,肉皮次之。随着多酚浓度的提高,西梅多酚的抗氧化性呈现出上升趋势。当溶液浓度为1.0 mg/mL 时,西梅多酚的超氧阴离子清除率、DPPH 清除率和维生素C 的抗氧化活性差异不大,说明西梅多酚具备良好的体外抗氧化性。
4 讨论
肖星凝等[25]对9种不同品种的李子中游离态及结合态多酚的含量进行比较,发现游离酚含量显著高于结合酚,本研究结果显示,同为李属的西梅中的多酚含量也具有相同的特点。一般植物体内,不溶性的结合酚常与多糖、木质素、细胞壁的聚合物等大分子物质结合[26],因此相较于结合酚,游离酚抗氧化活性与其含量显著相关[27]。西梅中多酚含量丰富,尤其是更易代谢转化的游离态多酚,其作为一种天然抗氧化剂,具有一定的开发价值。本研究得到西梅果皮较果肉具有更高的抗氧化价值及其物质基础,可为西梅果实不同部位使用的功能性以及西梅多酚产品的进一步开发和资源的综合利用提供理论依据。

