葡萄铁还原酶FRO基因的克隆、鉴定与表达模式分析
王建萍,刘万好,隋永超,唐美玲,2,,李进,徐维华,宋志忠,2,5
(1山东省烟台市农业科学研究院,山东烟台 264000;2鲁东大学农林工程研究院,山东烟台 264025;3龙口市农业技术推广中心果树站,山东烟台 265700;4山东省酿酒葡萄与葡萄酒技术创新中心/中粮长城葡萄酒(蓬莱)有限公司,山东烟台 264000;5剑桥大学植物系,英国剑桥 CB2 3EA)
0 引言
铁(Fe)是植物细胞中含量较为丰富的矿物元素之一,作为铁硫蛋白和细胞色素的组成成分,参与植物呼吸作用、光合作用、激素合成、DNA修复和氨基酸与嘌呤代谢等多种生命活动过程[1-4]。果树学中,合理的铁肥施放促进果树生长发育,并与果实品质和产量息息相关,土壤缺铁将阻碍果树的正常生长和发育,特别是石灰性土壤缺铁现象更为明显,造成作物严重减产或品质降低[5-8]。然而,有关果树铁素营养高效与利用的分子基础研究较少。
土壤中的铁多为Fe3+,植物根际对Fe3+的利用微乎其微[5,7-9]。目前,有关植物吸收、转运和分配铁的分子机制研究是植物营养领域的热点,主要集中在拟南芥、水稻等模式植物中[5-6,9],果树作物中的研究鲜少。研究表明高等植物为适应缺铁胁迫而进化出了2种根际铁吸收策略[10]。吸收策略Ⅰ,见于双子叶植物(如拟南芥、番茄等)和非禾本科单子叶植物(如黄瓜等),通过定位于根细胞膜表面的H-ATP酶向根际分泌H+,降低周围土壤pH,促进Fe3+的溶解,并通过铁还原酶FRO(ferric reduction oxidase)将根系周围的Fe3+被还原为Fe2+,再通过Fe2+转运蛋白IRT(ferrous iron transporter)进入根系被植物吸收利用[5-6,9-10];吸收策略Ⅱ,见于小麦、玉米等禾本科植物,通过分泌麦根酸类物质,与根际的Fe3+形成螯合物后,由专门的铁载体PS(phytosiderophore)的方式被根系吸收和利用[5-6,9-11]。
Robinson等[12]最早从拟南芥根中克隆获得AtFRO2基因,将AtFRO2在铁还原酶缺陷的突变体fro互补表达后,缓解低铁胁迫对突变体植株生长的抑制,并检测到互补株系根表面FRO的酶活性逐渐回到正常水平。水稻中已报道2 个在旗叶中高量表达的基因OsFRO1和OsFRO7,其表达水平均受盐、干旱、热、重金属等非生物胁迫的调控,OsFRO1被RNAi干涉后,转基因株系生长受抑制,铁素含量、叶绿素含量和活性氧ROS(active oxygen savaging)清除能力均显著降低[11]。玉米ZmFRO2主要在叶片表达,短期缺铁诱导其在玉米幼苗叶片和根部的表达,在玉米中过表达后显著增强了转基因玉米的产量和各组织部位的铁含量[13]。果树作物中有关FRO家族基因的研究较少,已有报道表明资阳香橙含有5 个FRO 家族基因,在幼苗中的整体表达量差异较大,缺铁胁迫显著诱导CjFRO4在幼苗根中的表达[14];小金海棠MxFRO4和MxFRO6均在根和新叶中高量表达,并受NaCl、缺铁和高铁胁迫的调控[15]。
葡萄(Vitisvinifera)是一种全球重要的水果,基因组序列已公布[16]。然而,葡萄FRO家族基因的生物学功能依然未知。笔者从‘烟酿1号’中鉴定葡萄FRO家族基因,并通过实时荧光定量PCR分析其组织特异性表达模式,及其在转录水平对等缺铁、高铁毒害、ABA、PEG、NaCl、低温和高温等非生物胁迫的响应特征,为研究果树的铁吸收与转运机制提供理论依据。
1 材料与方法
1.1 试材与采样
本研究所用的5年生‘烟酿1号’成年葡萄果实和叶片材料由山东省烟台市农业科学研究院葡萄资源圃提供,树体健壮,南北行向,常规田间管理。参照张璐等[17]描述,2021 年分别于特定日期采集不同发育时期的果实(幼果期为6月30日,硬核期为7月15日,转色期为8 月5 日,第二次膨大期为8 月20 日,成熟期为9月20日)和叶片(幼叶为6月30日,老叶为9月20日),迅速用液氮处理并置于-80℃冰箱保存备用。
胁迫实验的供试材料为鲁东大学园艺作物遗传改良创新团队提供的‘烟酿1 号’组培脱毒幼苗,所用培养基为1/2MS 固体培养基,组培室温度为(25±1)℃,湿度70%,光照3000 lx,培养2 个月的组培苗先进行3 d 的炼苗处理,然后转移至1/2MS 培养液中培养。以1/2MS 液体培养基作为对照条件,根据Song 等[18]和李又欢等[19]描述,对‘烟酿1 号’组培幼苗分别设置缺铁(0 mmol/L FeNa-EDTA)、高铁(500 μmol/L FeNa-EDTA)、ABA(200 μmol/L)、PEG6000(10% ,w/v)、NaCl(200 mmol/L)、低温(4℃)和高温(45℃)胁迫,处理48 h后,采集根部材料用于转录水平的表达差异分析。
1.2 葡萄FRO家族基因的筛选与克隆
以8 个拟南芥FRO基因的氨基酸序列为参考[9,20],在Phytozome葡萄基因组数据库(http://www.phytozome.net)中检索葡萄中潜在的FRO家族蛋白(VvFRO),并利用Pfam 在线服务器(http://pfam.xfam.org/search)验证VvFRO 蛋白的功能结构域。根据获得的葡萄VvFRO基因的编码区CDS(coding sequence)序列,设计上下游引物(表1),利用高保真聚合酶Prime STARTMHS DNA试剂盒(TaKaRa,大连)进行PCR 扩增,并委托生工生物工程(上海)股份有限公司进行测序验证。

表1 CDS扩增所用上下游引物序列
1.3 葡萄FRO基因及其编码蛋白的特征分析
在Phytozome 葡萄基因组数据库(http://www.phytozome.net)下载VvFRO家族基因的CDS 及基因组DNA 序列,借助Gene Structure Display(http://gsds.cbi.pku.edu.cn/index.php)分析VvFRO的基因结构;利用ProtParam(http://expasy.org/tools/protparam.html) 分析VvFRO蛋白的理化性质,包括理论等电点、分子量、稳定性等,分别借助MEME v4.8.1(https://meme-suite.org/meme/tools/meme)、PSORT(http://psort.hgc.jp/form.html)、TMpredict(http://ch.embnet.org/software/TMPRED_form.html)、SignalP4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/) 和 Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)在线服务器分别预测VvFRO 蛋白的保守结构域、亚细胞定位、跨膜结构域、信号肽和三级结构。借助Clustal X 2.0软件对VvFRO蛋白与拟南芥(7 个,AtFRO1~AtFRO7)、水稻(2 个,OsFRO1 和OsFRO2)、玉米(1 个,ZmFRO2)、番茄(1 个,SlFRO1)、大豆(1 个,GmFRO2)、落花生(2 个,AhFRO1 和AhFRO2)、小金海棠(2个,MxFRO4 和MxFRO6)、蒺藜苜蓿(4个,MtFRO1和MtFRO2~MtFRO4)、资阳香橙(5个,CjFRO1~CjFRO5)等已报道植物FRO 同源蛋白进行氨基酸序列一致性分析,通过MEGA 13.0 软件中的最大相似法(maximum likelyhood method)构建植物FRO蛋白的统进化树;在葡萄基因组数据库下载VvFRO各基因起始密码子ATG 上游2 kb 的启动子区域,通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测VvFRO启动子区域可能存在的cis-顺式作用元件。
1.4 实时荧光定量PCR分析
分别采集‘烟酿1 号’发育不同时期的组织材料,通过MiniBEST Plant RNA Extraction Kit(TaKaRa,大连)提取葡萄各组织的总RNA,借助PrimeScriptTM RT reagent Kit(TaKaRa,大连)反转录获得第一链cDNA。设计VvFRO各基因的特异性表达引物(表2),以葡萄Ubiquitin[17,21-23]作为内参基因,以荧光染料SYBR Green(TaKaRa,大连)作为标记,利用实时荧光定量PCR仪(ABI 7500,Applied Biosystems,USA)检测VvFRO在不同组织中的表达模式及其在转录水平对不同非生物胁迫的响应特征。利用ABI 7500PCR 仪记录不同反应的Ct值,经内参基因Ubiquitin均一化处理后,采用2-ΔΔCt法计算VvFRO的相对表达量,每个样品进行3次生物学反应,每个反应3次技术重复[17,19,21-23]。

表2 研究所用的特异性引物序列
2 结果与分析
2.1 葡萄FRO家族基因的筛选与克隆
以拟南芥铁还原酶AtFRO 的氨基酸序列为参考[9,20],在葡萄基因组数据库中检索到6 个潜在的葡萄FRO 家族蛋白,下载葡萄FRO各基因的CDS 电子序列,利用高保真酶扩增‘烟酿1 号’葡萄FRO各基因CDS(图1 和表3),测序验证后分别命名为VvFRO1-VvFRO6,其编码蛋白均预测到FAD 结合区域(FADbinding site)、NADPH结合区域(NADPH-binding site)和氧化还原辅酶结合区(oxidoreductase signature)功能结构域(图2),均属于典型的铁还原酶家族蛋白。
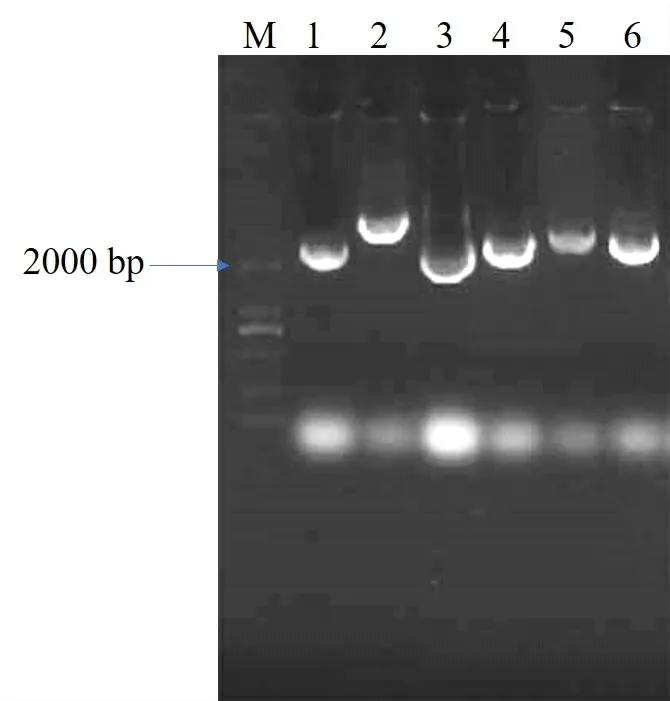
图1 VvFRO家族基因CDS扩增

图2 VvFRO家族蛋白氨基酸序列比对
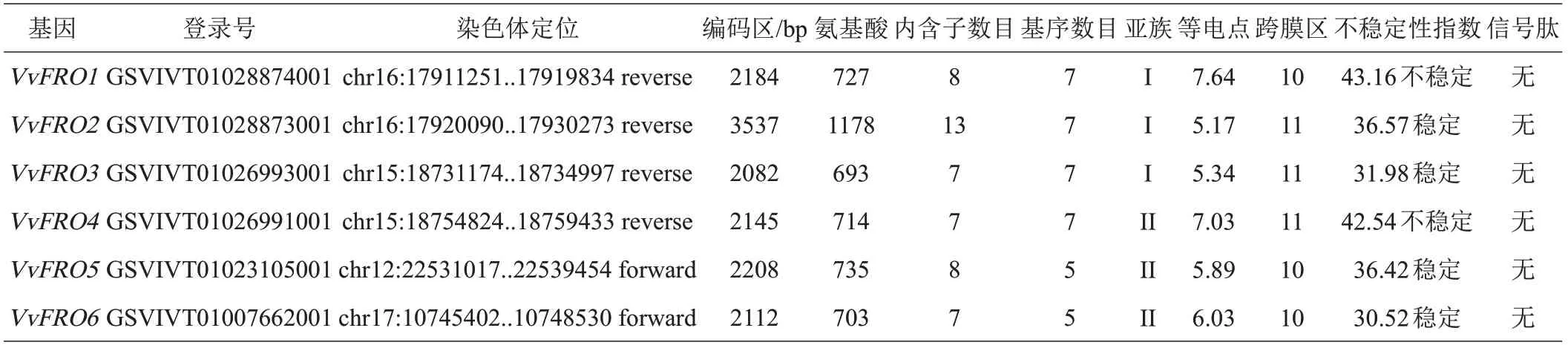
表3 VvFRO基因及编码蛋白基本信息
2.2 植物FRO同源蛋白的系统发育树
分别下载葡萄(葡萄科)、资阳香橙(芸香科)、小金海棠(蔷薇科)、拟南芥(十字花科)、番茄(茄科)、蒺藜苜蓿(豆科)、落花生(豆科)、大豆(豆科)、水稻(禾本科)和玉米(禾本科)等植物FRO同源蛋白的序列。氨基酸序列一致性比对结果表明,10 种不同科属植物FRO 蛋白之间具有较高的同源性,在氨基酸水平的一致性为43.66%(数据未展示),同源关系较近的两者之间的序列一致性均高于67.35%。此外,6个VvFRO 蛋白在氨基酸水平的一致性为51.62%(图2),在核苷酸水平的一致性为48.65%。
系统发育树结果(图3)表明,10 种不同科属植物FRO家族蛋白可分为Group I和II 2个亚族,其中,葡萄VvFRO1~VvFRO3 属于Group I,而葡萄VvFRO4~VvFRO6 属于Group II(图3)。此外,10 种植物FRO家族蛋白在遗传进化关系上有差异,相较于其他8 种植物,葡萄FRO倾向于和资阳香橙和小金海棠同源蛋白的遗传进化距离更近,如VvFRO1 和VvFRO4 分别与CjFRO1 和CjFRO5 紧密聚集在一起,VvFRO6 与CjFRO3 和CjFRO4 紧密聚在一起,而VvFRO2 和VvFRO3 与MxFRO6 均紧密聚集在一起;大豆(GmFRO2)、蒺藜苜蓿(MtFRO1)和落花生(AhFRO1、AhFRO2)同属于豆科植物,其FRO 同源蛋白倾向于紧密地聚在一起,而禾本科水稻(ZmFRO2)和玉米(OsFRO1)的同源蛋白在遗传距离上也是最近的。
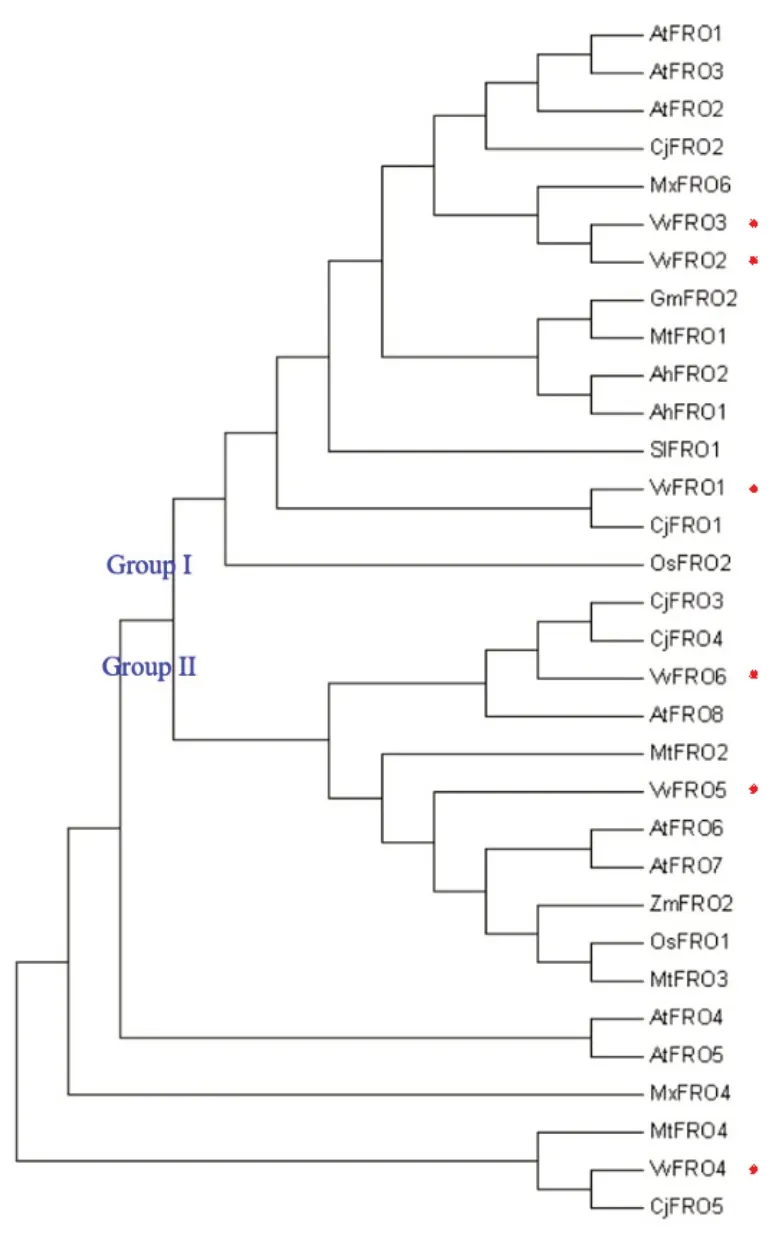
图3 植物FRO同源蛋白系统发育树
2.3 葡萄FRO家族基因及编码蛋白特征分析
VvFRO基因主要定位于12 号(VvFRO5)、15 号(VvFRO3、VvFRO4)、16 号(VvFRO1、VvFRO2)和17 号(VvFRO6)染色体上(表3),均至少含有7个长度不一的内含子(图4 和表3)。保守基序分析结果表明VvFRO1~VvFRO4 含有所有Motif 基序(Motif 1~7),VvFRO5和VvFRO6仅含有5个Motif基序,缺失Motif 6和Motif 7(图4和表3);VvFRO1的等电点PI>7.00,含有的碱性氨基酸较多,VvFRO4 的等电点PI≈7.00,为中性蛋白,而其他4 个成员(VvFRO2、VvFRO3、VvFRO5、VvFRO6)的等电点PI均小于7.00,含有酸性氨基酸较多;VvFRO蛋白含有10或11个跨膜区,且均不含有信号肽;VvFRO1和VvFRO4的不稳定指数大于40,为不稳定蛋白,而其他4 个VvFRO 的不稳定指数均小于40,为稳定蛋白(表3)。此外,葡萄VvFRO 蛋白具有相似的蛋白质三级结构(图5)。
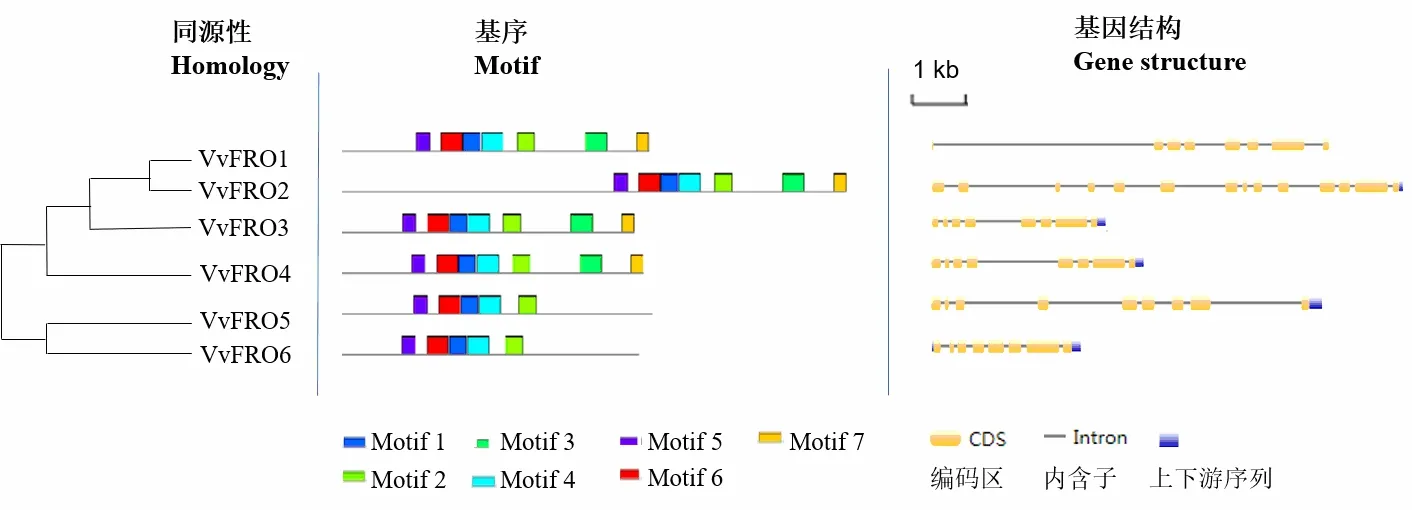
图4 葡萄FRO家族蛋白Motif和基因结构分析

图5 葡萄FRO家族蛋白三级结构预测
2.4 VvFRO启动子cis-顺式作用元件预测
在VvFRO基因启动子区域至少鉴定到了11 种cis-顺式作用元件,包括激素响应、胁迫响应和昼夜规律等不同生物功能或代谢途径的调控元件,且不同VvFRO启动子中的顺势作用元件数量差异显著(表4)。其中,2种转录元件(光感应和脱落酸ABA 响应)在全部6 个VvFRO的启动子区域中均能检测到,在5个VvFRO启动子区域检测到响应热胁迫(除VvFRO3)和赤霉素(除VvFRO5)的顺式作用元件,在4 个VvFRO的启动子区域检测到响应干旱诱导、厌氧感应和生长素的顺式作用元件,在3个VvFRO的启动子区域检测到响应防御与胁迫、低温感应和昼夜规律的顺式作用元件,在VvFRO2的启动子区域鉴定到2 个乙烯响应有关的作用元件(表4)。
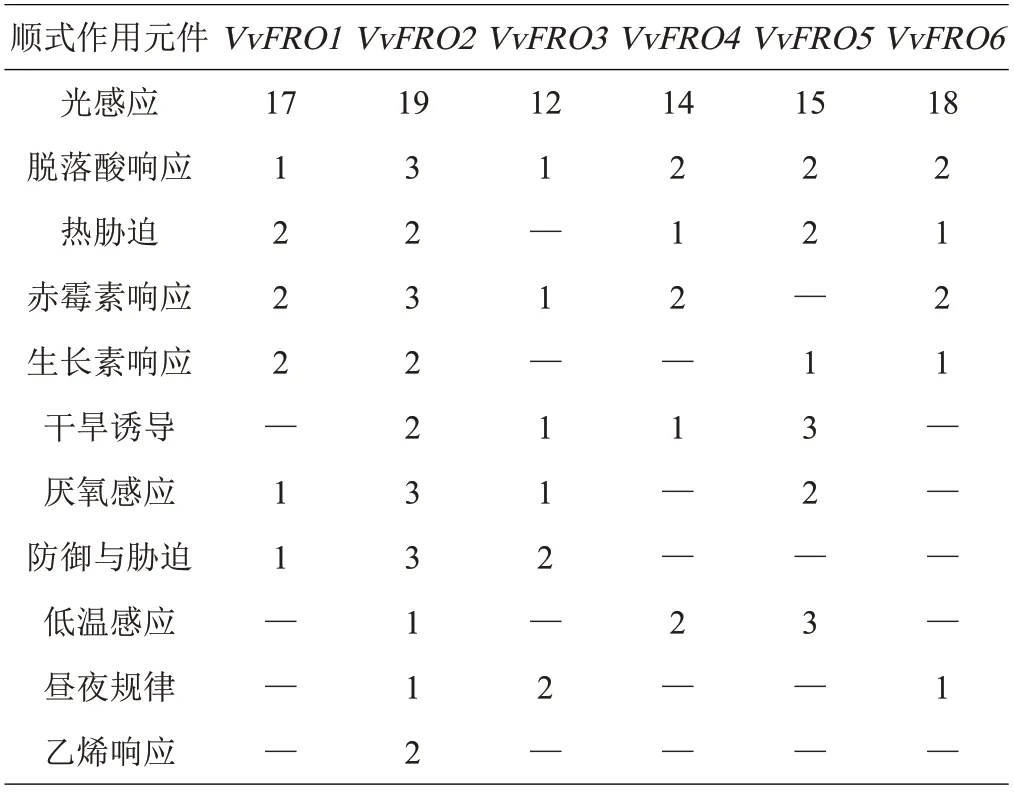
表4 启动子顺式作用元件分析
2.5 VvFRO亚细胞定位预测
亚细胞定位预测结果表明,VvFRO 蛋白主要定位于细胞质膜,其次是内质网膜(VvFRO2 和VvFRO6 除外)、液泡膜(VvFRO2 和VvFRO4 除外)和线粒体(VvFRO2 和VvFRO3 除外),VvFRO2 和VvFRO3 分别在叶绿体和细胞核上也有少量分布(表5)。
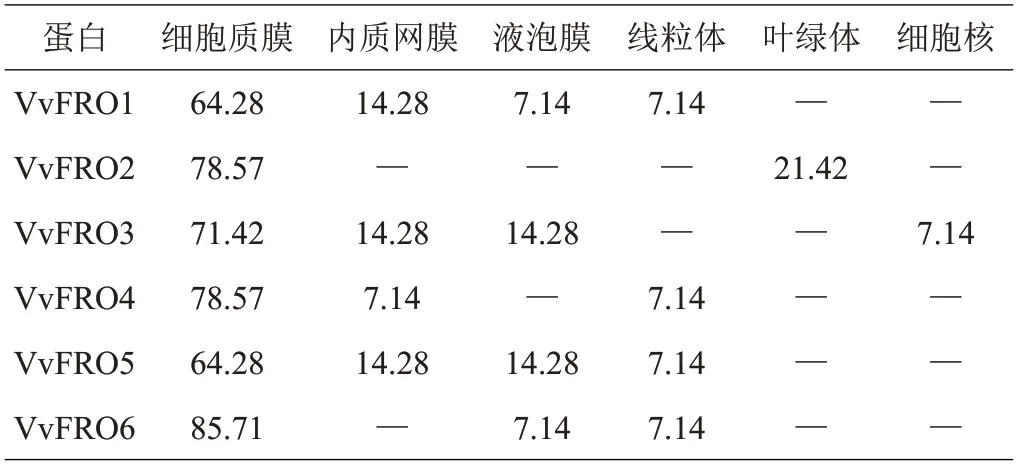
表5 葡萄FRO家族蛋白的亚细胞定位预测 %
2.6 VvFRO表达模式分析
荧光定量PCR 分析结果表明,VvFRO1~VvFRO6在‘烟酿1号’成年树体和幼苗不同组织中的表达量存在差异(图6)。其中,VvFRO3在不同组织中的整体表达水平最高,且在成年树体1 年生幼叶和幼苗叶片中的表达量较高,远高于其他组织;VvFRO2的表达特征与VvFRO3类似;VvFRO5在硬核期和转色期果实中的表达量较高,远高于其他组织;而其他3 个基因(VvFRO1、VvFRO4、VvFRO6)在葡萄不同组织中的整体表达水平相对较低(均小于0.1且较为接近)。
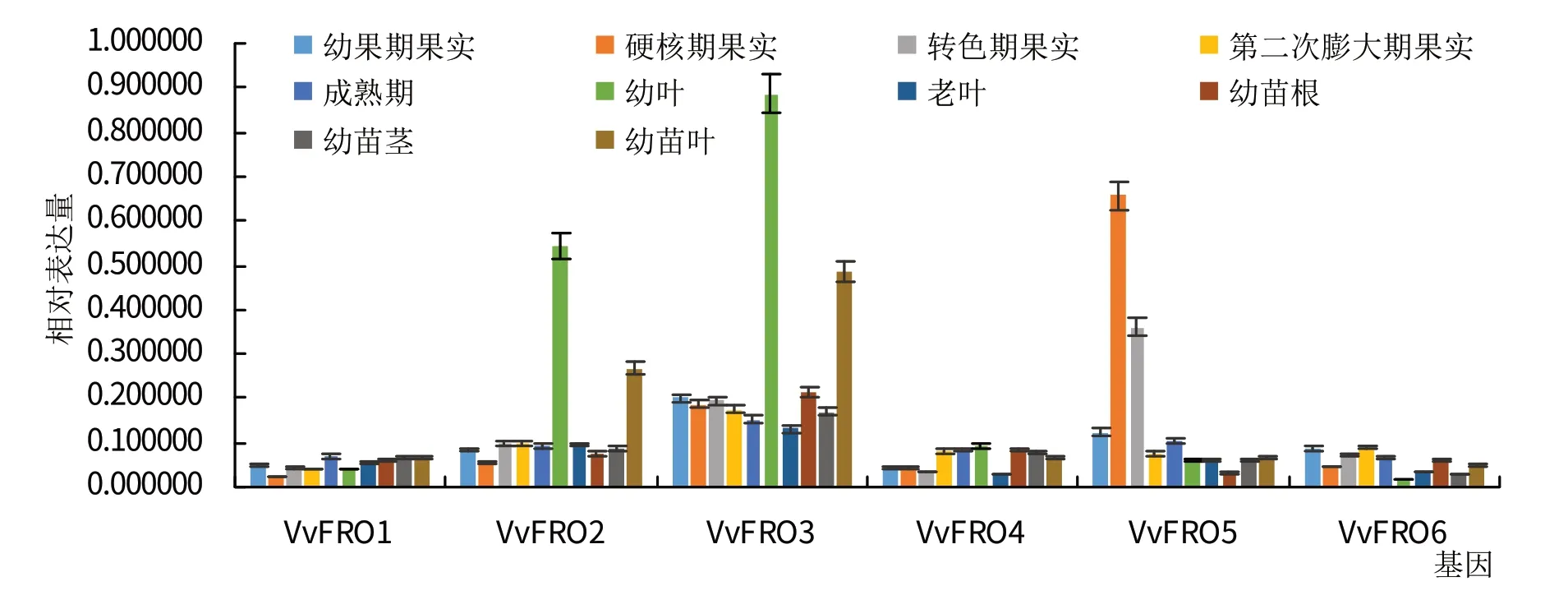
图6 VvFRO组织特异性表达分析
2.7 VvFRO对非生物胁迫的相应差异
荧光定量PCR分析结果(图7)表明,在转录水平,VvFRO1~VvFRO6在‘烟酿1 号’幼苗根部对7 种不同非生物胁迫的响应情况存在差异。葡萄FRO家族基因对缺铁和NaCl胁迫最为敏感,除VvFRO6外,其他5个FRO基因在根部的表达量均受缺铁和NaCl 处理的诱导而显著增加;3 个基因(VvFRO1、VvFRO3、VvFRO5)在根部对PEG 处理较为敏感,其表达量显著增加;仅有VvFRO3对ABA处理有响应,其在根部的表达量显著被诱导而上调,此外,也仅有VvFRO3对铁毒害有响应,其在根部的表达量显著被抑制而降低;然而,葡萄FRO家族基因对温度变化不敏感,其表达量在低温(4℃)和热(45℃)胁迫条件下均没有显著变化。特别地,3 个(VvFRO1、VvFRO3、VvFRO5)基因在根部的表达易受外界非生物胁迫的调控,在转录水平至少对3 种处理有响应,其中,VvFRO3在葡萄中的整体表达量最高,且对5 种胁迫处理(除了低温和热胁迫之外)均有响应;虽然VvFRO6的整体表达量相对较低,但其表达最为稳定,且在转录水平对本研究设置的7种胁迫条件均没有任何响应。
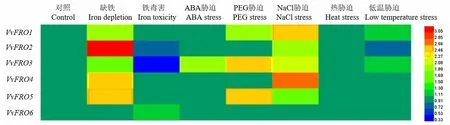
图7 VvFRO对非生物胁迫的响应情况
3 讨论
铁在果实品质形成方面发挥重要作用,并与果实产量密切相关,然而,果树中铁吸收与转运相关基因的生物学功能依然未知。葡萄属于双子叶植物,其根际对铁的吸收属于策略I[5-6,9,24-25],有关葡萄铁吸收与转运的分子机制尚未见报道。本研究从葡萄中克隆并鉴定了6 个铁还原酶FRO 编码基因(图2),数量略低于拟南芥(8 个)同源基因的数量[9,20],暗示同一家族的基因数目在不同的科属植物之间存在差异。此外,不同的科属植物FRO同源蛋白在遗传进化关系上存在差异,相较于其他禾本科、豆科、茄科和十字花科植物,VvFRO 倾向于和资阳香橙和小金海棠等多年生木本果树同源蛋白的遗传进化距离更近(图3),暗示木本果树铁还原酶可能具有相似或相近的生物学功能。在6个VvFRO 蛋白中,VvFRO1~VvFRO3 同属于Group I,且拥有相似的Motif基序和高级蛋白结构,暗示同一亚族且进化关系上相近的铁还原酶FRO 之间可能具有相似的生物学功能,仍需进一步的实验证实。此外,同属于Group II 的VvFRO5 和VvFRO6 具有一致的Motif基序,且比Group I成员少了2个特征Motif基序(图4),暗示其生物学功能可能与Group I成员存在差异,这些结果表明同一家族的铁还原酶FRO 不同成员之间虽然遗传关系相近,但在长期进化关系中可能发生了功能差异的演变。
研究表明水稻OsFRO1主要定位于细胞质膜上[11],本研究中亚细胞定位预测表明VvFRO 蛋白主要分布在细胞质膜上(表5),与水稻中的报道相一致。已有研究表明,水稻OsFRO1和OsFRO7[11]、玉米ZmFRO2[13]、小金海棠MxFRO4和MxFRO6[15]、资阳香橙CjFRO1[14]均在叶片中高量表达,与之相一致的是,本研究发现VvFRO2和VvFRO3成年树体1 年生幼叶和幼苗叶片中高量表达,其表达水平是其他检测组织中的2~4 倍(图6),再次印证植物FRO 家族基因在植物叶片中铁素的吸收与转运过程中发挥重要作用。此外,有关FRO基因在果实中的表达特征情况未见报道,本研究发现VvFRO5在硬核期和转色期果实中高量表达(远高于其他检测的组织),暗示该基因可能在硬核形成至转色的这一关键发育时期参与果实中的铁素动态平衡。
前人研究表明,OsFRO1和OsFRO7在转录水平的表达受盐、干旱、热、重金属等非生物胁迫的调控[11],小金海棠MxFRO4和MxFRO6受NaCl胁迫的调控[15]。本研究在VvFRO启动子区域鉴定到多种顺式作用元件,且均含有ABA 响应和光感应的顺式作用元件(表4),表明这2 种作用元件倾向于与VvFRO启动子区域的关键位点相结合,进而调控VvFRO的转录或表达。特别地,水稻OsFRO7在转录水平易受ABA处理的诱导,可能参与水稻响应和调节渗透作用,而OsFRO1在转录水平对ABA没有响应[11],本研究中VvFRO启动子区域均含有ABA 响应的作用元件,然而,本研究中仅有VvRFO3在根部受ABA 处理诱导而显著增高,暗示该基因可能参与或响应渗透调节,为进一步研究葡萄铁还原酶FRO 的生物学功能及其调控机理提供理论参考。此外,VvFRO2-5的启动子区域均鉴定到响应干旱诱导的顺式作用元件,VvFRO1、VvFRO3和VvFRO5在根部受PEG 处理的诱导而显著上升(图7),初步暗示了这3个基因倾向于参与葡萄对干旱胁迫的响应机制,仍需后续的实验证实。
此外,本研究表明VvFRO在转录水平受不同铁素供应水平的调控,特别是对缺铁处理较为敏感,除VvFRO6外,其他5个基因在根部均受缺铁诱导而增强(图7),推测葡萄FRO 家族基因在缺铁胁迫条件下更倾向于被诱导表达,以便最大限度地发挥铁还原酶的活性,进而维持葡萄根部铁吸收和转运功能以保障基本的依赖于铁的生命活动,FRO 家族因表达水平的增高可能是葡萄响应环境缺铁的信号之一。特别地,VvFRO3在‘烟酿1 号’不同组织中的整体表达水平最高,其在根中的表达量约为其他5个VvFRO基因的3~7倍,且在根部受高铁毒害处理的抑制而显著降低(约3倍),受缺铁胁迫的诱导而显著增加(约1.7倍),暗示该基因可能是葡萄树体中具有较强活性的铁还原酶蛋白,其活性直接受外界铁素供应水平的调控,这些结果与拟南芥[20]、玉米[13]、资阳香橙[14]和小金海棠[15]中有关FRO基因响应铁素供应水平的报道一致。虽然VvFRO6在‘烟酿1 号’不同组织中的整体表达水平较低,但其在根部不受本研究设定的7 种胁迫处理的影响,暗示VvFRO6可能在葡萄树体中持续、稳定地发挥铁还原酶的活性,进而有效地参与葡萄对铁的吸收和转运过程。此外,葡萄属于温带果树作物,在热带地区或寒冷地区的生长适应性相对很差,本研究发现VvFRO在根部的表达水平均不受低温(4℃)或热处理(45℃)的影响,暗示葡萄VvFRO的表达不易受外界温度变化的影响,在不利温度环境条件下依然可以稳定发挥活性,进而保障葡萄树体一些必需铁的代谢途径或生命活动,以适应或耐受不利温度胁迫对葡萄生长的影响。

