耐锑白腐真菌的筛选及其吸附特性的研究
望婷,陈奕凡,王剑桥*
(1.广东增源检测技术有限公司,广东广州 511453;2.广州大学 环境科学与工程学院,广东广州510006)
锑(Sb)位于元素周期表中第5 周期VA 族,原子序数为51,相对原子质量为121.75 g/mol,是一种类金属元素。大气、水体、土壤和植物体中的锑通过皮肤接触、呼吸、食物链等途径进入生物体内累积富集,进而对机体造成毒害作用。锑的毒理性质与类金属砷相似,单质比化合物毒性强,无机锑比有机锑毒性强,Sb(Ⅲ)化合物毒性是Sb(Ⅴ)化合物的10 倍多[1]。何孟常等在锑对水稻生长影响的实验中发现,经过高浓度锑处理的水稻植株出现生长矮小,叶片发黄等明显发育不良的症状[2]。BRIEGER 等在研究三硫化锑对小鼠的毒性实验中发现,三硫化锑会导致小鼠出现心脏退化、体重下降、肺间隙发炎等症状[3]。对于人体,由于锑与蛋白质的巯基(-SH)具有很强的亲和力,在人体内结合后抑制了某些巯基酶(如琥珀酸氧化酶)的活性,干扰体内蛋白质及糖类的代谢,损害肝脏、心脏及神经系统,还会对黏膜产生刺激作用[4]。锑的急性中毒会导致出现肚子痛、呕吐、脱水、肌肉痛、抽筋等症状,甚至能够引起肝硬化、肌肉坏死、肾炎和胰腺炎等[5]。由于锑的高毒性和致癌性以及对环境造成的各种危害,被世界卫生组织(WHO)和多个国家列为优先控制的污染物,并制定了各类标准,如WHO 对锑的饮用水限制浓度为20 μg/L、美国国家环境保护局(USEPA)规定限量为6 μg/L、德国为5 μg/L、日本为2 μg/L、中国为5 μg/L[6]。
过去数十年,锑被广泛应用于半导体、聚乙烯苯二酸盐(PET)、刹车片、弹药、阻燃剂和医药等行业,我国是世界上最主要的产锑国,约占世界锑产量的87%[7]。随着锑矿的大规模开采以及锑的大量使用,大量锑进入到环境中,湖南锡矿山锑矿北矿区地下水中的锑最大含量已达22 980 μg/L[6],在北极冰心中也检测到了锑的存在[8],锑污染修复成为急需解决的问题。
白腐真菌是一类能使木材呈白色腐朽的丝状真菌的统称,在分类学上主要属于担子菌,少数为子囊菌,是目前已知的唯一一类能够将木质素完全降解为CO2和H2O 的微生物。已知的白腐真菌有一千多种[9],包括栓菌属(Trametes)、平革菌属(Phanerochaete)、侧耳菌属(Pleurotus)、香菇属(Lentinnula)、射脉菌属(Tremellosus)等,常见品种包括黄孢原毛平革菌(Phanerochaetechrysosporium)、射脉菌(Phlebia radiate)、平菇(Pleurotusostreatus)等。白腐真菌不仅对木质素有良好的降解能力,也能降解多种异生型化合物,包括芳香族化合物、多环芳烃、氯代芳烃、非芳香族的氯化物以及天然的生物高聚物[10]。由于降解底物范围广泛,白腐真菌在环境治理中具有极大的潜力,如污染土壤修复、造纸工业废水处理和生物漂白过程等[11]。
本研究首先从实验室中存有的菌种中筛选出耐锑的白腐真菌,利用耐锑白腐真菌对锑进行吸附,并进一步研究其吸附特性,探讨白腐真菌对重金属锑污染修复的可行性,为防治锑污染的微生物修复提供理论基础和科学依据。
1 材料与方法
1.1 仪器与材料
酒石酸锑钾(纯度≥98%),上海阿达马斯试剂有限公司;马铃薯葡萄糖琼脂(PDA)培养基,美国BD 公司;马铃薯葡萄糖液体培养基(PDB),美国BD公司;0.1 mol/L NaOH 溶液(纯度≥97%)、0.1 mol/L HCl 溶液(纯度≥95%)、2% KBH4(0.5% NaOH 介质,纯度≥99%)、硫脲(纯度≥99%)、抗坏血酸(纯度≥99%),上海阿拉丁生化科技股份有限公司。
GF54DA 高压蒸汽灭菌锅,致微(厦门)仪器有限公司;TLE104 电子分析天平,梅特勒-托利多国际贸易(上海)有限公司;BSC-1360IIA2 超净工作台,北京东联哈尔仪器制造有限公司;BPC-150F 恒温培养箱,上海一恒科学仪器有限公司;Coolsafe 110-4L真空冷冻干燥机,丹麦Scanvac 公司;AFS-9780 原子荧光光谱仪,北京海光仪器有限公司。
白腐真菌为黄孢原毛平革菌(P.chrysosporium)、白囊耙齿菌(Irpexlacteus)、污原毛平革菌(P.sordida)YK-624 菌株,来自美国标准菌种保藏中心和中国普通微生物菌种保藏管理中心。
1.2 实验方法
1.2.1 白腐真菌筛选试验
配置浓度为0 mg/L、500 mg/L、1 000 mg/L、2 000 mg/L、3 000 mg/L、4 000 mg/L 和5000 mg/L 的锑溶液,加入PDA 培养基中,121 ℃灭菌15 min,分装培养基,待培养基冷却后分别接种三种白腐真菌,生化培养箱中30 ℃恒温培养,每隔12 h 观察生长情况,测量菌落直径。
菌落直径测量方法:首先选取菌落任意位置测量其直径,然后逆时针旋转60°再次测量其直径,最后再逆时针旋转60°进行第三次测量,取平均值。
1.2.2 白腐真菌P. chrysosporium 的吸附试验
进一步探究白腐真菌在不同条件下对锑的吸附效果,进行液体培养基中的吸附实验。配置PDB 培养基,分装后121 ℃灭菌15 min,将P.chrysosporium接种到PDA 培养基预培养2 d 后,与PDB 培养液一起倒入组织捣碎机,打碎20 s 后将菌液倒回原来含PDB 的锥形瓶中,将接种后的锥形瓶放入恒温振荡培养箱里,在30 ℃、150 r/min 的条件下恒温振荡培养5 d。
(1)锑的初始浓度对吸附效果的影响。配制锑浓度为10 mg/L、50 mg/L、100 mg/L、150 mg/L、200 mg/L 的溶液各180 mL,用NaOH 溶液和HCl 溶液调节pH 至5。称取50 mg 湿重菌体加入配制好的锑溶液中,摇匀后放入恒温振荡培养箱中,在30 ℃、150 r/min 的条件下振荡24 h,取出,每个样品加入120 mL 超纯水稀释,使用0.22 μm 的微孔滤膜进行过滤,保留5 mL 滤液,过滤后的滤膜放入-80 ℃的超低温冰箱中冷冻保存,然后放入真空冷冻干燥机中干燥,干燥后称量滤膜上菌体的质量并记录。过滤后每个样品滤液分别取出0.1 mL 用超纯水稀释到10 mL,将稀释后的样品各自取出0.5 mL,分别加入0.5 mL 100 g/L 硫脲、0.5 mL 100 g/L 抗坏血酸和3.5 mL HCl溶液,得到5 mL 待测液,摇匀静置一段时间,用原子荧光光谱仪测量样品。
(2)不同吸附时间和pH 对吸附效果的影响。配制锑浓度为50 mg/L 的锑溶液,每组样品30 mL,分别调节pH 至3、5、7。称取50 mg 湿重菌体于配制好的锑溶液中,摇匀后放入恒温振荡培养箱中在30 ℃、150 r/min 的条件下振荡培养,分别于吸附0 h、6 h、12 h、24 h 取样检测。
1.2.3 原子荧光光谱测定
配置锑溶液100 μg/L,以盐酸为载流剂,硼氢化钾溶液为还原剂,按照仪器使用说明书调节仪器至最佳工作条件(负高压:300 V;总电流:40 mA;载气:300 mL/min;屏蔽气:800 mL/min;原子化器高度:8 mm),预热30 min,利用原子荧光光谱仪测定锑的荧光强度。首先设置仪器标准曲线法,自动获得标准曲线的线性回归方程IF=163.036C-239.509 4(IF为荧光强度,C为锑浓度;相关系数为0.999 97)。再进行上述样品的测定,并减去试料空白溶液的荧光强度,根据标准曲线的线性回归方程,计算得出锑的含量。
2 结果与分析
2.1 三种白腐真菌的耐受性筛选
不同锑浓度条件下P.chrysosporium的生长情况如图1 所示。与不含锑的对照组比较,锑浓度500 mg/L及以上时,P.chrysosporium的生长速度随浓度升高而减慢,浓度达5 000 mg/L 时,其生长速度受到的抑制最明显。在培养24 h 之后,锑浓度为5 000 mg/L 时的菌落直径只有3.0 cm,无添加时菌落直径为3.5 cm。各浓度都在培养36 h 后菌落生长蔓延至整个培养皿。
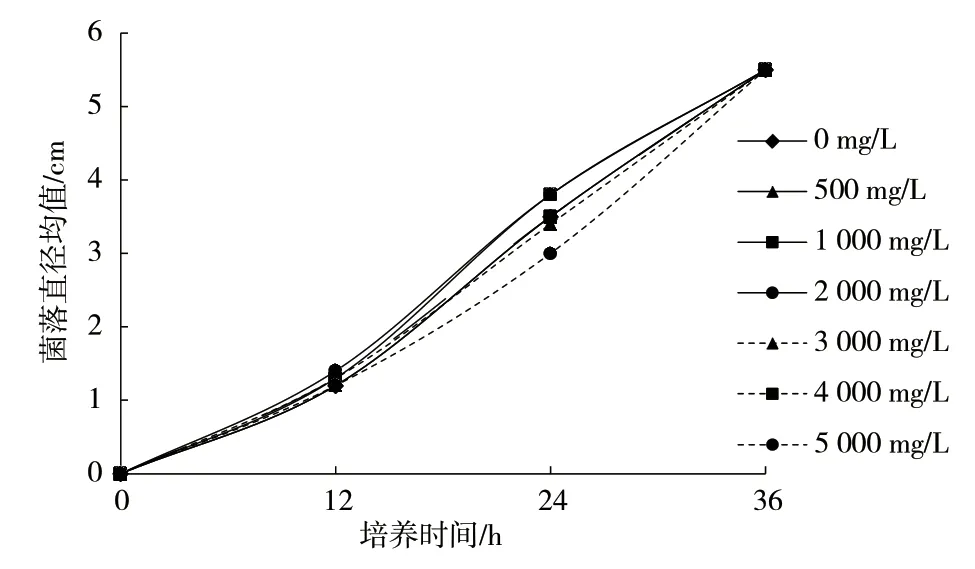
图1 P. chrysosporium 在不同锑浓度下的菌落直径变化
P.sordidaYK-624 的生长状况如图2 所示。不同锑浓度影响下,P.sordidaYK-624 的生长速度随着锑浓度的升高而减慢,高浓度的锑对其生长存在明显的抑制作用。在培养36 h 之后,锑浓度为5 000 mg/L下的菌落直径为3.7 cm,在锑无添加时菌落直径为4.9 cm。各浓度在培养48 h 后菌落生长蔓延至整个培养皿。
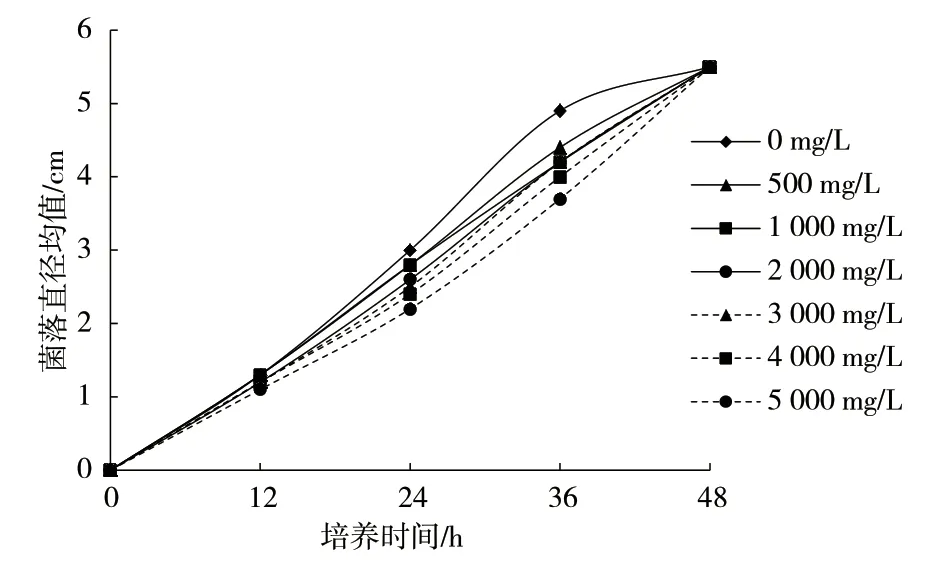
图2 P. sordida YK-624 在不同锑浓度下的菌落直径变化
在不同浓度的锑影响下,I.lacteus的生长速度随着锑浓度的升高而减慢,高浓度锑对其生长存在明显的抑制作用(图3)。培养60 h 之后,锑浓度为5 000 mg/L 下的菌落直径只有2.8 cm,无添加时的菌落直径是4.8 cm。培养72 h 后,不添加锑的菌落生长蔓延至整个培养皿;锑浓度在500 ~3 000 mg/L 时,培养96 h 后菌落生长蔓延至整个培养皿;锑浓度为4 000 mg/L 和5 000 mg/L 时,培养108 h 后菌落生长蔓延至整个培养皿,高浓度的锑对I.lacteus生长抑制非常明显。

图3 I. lacteus 在不同锑浓度下的菌落直径变化
综上所述,三种白腐真菌中,P.chrysosporium的生长最为迅速,受环境中锑的影响最小。I.lacteus的生长速度最慢,受环境中锑的影响也更为明显。P.chrysosporium的耐受性最强,采用P.chrysosporium作为供试菌,开展白腐真菌对锑吸附特性的研究。
2.2 锑的不同初始浓度对吸附效果的影响
如图4所示,当锑浓度为50 mg/L时,P.chrysosporium对锑吸附量最高,达89.9 mg/g;锑初始浓度为200 mg/L时次之,为73.0 mg/g;锑初始浓度为10 mg/L 时吸附量最小,仅为6.6 mg/g。李宁杰研究发现,P.chrysosporium吸附重金属铅时,随着重金属铅的初始浓度的增大,其吸附量也随之增大[12]。本次实验中锑初始浓度为10 mg/L、100 mg/L、150 mg/L 和200 mg/L 时也呈现出此趋势。
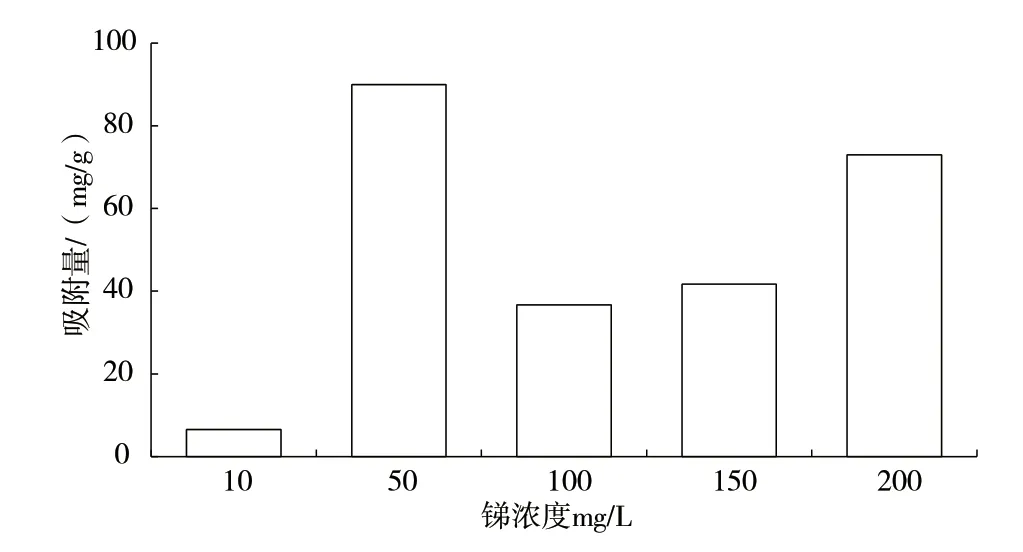
图4 不同锑浓度下P. chrysosporium 的吸附情况
2.3 pH 对锑吸附性能的影响
在锑浓度为50 mg/L 的前提下,各pH 条件下的吸附量均随吸附时间先增加后减少,最佳吸附效果为吸附时间12 h。推测当P.chrysosporium暴露在重金属溶液中时,其细胞壁先与重金属溶液接触,细胞壁上的各种活性基团与重金属离子形成配位络合,该过程反应速度较快。随着吸附量的增加,细胞壁对重金属离子的吸附逐渐达到饱和,重金属离子进入细胞内,该反应较慢,历时较长,这是第二阶段重金属慢速积累的过程[13]。不同pH 条件下对锑的吸附实验的结果显示,P.chrysosporium在pH=3 时吸附效果最佳,吸附量最高可达291.76 mg/g;pH=5 时效果次之,吸附量最高为267.34 mg/g;pH=7 时吸附效果最差,其最高吸附量为195.91 mg/g(图5)。
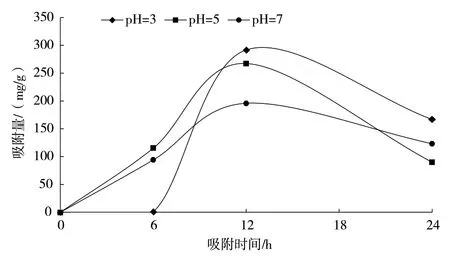
图5 pH 对P. chrysosporium 吸附锑的影响
3 结论与讨论
面对日益严重的锑污染,如何修复锑污染成为急需解决的问题。在去除重金属污染的方法中,生物吸附方法因成本低、吸附量大等优点在最近几年引起了广泛关注。本研究旨在探究白腐真菌对重金属锑污染修复的可行性,通过耐锑菌株筛选实验选出其中最耐锑的是黄孢原毛平革菌(P.chrysosporium);改变锑的初始浓度、吸附时间和pH 分析P.chrysosporium对锑的吸附性能,发现锑浓度为50 mg/L、pH=3 时吸附效果最好,吸附12 h 后吸附量高达291.76 mg/g,24 h 后降低至89.9 mg/g。

