自由基氰甲基化反应研究进展
肖青,方洁
(江西省科学院应用化学研究所,江西南昌330096)
有机腈存在一些天然产物和药物分子中,在药学方面具有重要作用。另外,有机腈在合成领域是一类重要的含氮化合物,因为氰基经过水解、还原或环加成,可以生成各类衍生物,比如羧酸、酯、酰胺、胺、醛以及各类含氮杂环。简单烷基腈通常廉价易得,其中乙腈就是常用的有机溶剂。将烷基腈接入有机骨架,可以合成一些含有氰基的复杂化合物。近年来,C-H键的直接官能团化反应受到广泛关注,高效和原子经济的优势使其成为一种非常有实用价值的合成手段。乙腈的α位C(sp3)-H键具有弱酸性,pKa值为31.3(二甲基亚砜为溶剂),键解离能(BDE)为96 kJ/mol,因此烷基腈α 位的活化具有一定的挑战性。
烷基腈的C-H 键活化有两种方式:(1)采用当量过渡金属或催化量过渡金属进行活化形成碳属亲核试剂;(2)通过C(sp3)-H键直接活化形成碳自由基。第一种方法通常需要使用当量强碱才能形成碳属亲核试剂,条件相对苛刻,多数敏感基团无法耐受,化学选择性低。第二种方法相对温和,近期引起了科学家的关注并取得了很好的进展。2018 年LOH 和SHEN课题组对自由基氰甲基化反应的工作进行了全面综述[1]。接下来几年,相关工作有了比较大的进展,特别是近年电化学方法的引入,使得α 氰基碳自由基的获得方式得到扩展。本文拟对近几年的相关工作按照α 氰基碳自由基活化的不同方式进行总结。
1 化学氧化剂
1.1 过氧化试剂
这类方法采用过量过氧化试剂为氧化剂,在加热条件下活化烷基腈得到α 氰基碳自由基。这类反应报道得比较多的是α 氰基碳自由基对双键加成引发的自由基关环反应。2019 年,LI 课题组以过苯甲酸叔丁酯(TBPB)为氧化剂,在加热条件下将过苯甲酸叔丁酯活化为苯甲酸自由基和叔丁基氧自由基,这些氧自由基与乙腈作用产生α 氰基碳自由基后与邻氰基芳基丙烯酰胺发生自由基[2 + 2 + 1]环化反应得到吡咯并[3,2-c]-喹诺酮类产物(图1)[2]。值得一提的是,在反应的过程中,第一次环化形成了亚胺氮自由基,经过1,5 氢迁得到另一种α 氰基碳自由基,进而发生第二次关环得到最终产物,期间TBPB 两次参与了氧化作用。整体来讲,该反应的底物兼容性较好,可以实现克级规模制备。之后,多个课题组分别报道了类似的α 氰基碳自由基进攻双键或者三键引发的关环反应[3-7]。与烯烃的其他反应也有报道,比如JIAN、SHEN[8]和CHENG、QIAN[9]课题组分别报道了烯烃的氢化氰甲基化和烯烃的氰甲基化重排反应。
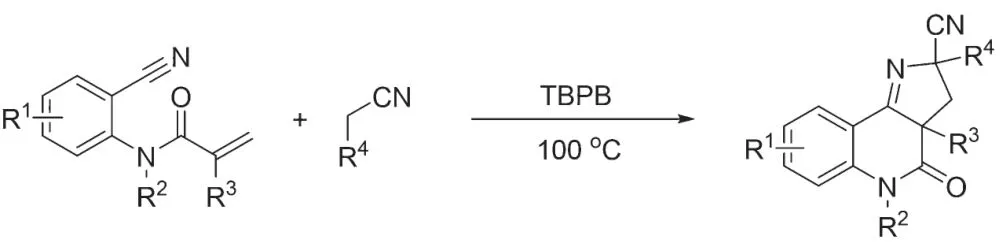
图1 α 氰基碳自由基引发的自由基环化反应
2021 年,FOROUMADI、KIANMEHR 和TAN 课题组分别发展了8-氨基喹啉酰胺的芳基取代反应,α 氰基碳选择性地上在喹啉的C5 位。二叔丁基过氧化物(DTBP)或TBPB 均可作为氧化剂,在加热条件下活化乙腈(图2)[10-11]。2022 年,YAN 和LIN 课题组报道了一例氨基导向的芳环氰甲基化反应,该反应以DTBP 为氧化剂,在氯化铁催化和加热下,氰甲基化选择性地发生在氨基的邻位或者吡啶的2 号位[12]。
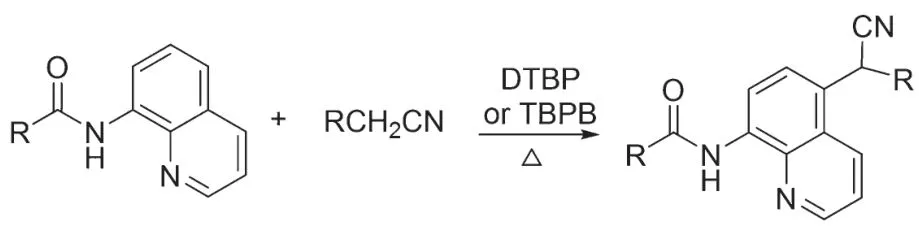
图2 氨基导向的芳环氰甲基化反应
2020 年,KOZLOWSKI 课题组报道了吲哚和芴的苄位氰甲基化反应(图3)[13]。α 氰基碳自由基在DTBP 和加热条件下产生,遗憾的是该反应整体收率偏低。芴的氰甲基化反应相对比较顺利,烷基腈的使用范围比较广,比如氰基的α 位,无论是伯碳、仲碳还是叔碳都可以参与反应。
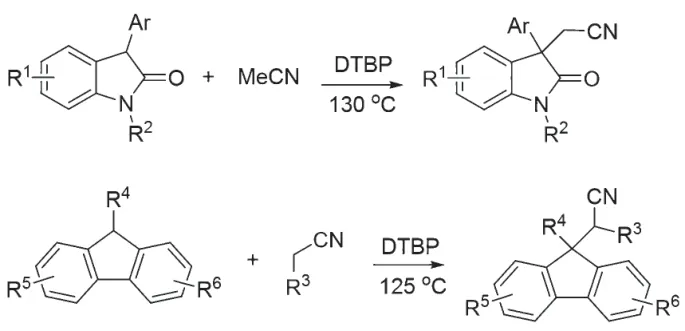
图3 苄位氰甲基化反应
近期也报道了一些其他类型的反应,比如2019年LI 课题组以过氧化苯甲酰(BPO)为氧化剂,完成了炔酸的脱羧氧化烷基化反应(图4)[14],以及SUN课题组报道的羧酸氰甲基酯化的反应[15]。

图4 α 氰基碳自由基与炔酸的加成反应
1.2 当量金属氧化剂
以当量金属作为氧化剂,也常用于自由基氰甲基反应。2019 年YU 和PAN 课题组发展了一种从N-烯丙基苯甲酰胺合成异二氢喹啉酮的反应。该方法以4当量的醋酸银为氧化剂,在150 ℃条件下活化乙腈而引发自由基的环化反应(图5)[16]。2021 年WEI 课题组以碳酸银为氧化剂,完成了1,6-二烯与烷基腈的自由基环化反应[17]。
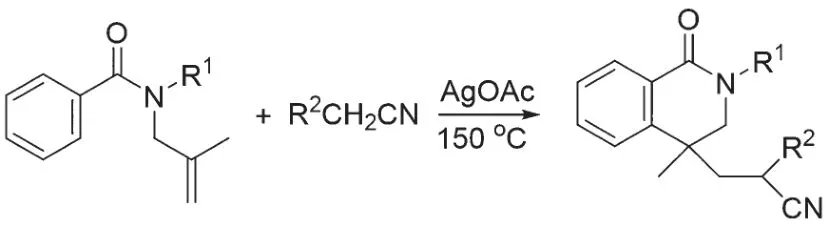
图5 醋酸银活化乙腈合成异二氢喹啉酮
LI、XIE、SONG 课题组在2019 年报道了碳酸银为氧化剂,镍催化的烯烃双官能团反应,即烯烃的烷基化酯基化反应(图6)[18]。作者推测碘化镍作为Lewis 酸与双键络合以稳定自由基从而提高了反应活性。该反应适用于芳基和杂芳基乙烯,非活化烯烃不参与反应。

图6 α 氰基碳自由基参与的烯烃双官能团化反应
2019 年,CHENG 课题组报道了乙腈与烯酯反应生成γ-酮基腈的工作(图7)[19]。同样以碳酸银为氧化剂引发α 氰基碳自由基,但是该反应的产率普遍不高。
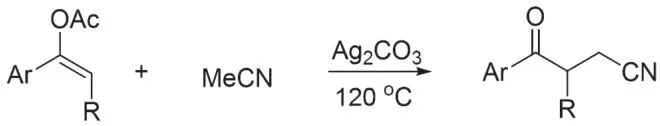
图7 α 氰基碳自由基与烯酯的加成反应
1.3 其他氧化剂
2019 年,ZHANG 和YAN 课题组报道了以全氟丁基碘为氧化剂,通过形成电子给予-接受络合物(EDA)引发α 氰基碳自由基的反应[20]。该反应在室温、碳酸铯的作用下顺利地将酮肟转化为酮肟醚,芳香族和脂肪族酮肟都可以参与反应。
2 光化学
光催化是一种被认为可以潜在降低能源危机和减少温室效应的有效方法,得到广大化学工作者的关注。CAI 课题组在2019 年报道了从N-芳基丙烯酰胺合成取代吲哚酮的反应[21]。该反应的体系相对比较复杂,有机荧光催化剂(4CzIPN),[双(三氟乙酰氧基)碘]苯(PIFA)和1,3,5-三甲氧基苯三种物质在可见光激发下协同作用产生α 氰基自由基,与N-芳基丙烯酰胺的双键加成后发生关环反应。
2019 年,SAITO 小组完成了以负载银的二氧化钛为光催化剂的苯乙烯氢化官能团化反应。该反应在水溶剂中进行,作者推测水溶剂化的羟基自由基引发了烷基腈的氢转移反应(图8)[22]。随后,SUN 和ZHONG 课题组以同样的模板反应[23],重点研究了负载镍和锰的二氧化钛光催化剂对反应催化活性的影响,发现负载镍和锰的二氧化钛的活性比纯的二氧化钛高60 倍。
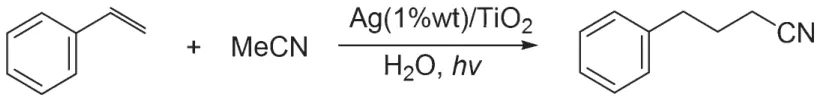
图8 光催化乙腈与苯乙烯的加成反应
3 电化学
电化学合成是一种绿色合成方法,因为该方式使用电子作为氧化剂或还原剂。2019 年,HUANG 课题组[24]和LEI 课题组[25]分别报道了以碘盐为电化学氧化媒介,立体选择性合成2-硫代-3-氨基巴豆腈的方法(图9)。作者推测乙腈自由基是通过阳极氧化碘得到活性碘,再与乙腈发生氢转移而产生的。该方法无需金属,从乙腈和硫酚(或硫醇)一步合成多取代烯烃。理论计算研究结果表明,体系中的有机膦配体具有稳定和调控自由基中间体活性的作用,从而优先生成(Z)-构型烯烃。之后HUANG 课题组以四甲基铵溴化物代替碘盐,在电化学条件下合成了一系列杂芳环烯基硫化物[26]。
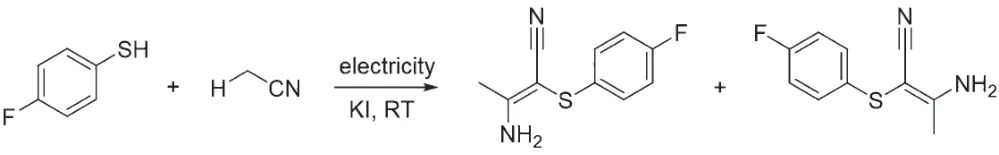
图9 电化学氧化乙腈合成多取代烯烃
2022 年,GUAN 和HE 课题组报道了一例亚胺和乙腈发生电化学加成合成β-氨基氰化合物的反应(图10)[27]。作者推测乙腈自由基与亚胺自由基发生了偶联反应,但该方法仅适用于芳醛和芳胺形成的稳定亚胺。

图10 亚胺和乙腈的电化学加成反应
4 结论
通过活化烷基腈中α 位的C(sp3)-H 键选择性地发生氰甲基化反应,以构筑新的碳-碳和碳杂(碳氮、碳氧、碳硫)键的方法,有很大的挑战性,同时具有重要意义。从C-H 键的活化方式来看,与传统的形成碳属亲核试剂的方法比,形成碳属自由基的方法相对比较温和,特别是近年光化学和电化学方法的引入。值得一提的是电化学方法,不需要金属、化学氧化和还原试剂,通常在室温和大气环境下完成,具有良好的官能团适应性。但是目前自由基氰甲基化反应绝大多数需要远远过量的烷基腈原料,而且常常作为溶剂,且报道的底物也有一定的局限性。发展新的氰甲基化方法,提高氰甲基化反应的活性和化学选择性,拓展底物的适用性,降低烷基腈原料的使用量,以及立体选择性自由基腈甲基化反应的开发,将是化学工作者下一步工作的目标和方向。

