微生态制剂对肺结核强化期治疗患者肝功能的影响
王明雄,杨海清,邓夏艳,廖小云,刘保珍,陈燕
1.茂名市慢性病防治中心结核病科,广东茂名 525000;2.茂名市慢性病防治中心呼吸内科,广东茂名 525000
肺结核是由结核分枝杆菌所致的一种慢性传染性疾病,初治敏感性肺结核患者需要至少规范治疗6 个月方可获得较好的疗效,其中以一线抗结核药物为主要治疗方案。一线治疗方案中,以利福平作为广谱抗生素,需要全程、规律、足量使用,同时还需要结合乙胺丁醇、异烟肼、吡嗪酰胺作为窄谱抗生素联合使用,使用周期较长[1-2]。此治疗方案虽然能取得一定的治疗效果,但是由于治疗周期较长,必然会对患者的微生物群体群产生影响,最为显著的是肠道微生物群。“肠-肝轴”理论的提出,为临床上采用益生菌改善肝功能提供了理论依据[3]。也有研究指出,在肺结核强化治疗患者中,若是及时给予微生态制剂治疗,能够有效改善患者的肝功能损害,进一步提升治疗效果[4]。既往学者的研究证实了微生态制剂对肺结核强化治疗患者的有效性,但是对于不同剂量的治疗效果仍有争议[5]。基于此,本研究选取2021 年2 月—2023 年2 月茂名市慢性病防治中心收治的90 例肺结核强化治疗患者,探讨不同剂量微生态制剂对肺结核强化治疗患者肝功能的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取本院收治的90 例肺结核强化治疗患者为研究对象,采用随机数表分组的方式,将90 例患者分为对照组、低剂量益生菌治疗组(低剂量组)、高剂量益生菌治疗组(高剂量组),每组30例。对照组中男14 例,女16 例;年龄34~67 岁,平均(46.18±2.32)岁;体质指数(body mass index,BMI)18.4~25.2 kg/m2,平均(20.48±0.43)kg/m2。低剂量组患者中男15 例,女15 例;年龄32~68 岁,平均(46.75±2.31)岁;BMI 18.1~25.8 kg/m2,平均(20.18±0.65)kg/m2。高剂量组患者中男13 例,女17 例;年龄33~67 岁,平均(46.17±2.21)岁;BMI 18.2~25.5 kg/m2,平均(20.78±0.61)kg/m2。3 组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经过医学伦理委员会批准。
1.2 纳入与排除标准
纳入标准:①年龄>18 岁,无性别限制;②符合肺结核临床诊断[6],能够提供影像学诊断报告以及痰涂片阳性或气管镜肺泡灌洗液阳性诊断报告;③自愿参与并签署知情同意书。
排除标准:①肺外结核者;②伴有严重的心脑血管、肝肾功能以及胃肠道疾病者;③恶性肿瘤者;④认知障碍或精神疾病者;⑤近2 个月内已经服用过益生菌治疗或者抗生素治疗者;⑥处于妊娠期或哺乳期女性。
1.3 方法
所有患者均接受肺结核强化治疗。异烟肼(国药准字H34023146;规格:50 mg)400 mg,1 次/d,口服2个月;利福平(国药准字H51023075;规格:0.15 g)450 mg,1 次/d,口服2 个月;吡嗪酰胺(国药准字H51022127;规格:0.5 g)0.5 g,3 次/d,口服2 个月。治疗期间,予以其他常规治疗,如肝功能损害谷丙转氨酶(alanine transaminase, ALT)超过正常值者,给予相应护肝药物治疗,超过正常值高限2 倍者,则停用抗结核药物。对照组无活性L.casei 补充。低剂量组:L.casei 发酵乳(批号20204231),1 瓶/d。高剂量组:L.casei 发酵乳,2 瓶/d。每瓶L.casei 发酵乳中,L.casei 活菌数高达1×1010CFU。每次服用益生菌需与抗结核药物间隔至少1 h。3 组患者均接受为期2 个月的治疗。
1.4 观察指标
1.4.1 肝功能指标异常率 在治疗2 个月后抽取患者空腹静脉血5 mL,采用生化分析仪进行检测患者的肝功能指标,包括ALT、谷草转氨酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰转肽酶(glutamyl transpeptidase, GGT)、总胆红素(total bilirubin, TBil)、间接胆红素(indirect bilirubin, IBiL)、直接胆红素(direct bilirubin, DBiL)。
1.4.2 肠道通透性 在治疗前、治疗2 个月后检测3组患者的肠道通透性,采用化学比浊法检测脂多糖(lipopolysaccharides, LPS)、闭锁连接蛋白-1(zonula occludens-1, ZO-1)、人肠脂肪酸结合蛋白(intestinal fatty acid binding protein, IFABP)指标。
1.4.3 炎症因子水平 在治疗前、治疗2 个月后检测3 组患者的炎症指标,采用酶联免疫吸附试验检测肿瘤坏死因子-α(tumor necrosis factor alpha, TNFα)、白介素-2(interleukin-2, IL-2)、白介素-6(interleukin-6, IL-6)指标。
1.5 统计方法
采用SPSS 20.0 统计学软件进行数据分析,计量资料符合正态分布表示为(),组间差异行t检验;计数资料表示为例数(n)和率(%),组间差异行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组患者肝功能指标异常升高率对比
治疗后,高剂量组肝功能指标异常升高率为10.00%,低于低剂量组的16.67%、对照组的36.67%,差异有统计学意义(P<0.05),见表1。
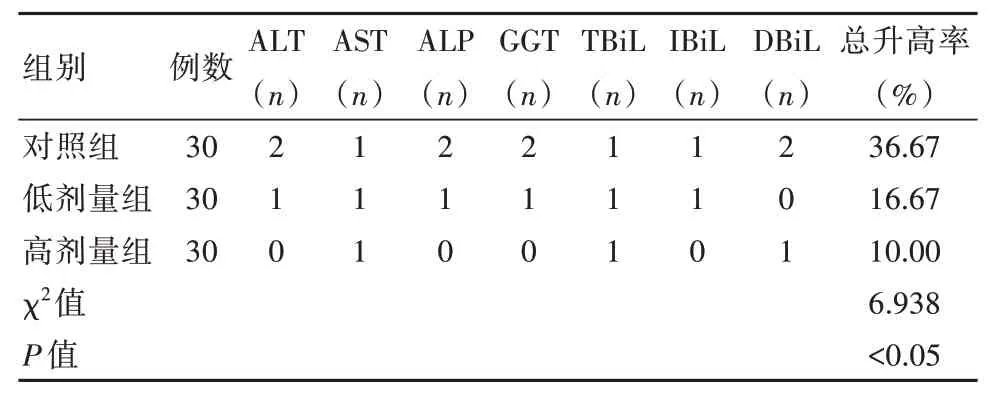
表1 3 组患者肝功能指标异常升高率对比
2.2 3 组患者肠道通透性对比
治疗前,3 组肠道通透性对比,差异无统计学意义(P>0.05)。治疗后,高剂量组LPS、ZO-1、IFABP低于低剂量组和对照组,差异有统计学意义(P<0.05),见表2。
表2 3 组患者肠道通透性对比[(),%]
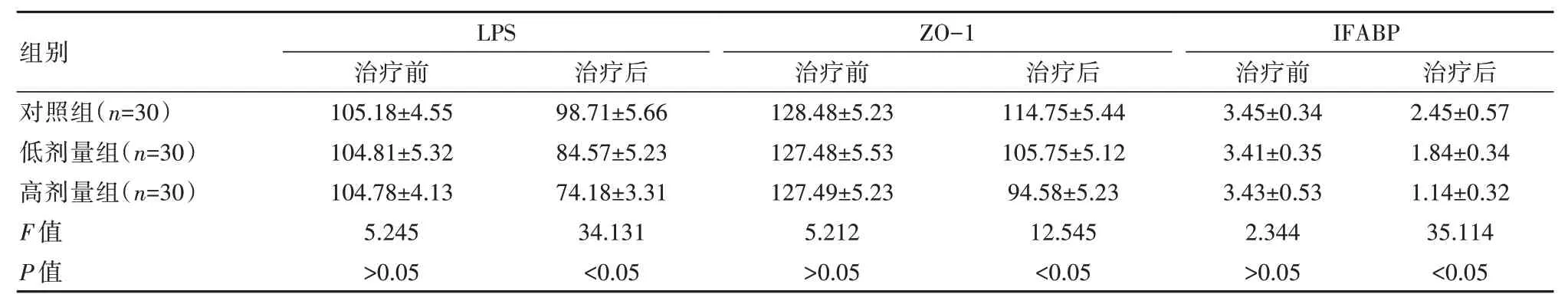
表2 3 组患者肠道通透性对比[(),%]
?
2.3 3 组患者炎症因子水平对比
治疗前,3 组炎症因子水平对比,差异无统计学意义(P>0.05)。治疗后,高剂量组TNF-α、IL-2、IL-6 水平低于低剂量组和对照组,差异有统计学意义(P<0.05),见表3。
表3 3 组患者炎症因子水平对比[(),ng/mL]
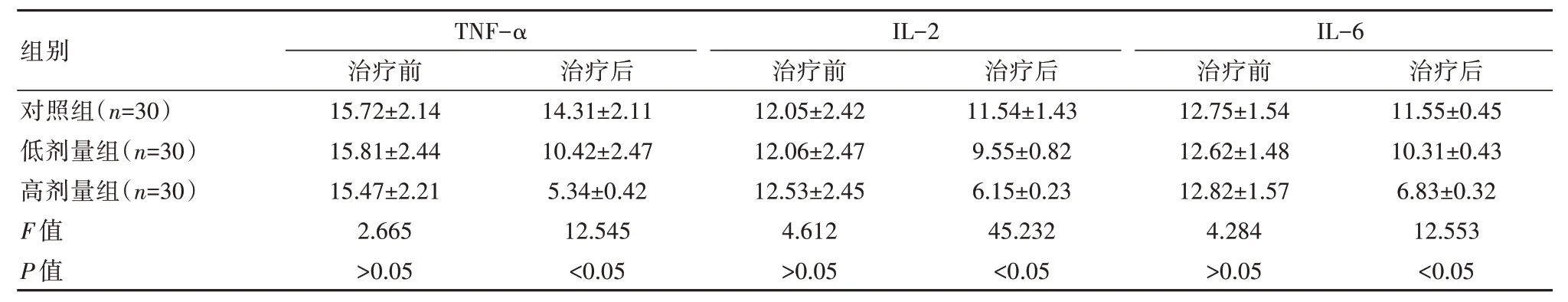
表3 3 组患者炎症因子水平对比[(),ng/mL]
?
3 讨论
肺结核的强化治疗通常需要进行2 个月,虽然能够有效杀灭结核分枝杆菌,但是,长期用药也会导致患者的肝功能出现损害,临床上针对强化治疗所致的肝损害,通常基于保肝药或者其他对症药物进行治疗,但是其疗效欠佳[7]。有研究表明,作为一种活性微生物,已有研究支持补充益生菌可以改善肠道功能的同时改善肝损伤[8-9]。目前越来越多的研究表明,在肺结核患者中,其肠道菌群发生了变化[10-11]。大部分研究提示,在强化治疗的肺结核患者中,大多数均存在肠道菌群失衡,且肠道菌群失衡会贯穿治疗的全过程,少数患者甚至会延长至停药后的数月至1 年[12]。益生菌可分为3 类,主要是乳杆菌属、双歧杆菌属、兼性厌氧球菌,近年来,益生菌的功效已经在多个研究中被证实,随着研究的深入,不同类型的基本中使用益生菌均获得了较好的疗效,值得注意的是,不同剂量的益生菌以及不同种类的益生菌产生的疗效也存在差异。
本研究中,治疗2 个月后,高剂量组肝功能指标异常升高率为10.00%,低于低剂量组的16.67%、对照组的36.67%(P<0.05)。与刘欣等[13]的研究中,益生菌治疗组的患者,肝功能指标异常升高为17.44%,而未采用益生菌治疗的对照组,肝功能指标异常升高为63.12%,与本研究结果一致。本研究中,治疗前,3 组肠道通透性对比,差异无统计学意义(P>0.05);治疗后,高剂量组LPS、ZO-1、IFABP 低于低剂量组和对照组(P<0.05)。潘燕珊等[2]的研究中,观察组患者的LPS(67.23±4.33)%、ZO-1(89.47±5.34)%、IFABP(1.23±0.34)%显著低于对照组的(85.81±5.34)%、(94.18±5.34)%、(2.33±0.23)%,与本研究结果一致。治疗前,3 组炎症因子水平对比,差异无统计学意义(P>0.05);治疗后,高剂量组TNF-α、IL-2、IL-6 水平低于低剂量组和对照组(P<0.05)。王起等[14]的研究中,观察组患者的TNF-α(5.43±0.43)ng/mL、IL-2(6.53±0.54)ng/mL、IL-6(6.81±0.54)ng/mL,显著低于对照组(10.54±2.66)、(10.55±2.43)、(11.56±3.43)ng/mL(P<0.05),与本研究结果一致。
综上所述,肺结核强化治疗患者采用微生态制剂补充治疗,能够有效的改善患者的肠道通透性,改善肝功能,降低炎症因子水平,与低剂量益生菌治疗相比,高剂量治疗效果更为显著。

