贮藏前后烟草种子的转录组与多肽组分析
李元君,王国平,牛永志,郑昀晔,张立猛
玉溪中烟种子有限责任公司,云南玉溪 653100
种子是最基本的农业生产资料,种子成熟时大量合成蛋白质、淀粉和脂类等贮藏化合物,为下一代植物生长提供物质基础[1]。烟草种子粒径小、繁殖系数高,但在繁种收获后需经过贮藏阶段才会投入使用[2]。大量研究表明,在贮藏过程中,种子时刻受到外界环境因素的影响,种子内部不断进行新陈代谢活动,种子活力下降,因此,烟草种子贮藏环境的温度、湿度及贮藏时间等关键因素的控制,贮藏后种子质量的优劣,对保障烟叶生产具有重要意义。
随着研究的深入,对于种子贮藏研究已经从生理生化分析发展到了功能基因和蛋白的挖掘,已有研究表明种子贮藏过程中众多基因或蛋白发生了变化,例如:ABI3[3]、ATHB25[4]等激素相关基因,OsALDH7[5]、PLDα1[6]等活性氧相关基因以及一些基因组修复[7]、种皮结构[8]等基因。此外,多肽是在生命过程起着极其重要作用的一类化合物[9],迄今在生物体内发现的多肽已达数万种,其广泛参与和调节机体内各系统、器官、组织和细胞的功能活动。研究也表明植物多肽参与受精授粉、根系发育、叶片发育等众多生物过程[10-12]。王国平等[13]基于多肽组学分析了烟草种子萌动前后的蛋白与多肽变化,并筛选出一个能够促进种子萌发的新型多肽。但目前对多肽的研究和认识远远不够,对于种子成熟、贮藏相关的多肽研究还未见报道。
本研究通过转录组与多肽组手段,研究贮藏期间烟草种子内部基因和多肽的表达差异与功能注释,挖掘调控种子贮藏活性的关键多肽,为指导种子贮藏提供理论依据和研究基础。
1 材料与方法
1.1 试验材料
供试材料烟草云烟105种子于2020年采收于西双版纳冬繁基地。
1.2 试验方法
1.2.1 种子的贮藏
将种子置于温度18℃,空气相对湿度40%以下的条件贮藏[14]。10 d 后开始取样,之后每隔2 周取样,80 d 后,每隔4 周取样,样品种子进行发芽检测。
1.2.2 种子发芽检测
在培养皿中垫海绵和滤纸,加入自来水,每个培养皿均匀播入100 粒种子,加盖。将培养品置于人工气候室,在温度25℃,每天光照12 h 的条件下发芽,发芽期间保持滤纸湿润。从第4 d 起每天记录发芽种子数(以露出子叶计为种子发芽),连续记录14 d。每个处理3 个重复,统计发芽势、发芽率。计算方法:发芽势(%)=(第7 d 发芽种子数/供试种子数)×100%;发芽率(%)=(第14 d 发芽种子数/供试种子数)×100%[1]。
1.2.3 转录组检测与分析
取贮藏前后的种子样品,用振荡研磨仪将种子样品磨碎后,采用Trizol 法提取总RNA(Invitrogen,Carlsbad, CA, USA),使用试剂盒去除rRNA,然后通过带有Oligo(dT)的磁珠富集具有polyA 尾巴的真核mRNA 后,用缓冲液把mRNA 打断。以片段化的mRNA 为模版,随机寡核苷酸为引物,合成cDNA。cDNA 经过末端修复、加A 尾并连接测序接头,用AMPure XP beads 筛选200 bp 左右的cDNA,进行PCR扩增,最终获得文库。
为减少无效数据带来的分析干扰,利用fastp[15]过滤掉(1)含adapter 的;(2)含(N)比例大于10%的;(3)全部都是A 碱基的以及(4)质量值Q≤20的碱基数占整条read 的50%以上的低质量数据,得到clean read。然后使用HISAT2[16]将整理好的数据和烟草参考基因组( https://solgenomics.net/organism/Nicotiana_tabacum/genome)进行比对,用RSEM[17]软件作表达量分析,最后使用DESeq2[18]进行差异表达和基因富集分析。
1.2.4 多肽组检测及分析
1.2.4.1 样品制备
种子样品研磨后加入裂解液(1%SDS, 8 mol/L urea, 1xProtease Inhibitor Cocktail(Roche Ltd.Basel,Swizerland)),振荡研磨3*400 s,冰上裂解30 min。高速离心15 min(4℃, 15000 rpm),取上清。用10K超滤管(Millipore,Billerica)于4℃下8000 g离心30 min去除高分子量的蛋白,然后采用 C18 除盐柱(MonoSpin C18, GL)对样品进行除盐并用真空浓缩仪抽干,于-80℃条件下保存待检。
1.2.4.2 多肽定性定量及差异分析
样品由配备在线纳喷离子源的LC-MS/MS进行分析。得到的串联质谱图经过PEAKS Studio version X+(Bioinformatics Solutions Inc., Waterloo, Canada)分析后用PEAKS DB 搜索烟草基因组数据库,设置None enzyme 即非酶切。搜库参数碎片离子质量容许误差:0.02 Da,母离子质量容许误差:7 ppm,可变修饰:Oxidation (M) 15.99,Acetylation (Protein N-term)42.01。肽段卡值为:-10lgP≥20。根据搜库结果对多肽进行定性定量分析。
同时,根据多肽定量结果,筛选出比较组间丰度发生显著变化的多肽,差异分析阈值:差异倍数(Fold change,FC)的绝对值大于1.2 倍,P值<0.05,并要求特异性肽段Unique Peptides≥1。
1.2.4.3 生物学信息分析
由于多肽序列较短,且数据库中对多肽的注释较低,为完整了解多肽的生物学功能,使用Blast2GO[19]version 5 对鉴定出的所有多肽所属的蛋白进行GO 和KEGG 注释,以差异蛋白为测试集,全基因组编码蛋白为背景,基于超几何分布检验对差异基因进行GO和KEGG 代谢通路富集分析。
2 结果与分析
2.1 贮藏时间对种子发芽的影响
由图1 可知,刚收获的云烟105 种子发芽率达到90%以上,与优质种子发芽率95%以上的标准相比,仍然偏低。其发芽势仅为65%,与优质种子发芽势92%以上的标准相比,明显偏低。在贮藏温度18℃条件下,随着贮藏时间的增加,种子发芽率略微升高,而发芽势显著升高,贮藏到大概200 d 以上的种子发芽势已经达到90%以上,发芽率和发芽势均趋于稳定。说明云烟105 种子刚收获后活力较低,经过一段时间贮藏后活力增高。
2.2 贮藏前后种子的差异基因筛选及分析
分别对贮藏200 d 以上的种子(V6)和刚收获的种子(V7)进行转录组测序,PCA 分析显示两组样品间差异性较好,可用于后续分析(图2)。设置差异基因筛选标准为FDR<0.05 且|log2FC|>1,共获得45712个基因,264 个差异基因(图3),其中有186 个基因上调表达、78 个基因下调表达。可以看出种子经过长期贮藏后,成熟更加充分并趋于稳定,相应的基因以下调表达为主。
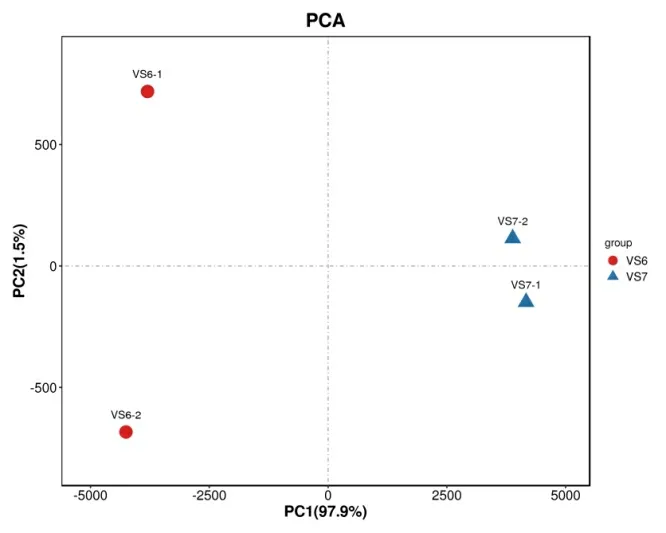
图2 贮藏前后种子中基因成分分析PCA 图Fig.2 PCA of differentially expressed genes in seeds before and after storage
2.3 贮藏前后种子差异基因的GO 和KEGG富集分析
对贮藏前后种子差异基因的GO 富集分析结果显示,差异基因可以注释到47 个GO 二级单元条目中,代谢过程(GO:0008152,50%)、细胞过程(GO:0009987,46.59%)、单生物过程(GO:0044699,45.83%);细胞组分(GO:0044464,28.03%)、细胞膜(GO:0016020,20.83%);催化活性(GO:0003824,49.62%)、结合(GO:0005488,39.77%)的差异基因数占总差异基因数百分比较高(图4A)。分别在3 个ontology 中筛选Q 值最小的前20 个GO term(图4B、C、D),可以看出差异基因主要富集在生物过程条目的硫酸盐同化(GO:0000103)、脂肪酸代谢(GO:0006631)、脱落酸转运(GO:0080168)、刺激应答(GO:0043207)、防御反应(GO:0006952)、单羧酸代谢过程(GO:0032787)、脂质代谢(GO:0006629)等过程;细胞组分条目的细胞连接(GO:0030054)、细胞膜(GO:0016020)、膜的固有成分(GO:0031224)等;分子功能条目中的硫氧还 蛋 白 活 性( GO:0004604 )、 铁 离 子 结 合(GO:0005506)、氧化还原酶活性(GO:0016705)等。对贮藏前后种子差异基因进行KEGG 富集分析,筛选Q 值最小的前20 个途径(图4E),差异基因主要富集在次生代谢物的生物合成(Biosynthesis of secondary metabolites)、硫代谢(Sulfur metabolism)、脂肪酸延长(Fatty acid elongation)、氨基酸合成(Amino acid metabolism)、植物激素信号转导( Plant hormone signal transduction)等。
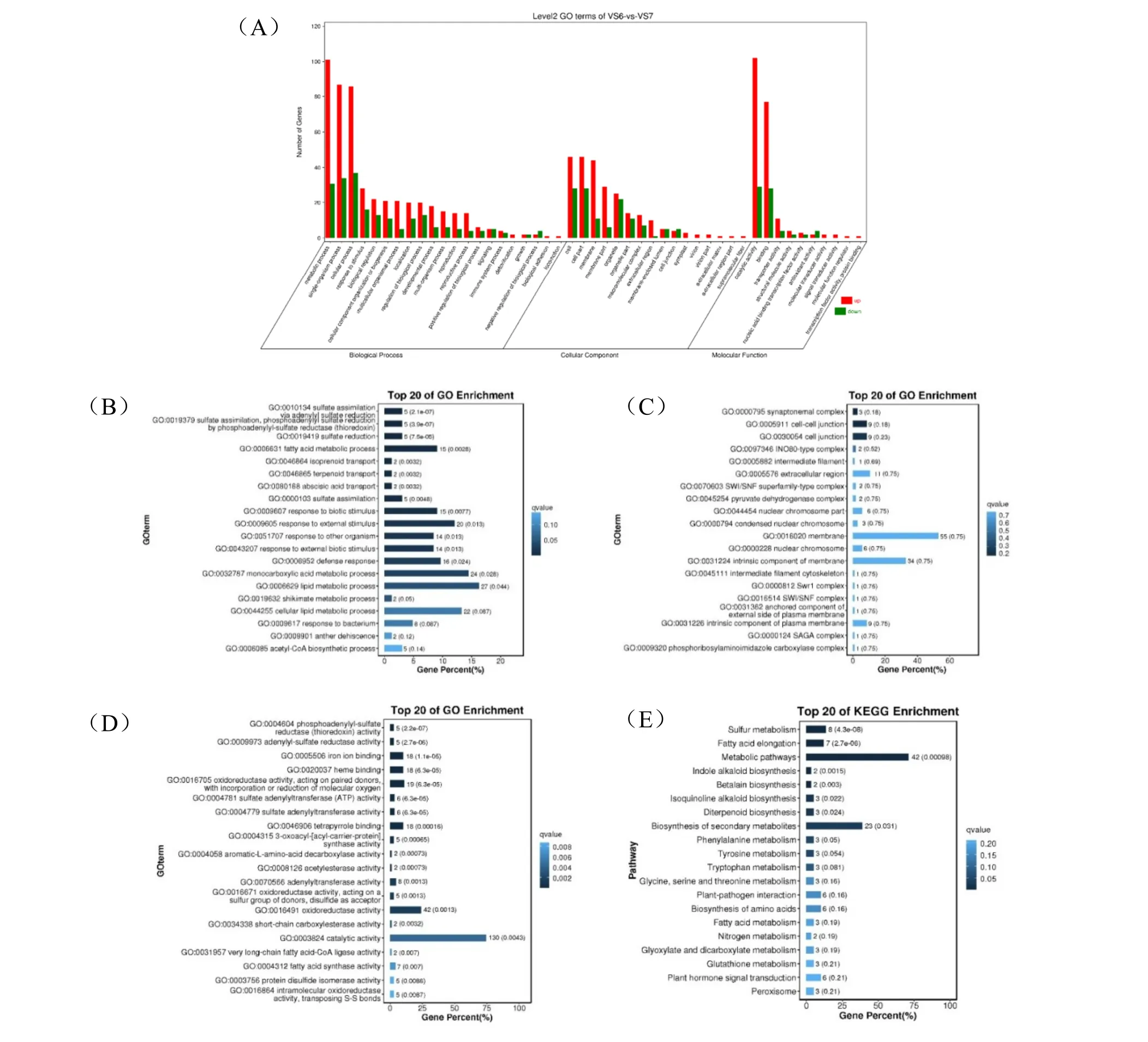
图4 差异表达基因的GO 和KEGG 富集分析Fig.4 GO and KEGG enrichment analyses of differentially expressed genes
2.4 贮藏前后种子的多肽鉴定
分别对贮藏200 d 以上的种子(V6)和刚收获的种子(V7)进行多肽的提取,并进行质谱鉴定。通过PCA 分析显示两组样品间差异性较好,可用于后续分析(图5)。对获得的质谱图与蛋白质数据库进行比对分析(-10lgP≥20,FDR≤0.01),获得匹配质谱图数2589 个,共匹配到特异肽段1052 个,蛋白质数量385个。鉴定获得的肽段主要集中在6~23 个氨基酸范围内,占全部鉴定肽段的96%以上。最终在贮藏前后种子样品中共筛选(P值<0.05)到256 个差异多肽,其中138 个多肽上调表达,118 个多肽下调表达(图6A)。可以看出种子经过长期贮藏后,相应的多肽以下调表达为主,这与基因表达规律一致。

图5 贮藏前后种子中多肽样品成分分析PCA 图Fig.5 PCA of differentially expressed peptides in seeds before and after storage
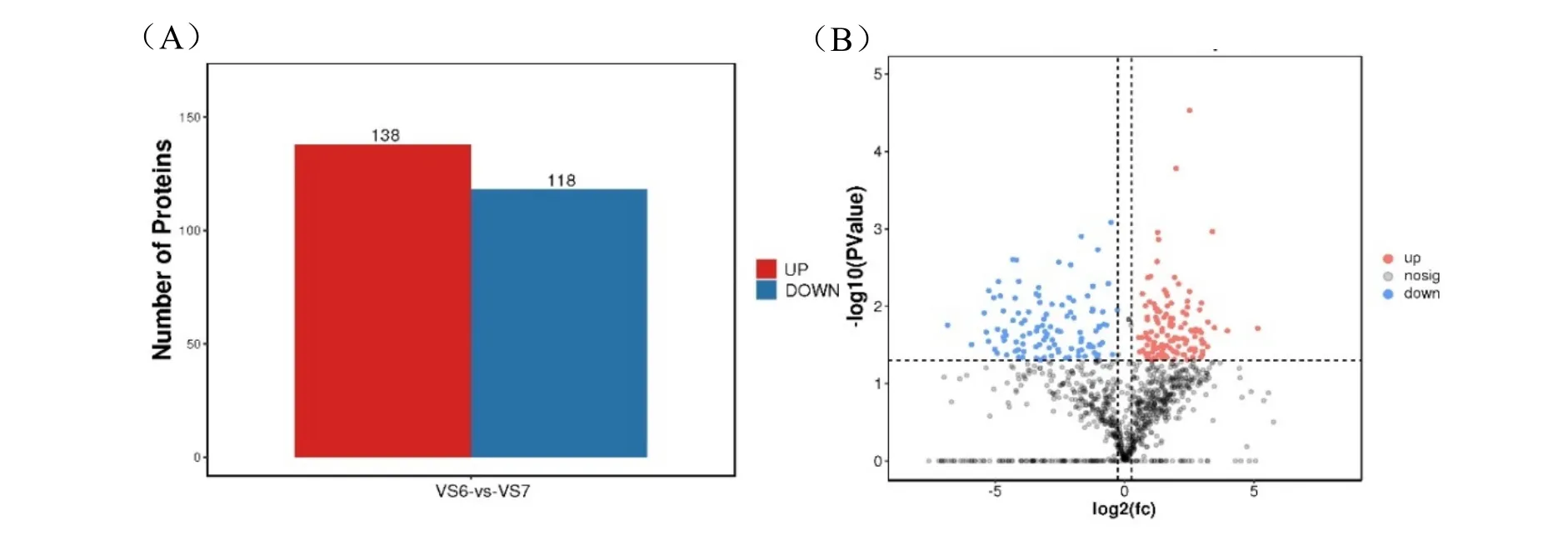
图6 贮藏前后种子差异多肽Fig.6 Differentially expressed peptide in seeds before and after storage
2.5 贮藏前后种子差异多肽所属蛋白的GO 和KEGG富集分析
贮藏前后种子样品中共筛选256 个差异多肽,这些差异多肽共匹配到125 个蛋白。对这些蛋白进行GO 富集分析,结果显示,共注释到41 个GO 二级单元条目,其中差异多肽数占总差异多肽数百分较高分的条目分别是单生物过程(13.67%)、代谢过程(12.89%)、细胞过程(9.38%);细胞组分(8.98%)、细胞器(6.25%);催化活性(10.55%)、结合(9.77%)等(图7A)。分别在3 个ontology中筛选Q 值最小的前20 个GO 条目,可以看出差异较大的多肽主要富集在生物过程条目的胚胎发育(GO:0009790)、种子发育(GO:0048316)、种子休眠的胚胎发育终止(GO:0009793)等;细胞组分条目的外膜(GO:0031975)、核膜(GO:0005635)、液泡(GO:005773)等;以及分子功能条目的氧化还原酶活性(GO:0016491 )、 过氧化物酶活性(GO:0051213)、裂解酶活性(GO:0016829)、脂质结合(GO:0008289)等(图7B、C、D)。对贮藏前后种子差异多肽所属蛋白进行KEGG 富集分析,筛选Q 值最小的前20 个途径,可以看出差异多肽主要富集在脂肪酸代谢、过氧化酶体、α-亚麻酸代谢、乙醛酸和二羧酸代谢、碳代谢等通路(图7E)。
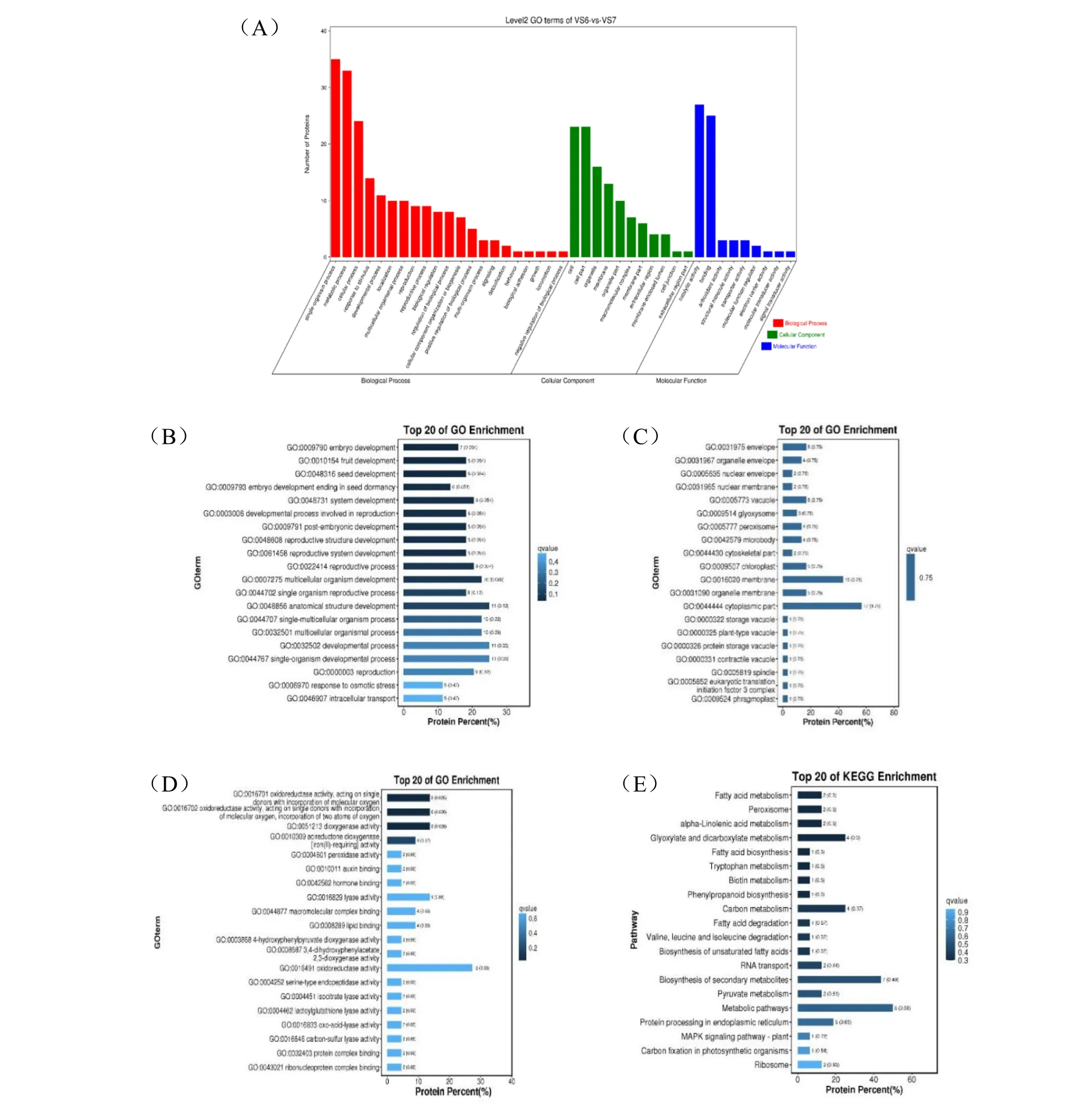
图7 差异多肽所属蛋白的GO 和KEGG 富集分析Fig.7 GO & KEGG enrichment analysis of differentially expressed peptide matched proteins
2.6 贮藏前后种子的转录组及多肽组交集分析
本研究在贮藏前后种子中共检测到差异基因264个、差异多肽256 个,差异多肽匹配到的蛋白125。将差异基因和差异多肽所属蛋白集合取交集,获得1个交集基因,即Nitab4.5_0000072g0130(图8)。该基因为预测的枯草菌素样蛋白酶SBT1.3(Subtilisin-like protease SBT1.3),主要作用为蛋白水解,具有丝氨酸型内肽酶活性。
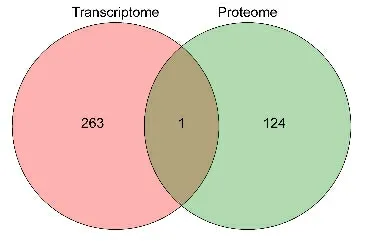
图8 贮藏前后种子中差异表达基因和蛋白韦恩图Fig.8 Venn diagram of differentially expressed genes and proteins in seeds before and after storage
2.7 目标多肽筛选
为了进一步筛选目标多肽,从获得的256 个差异多肽所属蛋白中继续筛选具有信号肽、蛋白长度不超过250 个氨基酸的蛋白,定义为目标多肽[13]。最终获得含信号肽的2 个多肽分子,且长度均不超过250 个氨基酸。其中Nitab4.5_0008018g0020,长度为142 个氨基酸,是类2S 富硫种子贮藏蛋白2(2S sulfur-rich seed storage protein 2-like),而另一个Nitab4.5_0002257g0090,长度为199 个氨基酸,则无注释信息。这两个多肽可能在种子成熟或贮藏过程起重要作用,后续可进一步验证其功能。
3 讨论
种子贮藏伴随种子内部一系列生理生化活性指标的变化,如脂肪氧化酶活性、抗氧化酶活性和非酶类抗氧化剂的种类和含量[20]。随着贮藏时间的延长,种子活力或种子寿命逐渐降低。本研究使用的试验材料为烟草云烟105 的种子,刚收获的云烟105 种子发芽率在90%以上,与优质种子发芽率95%以上的标准相比,仍然偏低,而发芽势与优质种子发芽势92%以上的标准相比,明显偏低,经过200 多天贮藏后,种子的发芽率和发芽势不断提高到90%以上并趋于稳定,种子活力提高。这一现象与一般认为的种子贮藏规律相反,考虑可能与种子后熟有关。种子后熟指的是种子形态成熟后被收获,并与母株脱离,但种子内部的生理生化过程仍然继续进行,直到生理成熟。烟草种子的采收时间主要是根据果皮颜色判断,果皮达到黄褐色为最佳成熟采收时间[21],而云烟105 的种子之所以活力还偏低,可能是未达到生理成熟导致。本研究的转录组和多肽组数据也表明,随着种子的成熟,其基因和多肽主要以下调为主,说明种子代谢活跃度降低,成熟更加充分并趋于稳定。
本研究从转录组和多肽组层面解析种子贮藏前后的基因与多肽表达差异并进行GO 和KEGG 富集分析。差异基因和差异多肽主要富集到脂肪酸代谢、过氧化物酶代谢、脂质代谢、激素信号、防御反应等途径。研究表明,烟草种子油含量较高,占到种子总量的33.6%~39.4%[22],种子成熟过程中油脂的代谢也相对活跃[23]。随着种子的成熟稳定,对外界环境的抗性也逐渐增强,其中抗氧化酶活性起着重要作用[24]。此外,激素也是种子成熟、萌发的重要调控因子[25]。因此,本研究结果也充分说明了烟草种子贮藏过程中富集到的主要途径与种子成熟稳定密切相关。本研究进一步筛选到 2 个目标多肽,其中Nitab4.5_0008018g0020是类2S 富硫种子贮藏蛋白2,与种子成熟过程的营养积累有关, 另一个Nitab4.5_0002257g0090则无注释信息,有待进一步研究。此外,目前关于种子的后熟研究主要集中在赤霉素的合成、脱落酸的抑制、细胞分裂促进等分子机制研究[26],多肽对种子休眠的解除及后熟过程的调控等多肽组研究仍然空白,本研究筛选的目标多肽分子在种子后熟过程中是否具有调控作用还有待进一步研究。
4 结论
本研究对贮藏前后烟草种子的基因和多肽进行了筛选,差异基因和差异多肽主要富集到脂肪酸代谢、过氧化物酶代谢、脂质代谢、激素信号、防御反应等与种子成熟稳定密切相关的途径。此外,本研究筛选到2 个与种子成熟及老化相关的目标多肽,为后续的深入研究奠定了基础。

