红鱼眼不同提取物含药血清对脂多糖诱导RAW264.7细胞炎症的影响
潘翠柳,莫文坤,潘真真,梁臣艳,唐云丽
(广西中医药大学,广西 南宁 530200)
红鱼眼是大戟科植物无毛龙眼睛Phyllanthus reticulatusPoir.var.glaber Muell.-Age.或龙眼睛Phyllanthus reticulatusPoir.的干燥茎及叶[1],其味微涩,性平。红鱼眼是广西壮族民间草药,具有祛风、散瘀、消肿的功效,主要用于治疗风湿性关节炎、类风湿性关节炎、骨性关节炎,同时还可用于辅助治疗急性肝炎、痢疾等[2-5]。目前已有关于红鱼眼抗炎作用的研究报道[6-8],但其作用机制尚未明确。因此,本实验拟采用血清药理学方法观察红鱼眼不同极性提取部位含药血清对脂多糖(LPS)诱导RAW264.7细胞炎症的影响,从而对红鱼眼的抗炎作用进行初步的探索。
1 实验材料
1.1 动物 SPF级昆明种(KM)小鼠,雌雄各半,体质量(20±2)g,购于湖南斯莱克景达实验动物有限公司,许可证编号:SCXK(湘)2019-0004。实验经广西中医药大学伦理委员会审查批准,批准号:DW20200315-43。小鼠饲养于屏障环境,符合SPF级要求,温度20~24 ℃,相对湿度50%~70%,12 h/12 h明暗交替,自由饮水、摄食。
1.2 细胞株 小鼠巨噬细胞株RAW264.7,由广西中医药大学科学实验中心提供。
1.3 药物与试剂 红鱼眼采集于广西南宁市青秀区,由广西中医药大学陆海琳高级实验师鉴定为大戟科叶下珠属植物无毛龙眼睛Phyllanthus reticulatusPoir.var.glaber Muell.-Age.或龙眼睛Phyllanthus reticulatusPoir.的地上部分。地塞米松(北京索莱宝科技有限公司,批号:20260511);噻唑蓝(MTT,北京索莱宝科技有限公司,批号:917Q051);脂多糖(LPS,北京索莱宝科技有限公司,批号:820F033);二甲基亚砜(DMSO,美国Sigma-Aldrich公司,批号:1121E0313);胎牛血清(FBS,北京索莱宝科技有限公司,批号:21070703);RPMI-1640 不完全细胞培养液(江苏凯基生物技术股份有限公司,批号:20220106);青霉素-链霉素混合物(北京索莱宝科技有限公司,批号:20180927);0.25 g/L含乙二胺四乙酸(EDTA)胰蛋白酶(江苏凯基生物技术股份有限公司,批号:20210927);一氧化氮(NO)、白介素1β(IL-1β)、白介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)试剂盒均购于北京康普同创生物科技发展有限公司;其他试剂均为分析纯。
1.4 仪器 EPOCH BIOTEK 型酶标仪(美国伯腾仪器有限公司);BC-J160S型二氧化碳细胞培养箱(上海博讯实业有限公司);Fresco 21 型高速冷冻离心机[赛默飞世尔科技(中国)有限公司];Sorvall-ST-16R型超声清洗仪(昆山市超声仪器有限公司);DHG-9203A 型热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);CKX41 型倒置生物显微镜[奥林巴斯(中国)有限公司];SW-CJ-1FD 型单人单面垂直净化工作台(上海苏竞实业有限公司)。
2 实验方法
2.1 红鱼眼不同极性提取物的制备 取红鱼眼药材适量,置于热恒温鼓风干燥箱中60 ℃烘干,烘干后将红鱼眼粉碎成粗粉。称取红鱼眼粗粉1.5 kg,用80%乙醇回流提取3 次,依次保持微沸状态2 h、1.5 h、1 h,过滤,合并滤液,用减压浓缩法将其制成干膏,称重,得到80%乙醇总浸膏604.4 g,留取220 g 浸膏备用,余下的384.4 g 浸膏用水完全溶解后,依次用石油醚、乙酸乙酯、水饱和正丁醇等溶剂进行萃取,减压回收溶剂,得到各部位浸膏,并于5~10 ℃冰箱中保存,备用。
2.2 红鱼眼不同极性部位提取物含药血清的制备 取小鼠42 只,雌雄各半,随机分为7 组:空白对照组、地塞米松组、80%乙醇提取物组、石油醚提取物组、乙酸乙酯提取物组、水饱和正丁醇提取物组、水提取物组,每组6 只。空白对照组灌胃给予生理盐水,地塞米松组灌胃给予地塞米松(剂量为6 mg/kg),其余组灌胃给予红鱼眼不同极性部位提取物(剂量均相当于生药量30 g/kg),各组灌胃容积均为20 ml/kg,连续给药7 d,1次/天。末次给药1 h后,眼球取血,静置,以3 000 r/min离心10 min,取血清,过滤除菌,分装,于-20 ℃下保存,备用。
2.3 细胞培养及传代 取RAW264.7 细胞加入到含10%胎牛血清和青霉素-链霉素混合液的RPMI-1640培养基中,在含5%CO2、37 ℃条件下的细胞培养箱中进行培养,每天更换培养液1 次,待细胞生长至80%以上,用0.25 g/L 含EDTA 胰蛋白酶进行消化后,进行1次细胞传代。使用对数生长期的细胞用于实验。
2.4 细胞活力的测定 采用CCK-8 法进行测定。取对数生长期的细胞,按细胞浓度为1×106个/ml 分别接种于4 块96 孔板中,于外圈加入200 μl PBS 缓冲液,置于5%CO2、37 ℃细胞培养箱中培养24 h。空白对照组加入含10%胎牛血清的培养基100 μl;地塞米松组加入含10%地塞米松血清的培养基100 μl;红鱼眼不同极性部位提取物组分别加入含10%红鱼眼不同极性部位提取物含药血清的培养基100 μl;空白组无细胞,加入含10%胎牛血清的培养基100 μl;每组设置6个复孔。置于含5%CO2、37 ℃培养箱中分别培养6 h、12 h、24 h、48 h 后,弃细胞上清液,每孔加入100 μl终质量浓度为1 mg/ml的MTT溶液[9],移置培养箱中培养4 h,终止培养,吸弃细胞的上清液后,每孔加入200 μl DMSO溶液,充分振摇10 min至板底无紫色结晶后,用酶标仪于490 nm 处分别测定其吸光度(OD)值,计算出RAW264.7细胞的存活率。细胞存活率(%)=(给药组平均OD 值-空白组平均OD 值)/(空白对照组平均OD值-空白组平均OD值)×100%。
2.5 细胞增殖的测定 采用MTT 比色法检测。取生长状态良好的RAW264.7 细胞进行消化,制成细胞混悬液,浓度为1×106个/ml,分别接种于4 块96 孔板中,外圈加入200 μl PBS 缓冲液,置于5% CO2、37 ℃条件下的细胞培养箱中培养24 h。实验分为8 组:空白对照组、LPS模型组、地塞米松组、80%乙醇提取物组、石油醚提取物组、乙酸乙酯提取物组、水饱和正丁醇提取物组、水提取物组。空白对照组加入完全培养液100 μl;LPS模型组加入含0.1 μg/ml的LPS培养基100 μl;地塞米松组加入10%地塞米松含药血清90μl和0.1 μg/ml LPS 10 μl 的培养基,共100 μl;红鱼眼不同极性部位提取物组分别将10%红鱼眼不同极性部位提取物含药血清90 μl 先预处理2 h,再分别加入0.1 μg/ml LPS 10 μl共100 μl孵育[10];每组设置6个复孔。各组在相同条件下分别培养6 h、12 h、24 h、48 h 后,弃细胞上清液,并向每孔加入终质量浓度为1 mg/ml 的MTT 溶液100 μl,再置细胞培养箱中培养4 h,弃上清液,每孔加入约200 μl 的DMSO 溶液,充分摇匀,于490 nm 处测OD值,并计算RAW264.7细胞的存活率。
2.6 细胞中IL-1β、IL-6、NO、TNF-α的含量测定 取对数生长期的RAW264.7 细胞,在96 孔细胞培养板中加入100 μl 浓度为1×106个/ml 的细胞悬液,置于细胞培养箱中培养24 h。实验分组同“2.5 项”,每组设置6个复孔,各组给药后在5%CO2、37 ℃的条件下培养12 h,取上清液,以3 000 r/min离心10 min,备用。取处理好的上清液按照ELISA 试剂盒的说明书操作,分别测定NO、IL-1β、IL-6、TNF-α的含量。
2.7 统计学方法 采用SPSS 19.0 统计软件对实验数据进行统计分析,计量资料以均数±标准差()表示,多组间比较采用方差分析,P<0.05 为差异有统计学意义。
3 结 果
3.1 红鱼眼不同极性部位提取物含药血清对RAW264.7细胞活力的影响 见表1。结果显示,用红鱼眼不同极性部位提取物含药血清对RAW264.7细胞进行干预后,随着培养时间的延长,各组细胞的存活率逐渐降低。尤其是药物干预24 h 后,80%乙醇提取物含药血清、乙酸乙酯提取物含药血清、水饱和正丁醇提取物含药血清、水提取物含药血清和地塞米松含药血清中RAW264.7 细胞的存活率显著下降(P<0.05 或P<0.01),说明红鱼眼不同极性部位提取物含药血清在24 h后有明显的细胞毒性,而在6~12 h培养时间范围内,除红鱼眼水提取物含药血清外,其余不同极性部位提取物含药血清对RAW264.7细胞活力均无明显影响。
表1 红鱼眼不同极性部位提取物含药血清对RAW264.7细胞活力的影响()
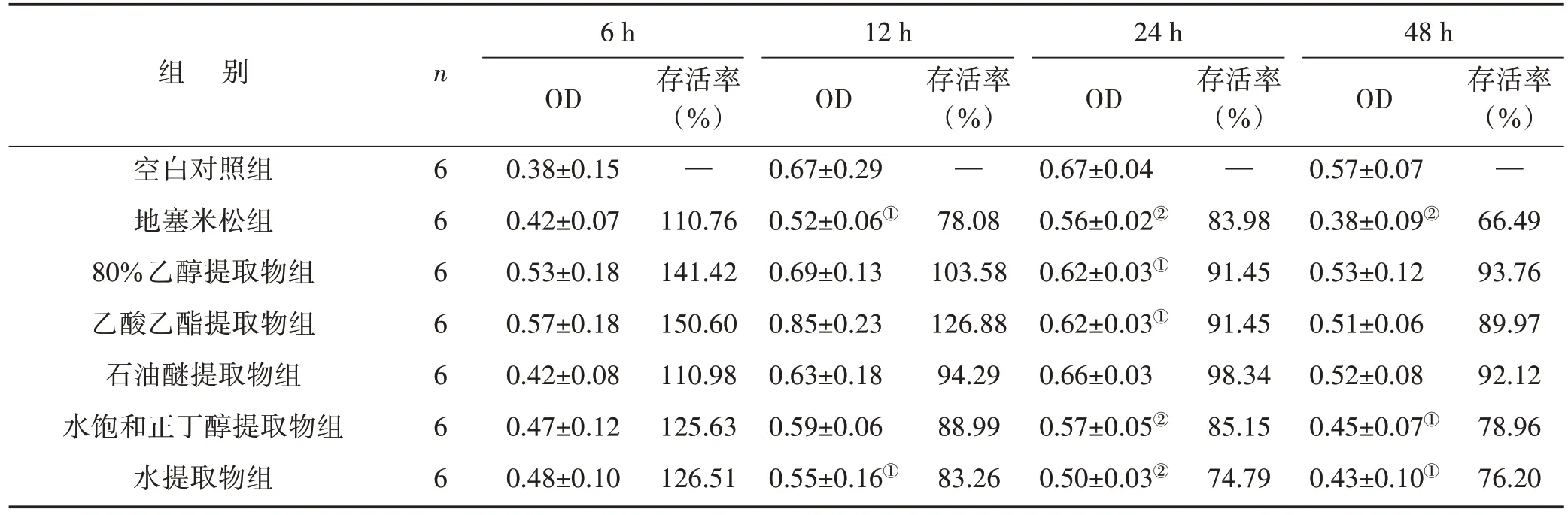
表1 红鱼眼不同极性部位提取物含药血清对RAW264.7细胞活力的影响()
注:与空白对照组比较,①P<0.05,②P<0.01
组 别空白对照组地塞米松组80%乙醇提取物组乙酸乙酯提取物组石油醚提取物组水饱和正丁醇提取物组水提取物组存活率(%)—66.49 93.76 89.97 92.12 78.96 76.20 n6 6 6 6 6 6 6 6 h OD 0.38±0.15 0.42±0.07 0.53±0.18 0.57±0.18 0.42±0.08 0.47±0.12 0.48±0.10存活率(%)—110.76 141.42 150.60 110.98 125.63 126.51 12 h OD 0.67±0.29 0.52±0.06①0.69±0.13 0.85±0.23 0.63±0.18 0.59±0.06 0.55±0.16①存活率(%)—78.08 103.58 126.88 94.29 88.99 83.26 24 h OD 0.67±0.04 0.56±0.02②0.62±0.03①0.62±0.03①0.66±0.03 0.57±0.05②0.50±0.03②存活率(%)—83.98 91.45 91.45 98.34 85.15 74.79 48 h OD 0.57±0.07 0.38±0.09②0.53±0.12 0.51±0.06 0.52±0.08 0.45±0.07①0.43±0.10①
3.2 红鱼眼不同极性部位提取物含药血清对LPS 诱导RAW264.7 细胞增殖的影响 见表2。结果显示,与空白对照组比较,LPS 模型组各培养时间段的OD值明显降低(P<0.01),表明LPS 对RAW264.7 细胞具有一定的抑制作用。与LPS 模型组比较,红鱼眼不同极性部位提取物组和地塞米松组各培养时间段的OD值和细胞存活率明显提高(P<0.01),表明红鱼眼不同极性部位提取物含药血清对LPS 诱导的RAW264.7 细胞具有显著的保护作用。
表2 红鱼眼不同极性部位提取物含药血清对LPS诱导RAW264.7细胞增殖的影响()
注:与空白对照组比较,①P<0.01;与LPS模型组比较,②P<0.01
组 别空白对照组LPS模型组地塞米松组80%乙醇提取物组乙酸乙酯提取物组石油醚提取物组水饱和正丁醇提取物组水提取物组存活率(%)—17.88 105.95 31.17 121.40 123.01 153.26 129.65 n6 6 6 6 6 6 6 6 6 h OD 1.38±0.33 0.33±0.06①1.67±0.32②1.37±0.25②1.35±0.29②1.74±0.29②1.62±0.22②1.91±0.27②存活率(%)—24.42 121.52 99.14 97.96 126.00 117.53 138.69 12 h OD 1.64±0.54 0.34±0.04①1.58±0.27②1.66±0.29②1.50±0.30②1.73±0.17②1.88±0.23②1.54±0.23②存活率(%)—20.42 96.15 101.02 91.28 105.07 114.30 93.71 24 h OD 0.65±0.03 0.21±0.10①0.68±0.08②0.59±0.09②0.64±0.06②0.73±0.07②0.71±0.03②0.70±0.03②存活率(%)—31.76 105.10 91.78 99.46 113.09 110.46 108.89 48 h OD 0.41±0.19 0.07±0.01①0.44±0.09②0.13±0.01②0.50±0.16②0.51±0.13②0.64±0.10②0.54±0.09②
3.3 红鱼眼不同极性部位提取物含药血清对NO、IL-1β、IL-6、TNF-α 含量的影响 见表3。结果显示,与空白对照组比较,LPS模型组RAW264.7细胞上清液的NO、IL-1β、IL-6、TNF-α 含量均显著增加(P<0.05 或P<0.01)。与LPS模型组比较,红鱼眼乙酸乙酯提取物组、石油醚提取物组、水提取物组和地塞米松组的NO、IL-1β、IL-6、TNF-α含量均显著降低(P<0.01);80%乙醇提取物组的IL-6、IL-1β含量均显著降低(P<0.01),NO含量明显升高(P<0.05),而对TNF-α含量无显著影响;水饱和正丁醇提取物组的IL-1β、NO、TNF-α 含量显著下降(P<0.01),而对IL-6含量无显著影响。
表3 红鱼眼不同极性部位提取物含药血清对NO、IL-1β、IL-6、TNF-α含量的影响()
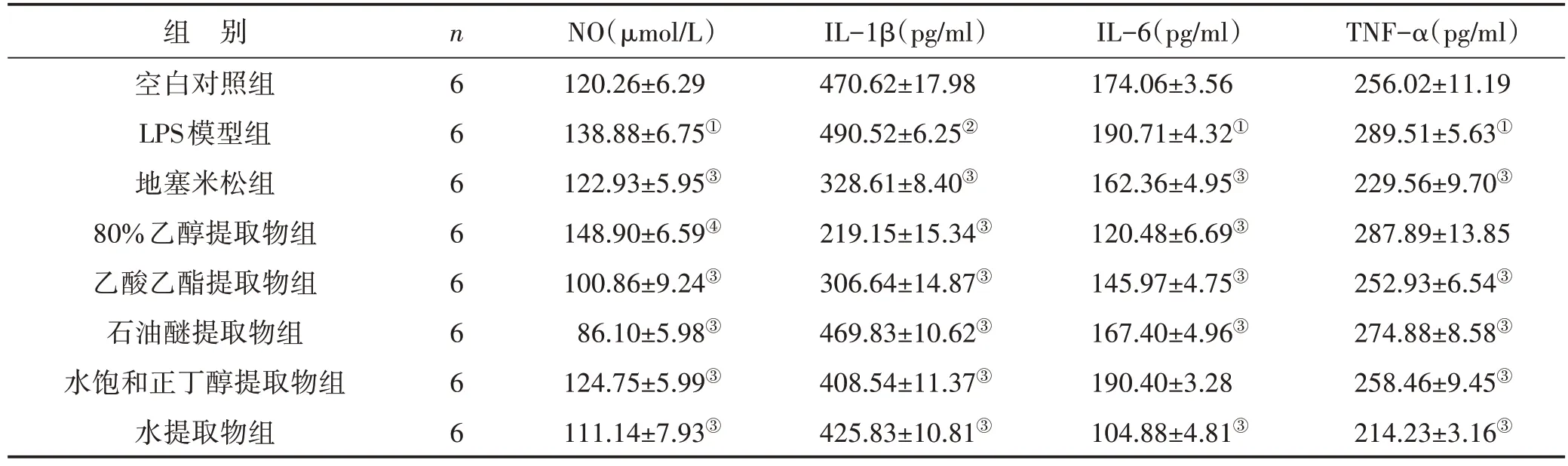
表3 红鱼眼不同极性部位提取物含药血清对NO、IL-1β、IL-6、TNF-α含量的影响()
注:与空白对照组比较,①P<0.01,②P<0.05;与LPS模型组比较,③P<0.01,④P<0.05
组 别空白对照组LPS模型组地塞米松组80%乙醇提取物组乙酸乙酯提取物组石油醚提取物组水饱和正丁醇提取物组水提取物组TNF-α(pg/ml)256.02±11.19 289.51±5.63①229.56±9.70③287.89±13.85 252.93±6.54③274.88±8.58③258.46±9.45③214.23±3.16③n6 6 6 6 6 6 6 6 NO(μmol/L)120.26±6.29 138.88±6.75①122.93±5.95③148.90±6.59④100.86±9.24③86.10±5.98③124.75±5.99③111.14±7.93③IL-1β(pg/ml)470.62±17.98 490.52±6.25②328.61±8.40③219.15±15.34③306.64±14.87③469.83±10.62③408.54±11.37③425.83±10.81③IL-6(pg/ml)174.06±3.56 190.71±4.32①162.36±4.95③120.48±6.69③145.97±4.75③167.40±4.96③190.40±3.28 104.88±4.81③
4 讨 论
LPS 是肠内毒素的一类主要代谢成分,可诱导细胞释放大量细胞因子,从而加重炎症反应,常用于建立各种炎症模型[11]。巨噬细胞作为参加炎症反应的中心细胞,具有一定的吞噬、分泌和呈递抗原等作用,是炎症细胞因子的主要来源,其中NO、TNF-α、IL-6是巨噬细胞产生的重要炎症介质[12]。NO具有增强细胞毒性的作用[13]。TNF-α为促炎细胞因子,能促使关节滑膜细胞增殖,诱导滑膜细胞产生炎症因子。IL-6含量增加时,可引发急性期应答诱导、滑膜成纤维细胞增殖等作用。IL-1β大量产生时能引起发热和恶病质。
研究发现,红鱼眼醇提物能降低小鼠耳廓肿胀度,且能降低渗出液中前列腺素E2(PGE2)的含量,说明红鱼眼具有一定的抗炎作用[7-8]。目前,常用LPS建立巨噬细胞炎症模型,当巨噬细胞被激活后,其释放炎症介质会增加[14-19]。本文通过体外分离手段建立由LPS 抗原诱导出的巨噬细胞RAW264.7 细胞增殖过程的免疫炎症模型,探讨红鱼眼不同极性部位提取物含药血清对LPS 诱导RAW264.7 细胞炎症因子分泌的影响。研究中采用MTT 比色法测定红鱼眼不同极性部位提取物含药血清对RAW264.7 细胞活力的影响,发现在6~12 h 培养时间内,除红鱼眼水提取物含药血清外,其余极性部位提取物含药血清对RAW264.7 细胞活力均无明显影响,而在24 h 后细胞存活率明显降低,因此选择在6~12 h 内观察红鱼眼不同极性部位提取物含药血清的抗炎效果。实验结果显示,与LPS 模型组比较,红鱼眼不同极性部位含药血清对RAW264.7细胞增殖有促进作用。红鱼眼乙酸乙酯提取物、石油醚提取物、水提取物的含药血清均能显著抑制NO、IL-1β、IL-6、TNF-α 的分泌,80%乙醇提取物的含药血清能显著抑制IL-6、IL-1β 的分泌,水饱和正丁醇提取物含药血清能显著抑制IL-1β、NO、TNF-α 的分泌,表明红鱼眼不同极性部位提取物含药血清具有一定的抗炎作用,其作用可能是通过抑制炎症反应中NO、IL-1β、IL-6、TNF-α 的释放来实现。

