MMT暴露对大鼠体质量、脏器系数、锰浓度的影响及相关性分析
黄昭莹,卢丽郦,朱其凤*
(1.广西中医药大学研究生院,广西 南宁 530200;2.广西中医药大学附属瑞康医院,广西 南宁 530011)
锰(Mn)是广泛存在于自然界里的一种金属元素,也是人体生长发育必不可少的微量元素,参与机体的多种生理过程,但体内锰含量过多会对机体产生严重的器官毒性[1]。有研究表明,过量的锰能够干预机体内线粒体代谢及神经递质表达而直接损伤神经系统[2];同时,血锰高水平状态被证实与脂肪性肝病和肝纤维化高度相关[3]。此外,长期暴露在高锰环境下,肺的通气功能随着暴露时间的延长会逐渐下降[4],对肾脏、脾脏也产生毒性作用[5]。甲基环戊二烯三羰基锰(methylcyclopentadienyl manganese tricar-bonyl,MMT)是一种有机含锰化合物[(CH3C5H4)Mn(CO)3],为黄色液体,具有易挥发、脂溶性强和微溶于水等特点[6],近年来,随着工业、采矿业、制造业的快速发展,汽油被广泛使用,MMT 作为汽油抗爆剂也随之大量被使用,导致环境中锰含量增高,人们在日常生活中接触锰的机会增多,可能导致一般人群体内锰含量失衡,进而产生毒性作用,损害体内脏器功能。动物急性MMT 暴露会导致肝、脾、肺和肾损害,并出现虚弱、抽搐和呼吸困难[7-8]。因此,本研究通过观察MMT 暴露SD 大鼠体质量增长情况、大鼠实质性脏器(心脏、肝脏、脾脏、肺脏、肾脏)的脏器系数和锰含量,并对实质性脏器质量与锰含量进行相关性分析,探讨MMT 暴露对SD 大鼠实质性脏器的影响,以便为临床提供实验依据。
1 实验材料
1.1 动物 8 周龄SPF 级SD 大鼠,雄雌各半,由广西医科大学实验动物中心提供,动物合格证号:SCXK(桂)202010018。将大鼠饲养于可控的SPF 级环境条件下,室温为(22±2)℃,湿度范围为(50±5)%,光暗周期为12 h/12 h,每日添加饲料、饮水,大鼠可自由饮水采食。动物研究根据《实验动物和福利伦理审查指南》(标准号:GB/T 35892-2018)进行。
1.2 试剂与仪器 甲基环戊二烯三羰基锰(MMT)、MnCl2·4H2O(无机MnCl2,由上海麦克林生化科技有限公司提供,货号:203637-22);电子分析天平(上海恒平科学仪器有限公司);制冰机(日本松下电器产业株式会社);医用低温保存箱(青岛海尔集团)。
2 实验方法
2.1 动物分组 取30只SD大鼠(雌雄各半),将15只雄性SD 大鼠按随机区组法分为正常对照组、MMT 低剂量组(L-MMT 组,1 mg/kg)、MMT中剂量组(M-MMT组,2 mg/kg)、MMT高剂量组(H-MMT组,4 mg/kg)和Mn-Cl2·4H2O组(MnCl2组,200 mg/kg),每组3只。另将15只雌性SD 大鼠按上述方法分为5 组,每组3 只。
2.2 动物处理 MMT 和无机MnCl2染毒剂量根据文献[9-10]确定。MMT 低、中、高剂量组分别予经口灌胃MMT 溶液(1 mg/kg、2 mg/kg、4 mg/kg,溶于玉米油),MnCl2组大鼠经口灌胃MnCl2·4H2O(200 mg/kg,溶于生理盐水),正常对照组大鼠经口灌胃玉米油,各组灌胃体积均为1 ml/kg。每日1 次,每周6 d,连续8 周。
2.3 观察指标
2.3.1 体质量 每天测定SD 大鼠体质量,评估其生长发育情况,并根据当天大鼠体质量调整MMT 和Mn-Cl2的剂量。
2.3.2 脏器系数指标 每组取3 只雄性大鼠和3 只雌性大鼠断头处死后进行腹主动脉采血,镊子分离心、肝、脾、肺、肾脏器后,用滤纸将各器官的血水拭干,称量并记录各器官质量。脏器系数(%)=脏器质量/空腹体质量×100%[11]。
2.3.3 组织锰含量测定 首先使用微波消解技术将大鼠的心脏、肝脏、脾脏、肺脏、肾脏样本放入5 ml 浓硝酸中消解。硝酸消解程序设定:温度爬升至100 ℃保持消化10 min,然后在温度爬升至180 ℃时保持20 min。微波消解仪消解结束后冷却至室温,将所得溶液在150 ℃石墨电热板上赶酸。最后将所得澄清透亮溶液转移至15 ml 离心管,使用超纯双蒸水定容至6 ml 浓硝酸中消解,使用电感耦合等离子体质谱仪(ICP-MS)分析锰浓度。
2.4 统计学处理 采用SPSS 21.0 统计软件进行统计分析。计量资料以均数±标准差表示,符合正态分布采用Pearson 进行相关性分析,若不符合正态分布,用Spearman 进行相关性分析,并用Levene 检验方差的同质性。组间比较通过单因素方差分析(ANOVA),然后进行Tukey事后检验。P<0.05为具有显著性差异。
3 结 果
3.1 各组大鼠体质量比较 在干预前,各组大鼠的体质量比较差异无统计学意义。干预后与正常对照组比较,MMT 各剂量组和MnCl2组的雄性大鼠和雌性大鼠的体质量增长均有所下降。与正常对照组比较,MnCl2组干预第2 周、第3 周后雄性大鼠的体质量增长下降(P<0.05)。与MnCl2组大鼠比较,第2 周L-MMT和M-MMT 组的雄性大鼠体质量明显增长(P<0.05),而H-MMT 组和MnCl2组雄性大鼠的体质量比较差异无统计学意义(P>0.05)。干预后第2 周、第3 周,H-MMT 组雌性大鼠体质量较正常对照组下降,差异有统计学意义(P<0.05)。其余组大鼠的体质量与正常对照组比较差异无统计学意义(P>0.05)。结果见表1。
表1 各组大鼠体质量比较(g,)
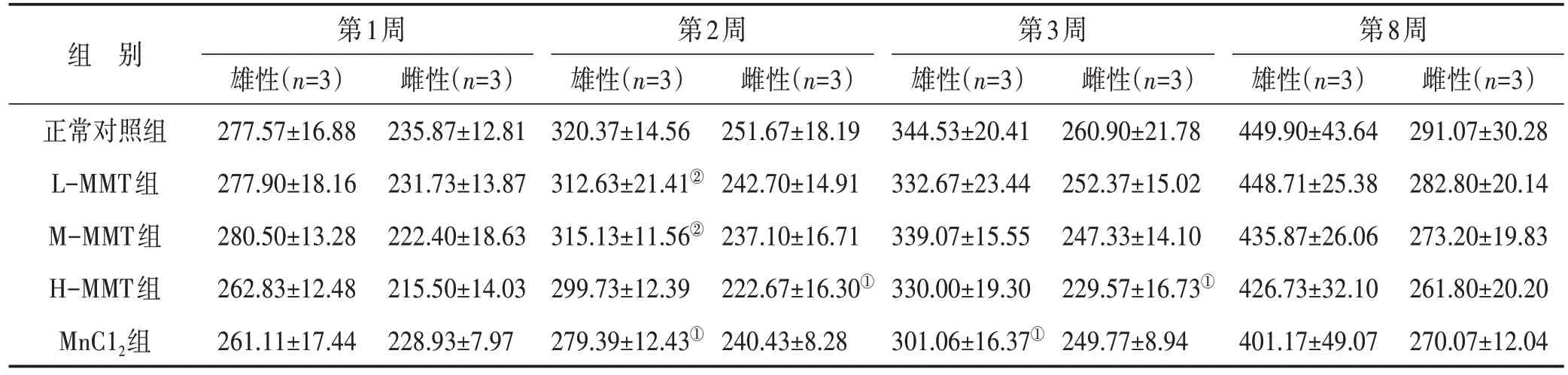
表1 各组大鼠体质量比较(g,)
注:与正常对照组同性别、同时间点比较,①P<0.05;与MnCl2组同性别、同时间点比较,②P<0.05
组 别第1周雄性(n=3)277.57±16.88 277.90±18.16 280.50±13.28 262.83±12.48 261.11±17.44雌性(n=3)291.07±30.28 282.80±20.14 273.20±19.83 261.80±20.20 270.07±12.04雌性(n=3)235.87±12.81 231.73±13.87 222.40±18.63 215.50±14.03 228.93±7.97正常对照组L-MMT组M-MMT组H-MMT组MnC12组第2周雄性(n=3)320.37±14.56 312.63±21.41②315.13±11.56②299.73±12.39 279.39±12.43①雌性(n=3)251.67±18.19 242.70±14.91 237.10±16.71 222.67±16.30①240.43±8.28第3周雄性(n=3)344.53±20.41 332.67±23.44 339.07±15.55 330.00±19.30 301.06±16.37①雌性(n=3)260.90±21.78 252.37±15.02 247.33±14.10 229.57±16.73①249.77±8.94第8周雄性(n=3)449.90±43.64 448.71±25.38 435.87±26.06 426.73±32.10 401.17±49.07
3.2 各组大鼠实质性脏器系数比较 干预8 周后,与正常对照组比较,L-MMT 组、H-MMT 组和MnCl2组雄性大鼠心脏系数较小,差异有统计学意义(P<0.05)。H-MMT组雌性大鼠肝脏系数比正常对照组小(P<0.05),L-MMT 组、M-MMT 组和MnCl2组雌性大鼠肺脏系数较正常对照组小,差异有统计学意义(P<0.05)。其余组大鼠脏器系数与正常对照组比较差异无统计学意义(P>0.05)。与MnCl2组大鼠比较,H-MMT 组雌性大鼠肺脏系数较大,差异具有统计学意义(P<0.01)。然而,L-MMT 组、M-MMT 组雌性大鼠肺脏系数与MnCl2组大鼠比较差异无统计学意义(P>0.05)。此外,与雌性大鼠比较,部分组别雄性大鼠在心脏、肺脏和肾脏系数均降低,差异具有统计学意义(P<0.05 或P<0.01);肝脏、脾脏系数未见性别差异(P>0.05)。结果见表2。
表2 各组大鼠实质性脏器系数比较(%,)
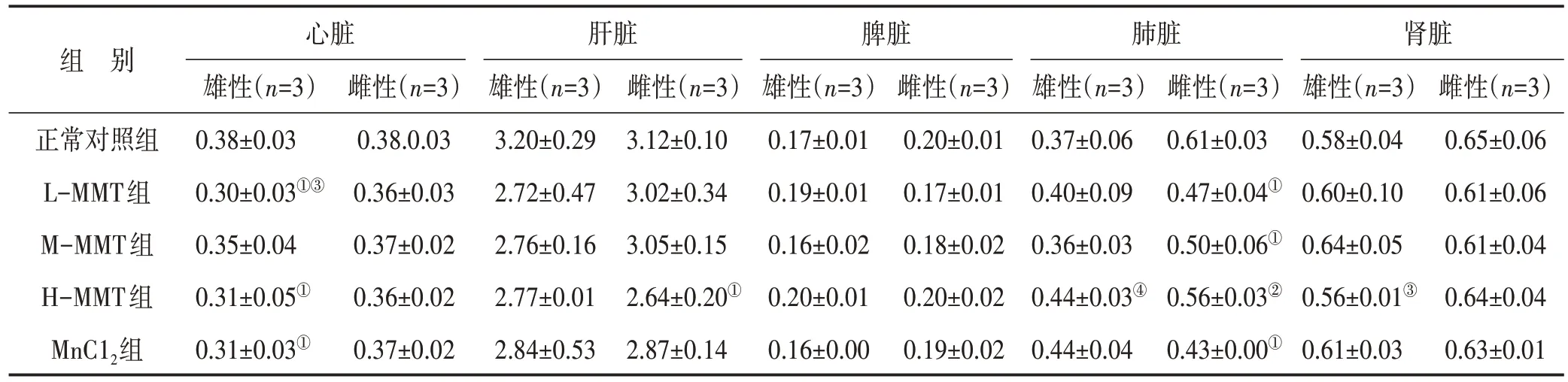
表2 各组大鼠实质性脏器系数比较(%,)
注:与正常对照组同性别比较,①P<0.05;与MnCl2组同性别比较,②P<0.01;与同暴露程度雌性大鼠比较,③P<0.05,④P<0.01
组 别正常对照组L-MMT组M-MMT组H-MMT组MnC12组雌性(n=3)0.65±0.06 0.61±0.06 0.61±0.04 0.64±0.04 0.63±0.01心脏雄性(n=3)0.38±0.03 0.30±0.03①③0.35±0.04 0.31±0.05①0.31±0.03①雌性(n=3)0.38.0.03 0.36±0.03 0.37±0.02 0.36±0.02 0.37±0.02肝脏雄性(n=3)3.20±0.29 2.72±0.47 2.76±0.16 2.77±0.01 2.84±0.53雌性(n=3)3.12±0.10 3.02±0.34 3.05±0.15 2.64±0.20①2.87±0.14脾脏雄性(n=3)0.17±0.01 0.19±0.01 0.16±0.02 0.20±0.01 0.16±0.00雌性(n=3)0.20±0.01 0.17±0.01 0.18±0.02 0.20±0.02 0.19±0.02肺脏雄性(n=3)0.37±0.06 0.40±0.09 0.36±0.03 0.44±0.03④0.44±0.04雌性(n=3)0.61±0.03 0.47±0.04①0.50±0.06①0.56±0.03②0.43±0.00①肾脏雄性(n=3)0.58±0.04 0.60±0.10 0.64±0.05 0.56±0.01③0.61±0.03
3.3 各组大鼠实质性脏器锰浓度比较 MMT 各剂量组、MnCl2组大鼠心脏、肝脏、脾脏、肺脏及肾脏锰浓度较正常对照组升高,多数存在显著性差异(P<0.05 或P<0.01)。与MnCl2组比较,L-MMT 组雄性大鼠肺脏、肾脏锰浓度显著升高(P<0.05);M-MMT 组雄性大鼠肾脏及雌性大鼠肺脏、肾脏锰浓度显著升高(P<0.05或P<0.01);H-MMT 组雄性大鼠肝脏、脾脏、肺脏、肾脏及雌性大鼠心脏、脾脏、肺脏及肾脏锰浓度显著升高(P<0.05或P<0.01)。此外,MMT各剂量组雌性大鼠脾脏锰浓度高于雄性大鼠,雄性大鼠肝脏锰浓度显著高于雌性大鼠,差异有统计学意义(P<0.05)。结果见表3。
表3 各组大鼠实质性脏器锰浓度比较(μg/g,)
注:与正常对照组同性别比较,①P<0.05,②P<0.01;与MnCl2组同性别比较,③P<0.05,④P<0.01;与同暴露程度雌性大鼠比较,⑤P<0.05
组 别雌性(n=3)0.37±0.03 0.46±0.04 0.71±0.06②④0.98±0.05②④0.45±0.03正常对照组L-MMT组M-MMT组H-MMT组MnC12组心脏雄性(n=3)0.16±0.02 0.20±0.01 0.34±0.02①0.41±0.01②0.31±0.09①雌性(n=3)0.13±0.01 0.21±0.02 0.25±0.01①0.41±0.07②③0.26±0.01①肝脏雄性(n=3)1.12±0.13 2.02±0.11①⑤2.52±0.16②⑤3.66±0.21②④⑤2.26±0.14①雌性(n=3)1.09±0.13 1.69±0.18①1.99±0.04②2.18±0.10②1.85±0.15②脾脏雄性(n=3)0.20±0.02 0.26±0.04⑤0.30±0.01①⑤0.46±0.02②④0.27±0.04⑤雌性(n=3)0.25±0.03 0.36±0.01 0.43±0.03①0.54±0.09②③0.37±0.04肺脏雄性(n=3)0.13±0.04 0.78±0.02②③1.28±0.10②1.79±0.17②④1.14±0.02②雌性(n=3)0.13±0.01 0.56±0.11①1.23±0.13②③2.23±0.16②④0.74±0.14①肾脏雄性(n=3)0.49±0.04 1.05±0.03②③1.44±0.09②④1.87±0.01②④0.82±0.08②
3.4 锰暴露大鼠脏器质量与锰浓度的相关性分析 除雄性大鼠肝脏质量与锰浓度的相关系数(R值)差异有统计学意义(P<0.01)外,其余各脏器质量与锰浓度相关性分析均无显著性差异(P>0.05),见表4。

表4 MMT暴露大鼠实质性脏器质量与锰浓度的相关性分析(n=3)
4 讨 论
体质量是评价大鼠生长发育的一项直观且重要的指标,可以反映毒物对生物体整体生长的影响,是动物实验、医学研究观察必不可少的基础数据。体质量增长的变化通常用于评价药物、各类化学物对实验动物的毒性作用。同样,在人体的临床研究中,体质量指数(body mass index,BMI)是国际上常用的基于人体身高、体重的测量方法,目前已广泛应用于评估高血压、糖尿病、癌症、高胆固醇血症和其他慢性疾病的风险及相关性研究。本次关于MMT 的动物实验研究结果发现,MMT 和MnCl2均可导致雄性和雌性SD 大鼠体质量增长速度下降,表明锰暴露会延缓SD 大鼠的生长发育,验证了之前的研究结果[12]。结果还显示,与正常对照组比较,H-MMT 组雌性大鼠体质量增长较少,这表明高剂量MMT(4 mg/kg)可能对雌性大鼠造成了更明显的毒性倾向,也说明雌性大鼠对MMT的敏感性较雄性大鼠高。有实验研究报道,腹腔内注射MnCl2会导致SD 雄性大鼠体质量持续下降[13]。本研究结果显示,MnCl2组雄性大鼠的体质量增长小于正常对照组。同时还发现,雄性L-MMT 组、M-MMT组和MnCl2组体质量增长比较存在显著性差异,其原因可能是由于低剂量产生的毒性作用较弱。H-MMT组与MnCl2组比较差异无统计学意义,表明高剂量MMT 与MnCl2致大鼠体重增长速度下降作用相似,这为有机MMT、无机MnCl2的锰毒性研究提供了相关剂量参考。同样,Nachtman 等[14]研究指出,给予MnCl2(1.0 mg/ml)饮用水的大鼠中,在13周内在不同暴露水平下各组之间的体质量比较无显著性差异。
脏器系数指标在毒理研究中可以反映各类有毒物质对动物脏器损害的严重程度,常用于评价药物安全。当动物脏器受损、充血、水肿或增生时,脏器系数会增大。锰一旦进入血液循环,就会分布到肝脏、肺脏和肾脏等组织器官[15],根据生长指标评估毒物的毒性终点,本研究分析了有机MMT 和无机MnCl2不同形式锰暴露大鼠下的心脏、肝脏、脾脏、肺脏、肾脏的脏器系数。有研究报道,锰对大鼠心脏的影响是迅速且可逆的,急性期大鼠心脏积累的锰不影响心功能和能量代谢[16]。在本研究中,L-MMT、H-MMT 及MnCl2组雄性大鼠心脏系数较正常对照组降低。另外,锰暴露会导致肺部引起炎症、细胞损伤和纤维化[17]。在本研究中,L-MMT 组、M-MMT 组及MnCl2组雌性大鼠肺脏系数较正常对照组降低。但是,H-MMT组与MnCl2组相比,雌性大鼠肺脏系数较正常对照组大,提示可能与锰剂量相关。脏器系数的改变存在性别差异,与雌性大鼠相比,雄性大鼠在心脏、肺脏和肾脏系数均降低。此外,与MnCl2组大鼠比较,H-MMT 组雌性大鼠肺脏系数升高,差异具有统计学意义。然而,L-MMT组和M-MMT 组雌性大鼠肺脏系数与MnCl2组大鼠比较差异未见统计学意义。
本研究结果表明,MMT 和无机MnCl2染毒均可导致锰在大鼠实质性脏器中沉积。MMT 各剂量组、Mn-Cl2组大鼠的心脏、肝脏、脾脏、肺脏及肾脏中的锰浓度显著升高,提示锰暴露造模有效。本研究结果表明,与MnCl2相比,更高剂量的MMT 暴露会导致实质性脏器更高的锰浓度。
值得注意的是,在既往研究中使用大鼠模型类似的动物模型实验表明,锰在肝脏中的含量最高,其次是肾脏和心脏[18]。本研究结果,所有雄雌性大鼠的最大脏器系数均为肝脏系数。锰迅速从血液分布到肝脏,到达脾脏的量较少。肝脏是以代谢功能为主的器官,主要参与营养物质、药物和毒物的代谢,造血和凝血功能及胆汁的分泌等[19]。肝脏和胆道排泄是锰排泄的主要途径[20],因此,锰从血液到肝脏的快速消除过程可能部分是从肝脏通过胆汁代谢。本研究结果还显示,雄性大鼠肝脏中锰浓度高于雌性大鼠,提示雄性大鼠中MMT 消除较慢。由于毒性代谢的性别差异已在许多研究中得到证实[21-22],故本研究假设MMT的性别依赖性代谢可能是其原因。
本研究对MMT 暴露大鼠脏器质量与锰浓度的相关性分析显示,雄性大鼠肝脏质量与锰浓度存在显著相关性(P<0.01),且呈负相关。肝脏作为全身最大的代谢和解毒脏器,在锰清除过程中发挥着重要作用。MMT暴露可能对大鼠的肝脏组织产生毒性作用,导致肝脏组织充血、水肿或增生肥大[23]。不仅如此,肝脏是一个可以受性激素调控的器官,雌激素通过卵巢内分泌对肝脏生理功能发挥重要的调控作用[24]。血管内皮生长因子(VEGF)是评估肝脏病变的常用指标,在既往比较研究雄雌性大鼠对有毒、有害物质造成的肝损伤实验中发现,雄性大鼠肝组织中VEGF 的阳性细胞较雌性大鼠表达更为显著,说明雄性大鼠肝损伤后修复能力较强[25]。有研究发现,MMT 暴露后,雄性大鼠的表观分布容积与雌性大鼠相似,但雄性大鼠的锰表观清除率是雌性大鼠的2 倍[26]。因此,雄性大鼠的肝脏质量与锰浓度存在负相关性可能与性别差异有关。
综上所述,MMT 和无机MnCl2暴露会减缓大鼠体质量的增长,同时,MMT 和无机MnCl2暴露可导致大鼠心脏、肝脏、脾脏、肺脏和肾脏的锰浓度升高。职业、环境或医源性锰来源都可能导致人体过量锰暴露,且长期接触生长性毒物的职业人群锰暴露风险更高,而环境中燃烧产物所致的锰污染也会使人群锰暴露的风险增高。但目前关于MMT 过量暴露对脏器毒性的机制并未完全清楚,锰对脏器毒性的相关实验研究不够完善,流行病学调查多为描述性结果,且研究样本量偏小。因此,需要更多实验数据及流行病学研究来进一步探索、检验和验证MMT 过量暴露致实质性脏器毒性的作用机制,为MMT 与锰毒性防治、制订预防对策提供科学参考。

