青海湖一株野鸟源H5N1亚型禽流感病毒核酸检测及其基因组序列特性分析
田 野,崔明仙,颜 焰,简莹娜,王光华,王戈平,李秀萍,胡 勇,廖 敏*,马利青*
(1.浙江大学农业农村部动物病毒学重点实验室,浙江 杭州 310058;2.青海大学畜牧兽医科学院,青海省动物疫病病原诊断与绿色防控技术研究重点实验室,青海 西宁 810016)
2005年5月,我国首次报道了野生鸟类感染禽流感病毒,造成大批鸟类死亡[1,2]。此次疫情发生在青海省刚察县泉吉乡年乃索麻村的青海湖国家级自然保护区,该区的斑头雁最先出现死亡病例,之后多种迁徙鸟类相继死亡,死亡数达6 000余只,后经国家相关部门确诊为H5N1亚型禽流感病毒感染造成的疫情[2],这是世界流感流行史上首次发生的野鸟H5N1高致病性禽流感疫情,此后至2006年5月,H5N1高致病性禽流感遍布亚洲、欧洲、北美30多个国家,几十种野鸟和家禽被感染[3,4]。青海湖野鸟感染禽流感疫情爆发的时间和地点基本与候鸟的迁徙路线一致,可见候鸟在禽流感病毒传播中起非常关键的作用。
青海湖是我国最大的内陆咸水湖,每年栖息的水鸟数以万计,被称为“鸟的天堂”,但不同来源背景的鸟类聚集,也使禽流感病毒得以交汇,容易引发禽流感疫情,造成野生鸟类发病或死亡,同时还可能将禽流感病毒传染给家禽。因此,对青海湖野鸟进行禽流感检测仍然非常必要。
本研究于2022年8月收到青海省刚察县林草站送检的死亡野鸟尸体,经核酸检测发现含有H5亚型AIV核酸片段,通过深度测序获得一株H5N1 AIV的全基因组序列。研究该毒株主要基因片段的序列特征,可为了解鸟类携带H5N1亚型禽流感病毒的演化规律提供数据。
1 材料与方法
1.1 样品来源
样品来自青海省刚察县林草站送检的野鸭尸体。H5N1病毒阳性核酸模板由农业农村部动物病毒学重点实验室提供,实验操作也在该实验室完成。
1.2 主要试剂
Trizol、PCR Mix、高保真酶、反转录试剂盒均购自南京诺维赞公司。
1.3 RNA抽提及RT-PCR扩增
取死禽病变组织加入适当的PBS充分混匀后,反复冻融3次,10 000 rpm离心5 min,取上清,按常规方法(Trizol法)进行RNA抽提。抽提的RNA按反转录试剂盒说明书进行反转录,获得cDNA。
1.4 禽流感病毒核酸检测
用实验室针对禽流感病毒M基因设计的各亚型通用引物(表1),以反转录获得的cDNA为模板进行PCR扩增,确定样品中是否含有AIV核酸。对M基因PCR阳性的样品进一步用H5、H7和H9 3种亚型的基因型鉴定引物(表1)鉴定该流感病毒为何种亚型。扩增体系总体积为20 μL,包括2×Taq Plus Master Mix 10 μL、10 mM的上下游引物各1 μL、cDNA 1 μL、ddH2O 7 μL。反应程序为95℃预变性5 min,30~35个循坏,每个循环包括:95℃变性30 s,56℃退火30 s,72℃延伸30~60 s,最后72℃延伸10 min。反应产物用1%琼脂糖凝胶电泳进行鉴定。

表1 引物信息表
1.5 基因组测序及分析
取部分上述抽提的RNA送上海晶能生物公司进行深度二代测序。测序获得的序列用SPAdes软件进行序列拼接获得流感病毒的8个基因片段序列,序列的基本信息见表2。在GISAID流感数据库中对获得的流感病毒的8个基因片段进行检索和比对分析。下载GISAID流感数据库中收录的青海野鸟H5亚型毒株的各基因序列及代表性毒株的HA和NA序列,采用MEGA 7.0软件对基因组测序获得的HA和NA基因片段进行系统进化树分析,同时对HA氨基酸糖基化位点进行分析(https://services.healthtech.dtu.dk/services/NetOGlyc-4.0/)。

表2 A/Wigeon/Qinghai/2022(H5N1) 8个基因片段信息
2 结果
2.1 死禽外观及肉眼剖检病变
送检野鸭身体僵硬,羽毛杂乱。经剖检可见肺部、气管和支气管出血严重,肠道出血,肝脏质脆易碎。
2.2 核酸检测及分型鉴定结果
从采集的气管、肺抽提的核酸成功扩增到AIV特异性的M基因片段(详见图1),进一步用实验室设计的AIV H5、H7、H9分型引物对AIV阳性的核酸进行分型鉴定,结果只有野鸟组织样品和阳性对照样品中检测到H5亚型AIV阳性,H7和H9亚型AIV为阴性(详见图2)。
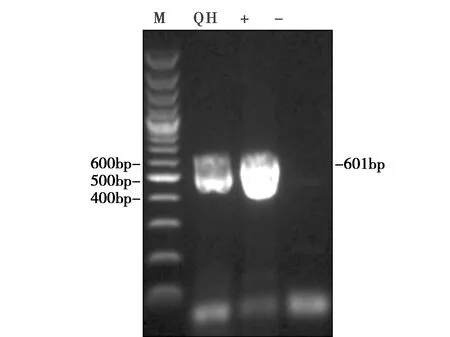
图1 组织样品中的检测结果

图2 AIV亚型检测结果
2.3 AIV基因组二代测序结果
从组织中抽提的RNA经二代测序拼接后,获得了AIV的8个基因序列,其核苷酸长度及其编码氨基酸序列长度如表2所示。经序列比对分析,除了NS基因的氨基酸序列与H6N2、H5N3亚型AIV有较高相似性外,各基因片段的氨基酸与H5N1亚型AIV相应片段的同源性最高(详见表2)。结合核酸检测和分型鉴定结果,认为样品中含有H5N1亚型禽流感病毒基因组,死亡的野鸭感染了H5N1亚型禽流感病毒。本研究所鉴定的H5N1亚型AIV命名为A/Wigeon/Qinghai/2022(H5N1)。
2.4 HA基因分析
HA基因的同源性分析显示,A/Wigeon/Qinghai/2022(H5N1)的HA基因与国内最先发现的H5N1亚型毒株A/Goose/Guangdong/1/96(H5N1)的同源性为91.03%,与2005年引起青海湖野鸟爆发禽流感疫情的毒株A/bar-headed goose/Qinghai/0510/05(H5N1) HA同源性为91.55%,与近年来在野鸭中流行的毒株A/wild duck/Hebei/SD012/2021(H5N1)同源性则达99.12%。
A/Wigeon/Qinghai/2022(H5N1)HA的裂解位点为“PLREKRRKRGLF”,与多株高致病性H5Nx毒株一致,具有5个连续的碱性氨基酸“KRRKR”[5,6],且含有27NST29、39NVT41、140NHT142、180NNT182、208NPT210、301NSS303、498NGT500、557NGS559糖基化位点,符合高致病性禽流感病毒的分子特征。根据世界卫生组织对高致病性禽流感病毒的分类规则[7],在基于HA基因的遗传进化分析中发现,A/Wigeon/Qinghai/2022(H5N1)归属于高致病性禽流感病毒2.3.4.4b分支(详见图3),与2020年以来在青海湖地区流行的野鸟和野鸭的H5N1在同一小分支中,而与2015年以前青海湖地区流行的毒株遗传距离较远。

图3 HA基因的遗传进化分析
2.5 NA基因分析
NA基因的同源性分析显示,A/Wigeon/Qinghai/2022(H5N1)的NA基因与国内最先发现的H5N1亚型毒株A/Goose/Guangdong/1/96(H5N1)的同源性为93.22%,与2005年引起青海湖地区野鸟爆发禽流感的毒株A/bar-headed goose/Qinghai/0510/05H5N1 HA同源性为88.35%,与近年来在野鸭中流行的毒株A/wild duck/Hebei/SD012/2021(H5N1)同源性为97.03%。在基于NA基因的遗传进化分析中发现,A/Wigeon/Qinghai/2022(H5N1)与所有用于分析的青海地区流行的H5N1毒株和在广东最先分离到的H5N1毒株归属于同一个分支,而N5和N6亚型的毒株则归属于不同的分支中(详见图4)。

图4 NA基因的遗传进化分析
3 讨论
自2005年大量野生候鸟感染高致病性禽流感(HPAI)病毒(H5N1)的疫情发生以来,有关青海湖地区野鸟携带H5亚型AIV的报道一直没有间断。2022年青海湖地区又出现了野禽非正常死亡的现象。本研究从一只死亡的野鸭组织中检测到H5亚型AIV,将测序获得的A/Wigeon/Qinghai/2022(H5N1) 8个基因序列进行比对分析,除了NS蛋白与H6N2、H5N3具有最高的同源性外,其余基因片段与野禽或家禽来源的H5N1亚型AIV遗传距离最近,进一步全基因组测序分析表明野鸭感染的毒株为H5N1亚型AIV,将其命名为A/Wigeon/Qinghai/2022(H5N1)。
为进一步了解2022年在青海湖地区流行的H5N1毒株的分子特性,我们下载了青海湖地区不同时期流行的毒株序列,与最先在禽类中流行的H5N1亚型毒株以及最近几年在野鸟中流行的参考毒株进行比较发现,A/Wigeon/Qinghai/2022(H5N1) HA氨基酸序列与国内最先发现的H5N1亚型毒株A/Goose/Guangdong/1/96(H5N1)的同源性为91.03%,与2005年引起青海湖野鸟爆发禽流感疫情的毒株A/bar-headed goose/Qinghai/0510/05 (H5N1)HA同源性为91.55%,与近年来在野鸭中流行的毒株A/wild duck/Hebei/SD012/2021(H5N1)同源性则达99.12%;NA蛋白与上述3个序列的同源性则分别为93.22%、88.35%和97.03%。同源性分析结果表明,2022年的毒株A/wigeon/Qinghai/2022(H5N1)与1996年出现的H5N1以及2005年青海湖地区流行的毒株HA基因的同源性均较低,为91%左右,与这两个基因的遗传进化树分析结果一致。
A/Wigeon/Qinghai/2022(H5N1)HA的裂解位点为“PLREKRRKRGLF”,含有5个连续的碱性氨基酸“KRRKR”,具有高致病性禽流感的特征。“PLREKRRKRGLF”裂解位点在H5N1、H5N2、H5N5、H5N8亚型中有过报道,感染的宿主有家禽、野鸟和人[8]。此外,糖基化分析表明,A/Wigeon/Qinghai/2022(H5N1)HA基因含有8个潜在的糖基化位点27NST29、39NVT41、140NHT142、180NNT182、208NPT210、301NSS303、498NGT500、557NGS559,其中NST、NVT、NNT、NSS、NGT、NGS为大多数致病性H5亚型毒株所共有[9,10]。HA裂解位点和糖基化位点分析结果表明A/Wigeon/Qinghai/2022(H5N1)具有高致病性禽流感的特征。
在以HA基因构建的遗传进化树中,A/Wigeon/Qinghai/2022(H5N1)被归入2.3.4.4b的分支,与2016年后在青海地区鉴定到的毒株归属于同一分支[11]。自2020年底以来,2.3.4.4b分支的HPAI H5N1已成为在野生和家养禽类中流行的主要亚型[5]。根据世界卫生组织对H5亚型AIV的分型标准[7],依据HA基因的遗传进化树进行分析发现,2005年在青海流行的毒株被归类至2.2分支。随后,在鸟类迁徙路线途经的国家和地区先后发现了该基因型毒株。2006—2009年,在中国、蒙古、俄罗斯、德国、埃及和尼日利亚的野禽中都分离到了2.2分支的病毒[3,4],但很少有2.2分支的病毒感染家禽的报道。2009-2015年,青海湖地区流行的AIV又进一步演化,出现了2.3.2分支的病毒[12]。从野鸟中分离到的2.3.2分支病毒均是在候鸟迁徙路线上分离到的,表明迁徙候鸟在传播AIV中发挥了重要作用。2015年至今,在青海湖地区分离到的毒株进化为2.3.4.4分支,而且这一分支病毒除了感染野禽,还引起世界范围内的家禽感染死亡[8]。本研究HA进化分析的结果显示,2006年以前青海湖地区流行的毒株主要归属于2.2分支,2007年进化到2.3.2分支,2015年再进化到2.3.4分支,表明病毒是不断进化的。因此,持续开展对青海湖地区野鸟中携带的AIV的监测,对了解AIV的流行、进化以及防控措施的制定具有重要意义。
致谢在样品采集过程中得到刚察县、海晏县林草站的大力支持,在此一并致谢。

