过低LDL-C水平在动脉粥样硬化性心血管疾病中潜在风险循证学证据
黄橙 李波 李志勇 陈紫君
(1.重庆医科大学附属永川医院心血管内科,重庆 402160;2.重庆大学附属江津医院心血管内科,重庆 402260)
低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)与动脉粥样硬化相关性已被相关研究所证实[1]。为改善动脉粥样硬化,降低LDL-C水平已经成为共识[2-4]。有专家还提出“零LDL-C的假设”[5],但是随着LDL-C水平被降低得越来越低,新的疑虑也开始出现,过低的LDL-C水平真的安全吗?现结合目前最新发表的相关研究结果对LDL-C过低的潜在风险进行综述。
1 胆固醇的生理作用
胆固醇是动物细胞膜的基本结构成分,可以转化为一些有重要生物学功能的固醇类化合物,体内的一些内分泌腺(如肾上腺皮质、睾丸、卵巢等)以胆固醇为原料合成类固醇激素,在肝内还可转变为胆汁酸,在皮肤可转化为维生素D3。
2 LDL-C过低可能存在的风险
首先,LDL-C水平过低尚无统一的定义。有专家提出LDL-C<1.0 mmol/L为LDL-C水平过低,也有专家提出LDL-C<0.78 mmol/L为LDL-C水平过低[6]。中国及欧美国家的血脂指南,对于降低LDL-C的目标值也不尽相同。《中国成人血脂异常防治指南(2016年修订版)》[7]提出:对于动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)极高危者目标值为LDL-C<1.8 mmol/L,高危者LDL-C<2.6 mmol/L;而对于LDL-C基线数值较高,不能达目标值者,LDL-C至少降低50%。最新《中国血脂管理指南(2023年)》[8]提出:ASCVD超高危患者LDL-C推荐目标值<1.4 mmol/L,极高危者LDL-C<1.8 mmol/L,且较基线下降幅度>50%。最新指南增加了ASCVD超高危患者分类,将LDL-C目标值进一步降低。《2018年美国心脏病学会/美国心脏协会血脂管理指南》[3]提出:对于高危ASCVD患者,LDL-C阈值为1.8 mmol/L时考虑在他汀类药物治疗中加入非他汀类药物。《2019年欧洲心脏病学会/欧洲动脉粥样硬化学会血脂异常管理指南》[4]建议:极高危ASCVD患者LDL-C目标应较基线下降幅度≥50%及<1.4 mmol/L;已接受最大耐受剂量他汀类药物治疗的ASCVD患者,若2年内再发心血管事件,推荐LDL-C水平降至1.0 mmol/L。目前降胆固醇药物主要是他汀类药物,但随着胆固醇吸收抑制剂(依折麦布)、前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂的研发和使用,使得胆固醇水平可以降到前所未有的程度,同时在各种研究结果的支持下,指南推荐的LDL-C达标值也越来越低,但胆固醇作为人体重要组成成分,是否应被降低得过低以及是否会随之带来新的风险值得关注。而随着LDL-C水平降低,一些潜在风险开始显现。
2.1 出血性卒中
许多流行病学研究包括Framingham心脏研究[9]、Multiple risk factor intervention研究[10]、TRIUMPH 研究[11]和Helsinki心脏研究[12]都表明,高胆固醇水平与心肌梗死和缺血性卒中有关,但是有研究[13]表明LDL-C过低反而会增加出血性卒中的风险。
中国慢性病前瞻性研究[13]共招募了来自10个不同地区的512 891例成年人,经过中位数随访时间(9年)后,发现LDL-C在1.7~3.2 mmol/L范围内,LDL-C每增加1 mmol/L,脑出血风险降低14%(RR=0.86,95%CI0.80~0.92)。在一项有96 043例参与者(平均年龄51.3岁)随访了9年的队列研究中发现,LDL-C<1.8 mmol/L的参与者发生脑出血的风险显著高于LDL-C为1.8~2.6 mmol/L的参与者;与LDL-C为1.8~2.6 mmol/L相比,LDL-C为1.3~1.8 mmol/L时,调整后的风险比为1.65(95%CI1.32~2.05),LDL-C≤1.3 mmol/L时,调整后的风险比为2.69(95%CI2.03~3.57)[14]。有研究[15]对脑出血患者在发生脑出血事件前后的血脂变化进行了对比,结果发现脑出血前6个月血浆LDL-C水平较出血前6~24个月平均水平下降了0.56 mmol/L (P<0.003 8)。对女性人群进行的前瞻性队列研究[16]发现,LDL-C水平<1.8 mmol/L的女性发生出血性卒中的风险是LDL-C水平为2.6~3.4 mmol/L组的2.17倍(95%CI1.05~4.48)。台湾相关研究[17]发现低水平的LDL-C还与脑出血患者死亡风险的增加相关,LDL-C<2.6 mmol/L的患者与LDL-C为2.8~3.4 mmol/L的患者相比,脑出血后发生的死亡风险增加了84%(95%CI28%~163%)。在SPARCL研究[18]中,既往脑卒中患者接受阿托伐他汀80 mg治疗,LDL-C平均水平降至1.9 mmol/L,与空白对照组(LDL-C平均水平为3.4 mmol/L)比较发现,治疗组的颅内出血(intracranial hemorrhage,ICH)发生率高于安慰剂组[2.3%(55)vs 1.4%(33),P=0.02]。还有关于血脂水平和出血性卒中相关的meta分析[19]发现,LDL-C与出血性卒中风险呈负相关(RR=0.69,95%CI0.53~0.89,P=0.04)。
有研究[20]认为由于血清胆固醇水平有助于维持血管的完整性,降低胆固醇水平可改变血小板聚集性,从而减小血管壁的阻力。还有研究[21]认为血脂水平过低会削弱内皮细胞功能,在低胆固醇患者中,脆弱的内皮细胞会导致血管破裂和脑出血。但相关机制还待进一步研究明确。
但中国相关队列研究[22]结果显示LDL-C水平与出血性卒中无相关性(P>0.05)。IMPROVE-IT研究[23]是一项随机、双盲、安慰剂对照试验,纳入了18 144例在10 d内住院的急性冠脉综合征患者,其LDL-C基线水平为1.3~2.6 mmol/L (之前服用了降脂药)或1.3~3.2 mmol/L (之前没有服用降脂药)。1个月时根据LDL-C水平分组评估,分为<0.8、0.8~1.3、1.3~1.8和≥1.8 mmol/L 4组,随访6年(平均4.3~7.1年)发现LDL-C水平<0.8 mmol/L组与其他3组在出血性卒中的发生率上没有差异(<0.8 mmol/L组为0.3%,其他组为0.4%~0.9%)。ODYSSEY OUTCOMES研究[24]对18 924例接受强化或最大耐受剂量他汀类药物治疗的近期急性冠脉综合征患者进行了阿莫罗布单抗与安慰剂的比较,在4个月时根据LDL-C水平进行分组,发现即使在LDL-C水平<0.4 mmol/L的患者中,没有明显的出血性卒中额外风险。所以LDL-C水平、降胆固醇药物与原发性非创伤性脑出血的关系还有待进一步的研究。
2.2 神经认知异常
在ODYSSEY LONG TERM试验[25]中,2 341例心血管事件高危患者被随机分配到PCSK9抑制剂阿莫罗布单抗组或安慰剂组。与安慰剂组相比,阿莫罗布单抗组在24周时将LDL-C水平降低了62%(平均1.2 mmol/L),阿莫罗布单抗组有575例(37.1%)患者的LDL-C水平<0.6 mmol/L,结果发现阿莫罗布单抗组比安慰剂组的神经认知不良事件发生率更高(1.2% vs 0.5%)。OSLER研究[26]结果显示依洛尤单抗+他汀类药物治疗组与他汀类药物单一治疗组相比,LDL-C降低了61%,从中位数3.1 mmol/L降低到1.2 mmol/L;依洛尤单抗+他汀类药物治疗组患者报告的神经认知不良事件(谵妄、认知和注意力障碍、痴呆和遗忘状态、思维和感知障碍以及精神损伤障碍)的发生率高于他汀类药物单一治疗组的患者(0.9% vs 0.3%)。还有研究[27]发现 LDL-C水平与帕金森病呈负相关(P=0.04)。
但在EBBINGHAUS研究[28]中未发现类似结果。EBBINGHAUS是FOURIER研究的子研究,招募了FOURIER研究27 564例受试者中的1 204例,依洛尤单抗组的LDL-C水平的中位值为0.8 mmol/L,与安慰剂组LDL-C的平均水平2.4 mmol/L相比降低了59%。随访19个月(中位数时间)后,与安慰剂组相比,依洛尤单抗组的执行功能、记忆或精神运动速度从基线到试验结束没有显著变化[28]。另一项大型综合研究[29]也发现,在治疗52周后,阿莫罗布单抗治疗组LDL-C<0.6 mmol/L患者与LDL-C≥0.6 mmol/L 的患者相比,神经认知不良事件的发生率相似[0.6%(4) vs 0.9%(15),HR=0.51,95%CI0.15~1.71]。
有研究[30]认为脑胆固醇主要通过从头合成形成,血脑屏障阻止脂蛋白胆固醇从循环中摄取。胆固醇代谢缺陷会导致结构和功能性的中枢神经系统疾病,如Smith-Lemli-Opitz综合征、C型Niemann-Pick病和阿尔茨海默病。
2.3 新发糖尿病
在JUPITER研究[31]中,将16 304例参与者随机分为瑞舒伐他汀组(20 mg/d)和安慰剂组,瑞舒伐他汀组中有767例患者LDL-C<0.8 mmol/L,结果发现LDL-C<0.8 mmol/L的患者与LDL-C≥0.8 mmol/L的患者相比,2型糖尿病风险增加(HR=1.56,95%CI1.09~2.23,P=0.01)。在ODYSSEY OUTCOMES研究[24]中,基线水平无糖尿病的6 769例阿莫罗布单抗组患者中,525例患者(7.8%)的连续LDL-C水平<0.4 mmol/L,这些患者新发糖尿病的风险高于安慰剂组(15.1% vs 10.1%,HR=1.46,95%CI1.16~1.85,P=0.001)。一项孟德尔随机化研究[32]发现PCSK9变异(rs11583680、rs11591147、rs2479409、rs11206510),LDL-C每降低1 mmol/L,空腹血糖增加0.09 mmol/L(95%CI0.02~0.15),罹患糖尿病风险大致增加1.29(1.11~1.50)倍。相关遗传学研究[33-34]还发现,PCSK9和3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)常见变异对糖尿病风险的影响非常相似:LDL-C每降低0.26 mmol/L,PCSK9变异组糖尿病风险增加11.1%(OR=1.11,95%CI1.04~1.19),HMG-CoA变异组糖尿病风险增加12.7%(OR=1.13,95%CI1.06~1.20)。
但也有研究提示过低LDL-C水平并不导致新发糖尿病。FOURIER研究[35]是一项纳入27 564例患者的随机、双盲、安慰剂对照试验,研究者将合并ASCVD、LDL-C≥1.8 mmol/L且已经接受他汀类药物治疗的患者随机分配接受依洛尤单抗(每两周140 mg或每月420 mg)治疗或匹配的安慰剂,在48周时发现他汀类药物联合依洛尤单抗组,LDL-C水平降至中位数0.8 mmol/L时,并没有明显增加新发糖尿病风险。
2.4 癌症
一项纳入中国68 759例成年男性的前瞻性研究[36]随访近8年,发现LDL-C和癌症发病率之间存在明显的负相关(HR=0.82)。另一项中国的大型前瞻性研究[37]纳入109 798例男性,经过9年随访发现低LDL-C水平与肺癌风险增加有关(HR=1.38,95%CI1.11~1.72)。Copenhagen City心脏研究[38]发现与血浆LDL-C>4.1 mmol/L相比,血浆LDL-C<2.3 mmol/L的癌症风险增加43%(15%~79%)。在IMPROVE-IT研究[23]中也发现LDL-C<0.8 mmol/L组新发、恶化或复发癌症发生率(9.0%)比LDL-C 0.8~1.3 mmol/L组(8.6%)、1.3~1.8 mmol/L组(8.7%)、≥1.8 mmol/L组(7.5%)更高(P=0.04)。相关meta研究[39]也发现LDL-C水平降低与癌症风险增加相关,LDL-C每降低0.26 mmol/L,癌症增加2.2例/1 000人年(95%CI0.7~3.6)。还有研究发现LDL-C水平与乳腺癌(OR=1.03,95%CI1.01~1.07,P=0.02)[40]、子宫内膜癌(OR=0.88,95%CI0.83~0.93,P=7.26×10-6)[41]风险相关。
有研究[42-43]认为胆固醇通过诱导慢性炎症在癌症发展中发挥作用,还有研究[44]认为低水平胆固醇增加了核因子κB的活性,可能导致细胞增殖,增加癌症风险,相关机制还有待进一步明确。
2.5 白内障和抑郁
Robinson等[45]收集14个随机对照试验数据发现,LDL-C<0.6 mmol/L的患者白内障发生率高于LDL-C≥0.6 mmol/L的患者(2.6% vs 0.8%,HR=3.40,95%CI1.58~7.35) 。HOPE-3临床研究[46]随访1年时,瑞舒伐他汀组LDL-C水平比安慰剂组低1.0 mmol/L,随访3年时低0.9 mmol/L,试验结束时低0.8 mmol/L(两组总体平均差异为0.9 mmol/L,P<0.001),研究结果发现瑞舒伐他汀组白内障手术率显著高于安慰剂组(3.8% vs 3.1%,P=0.02)。但也有研究[23]发现低水平LDL-C组[<0.8 mmol/L组(OR=1.12,95%CI0.78~1.62)、0.8~1.3 mmol/L组(OR=1.20,95%CI0.96~1.50)、1.3~1.8 mmol/L组(OR=1.08,95%CI0.86~1.34)]相较于高水平LDL-C组(LDL-C>1.8 mmol/L)的白内障相关不良事件风险无差异。
一项前瞻性队列研究[47]收集了24 216例50~79岁妇女的数据,随访观察后发现在绝经后妇女中,血清LDL-C<2.6 mmol/L与出现抑郁症状的风险增加有关(HR=1.25,95%CI1.05~1.49,P=0.01)。还有研究[48]表示较低的LDL-C水平与自杀行为风险的增加有关(OR=0.99,95%CI0.98~1.00)。降低LDL-C水平相关重要研究汇总如表1。
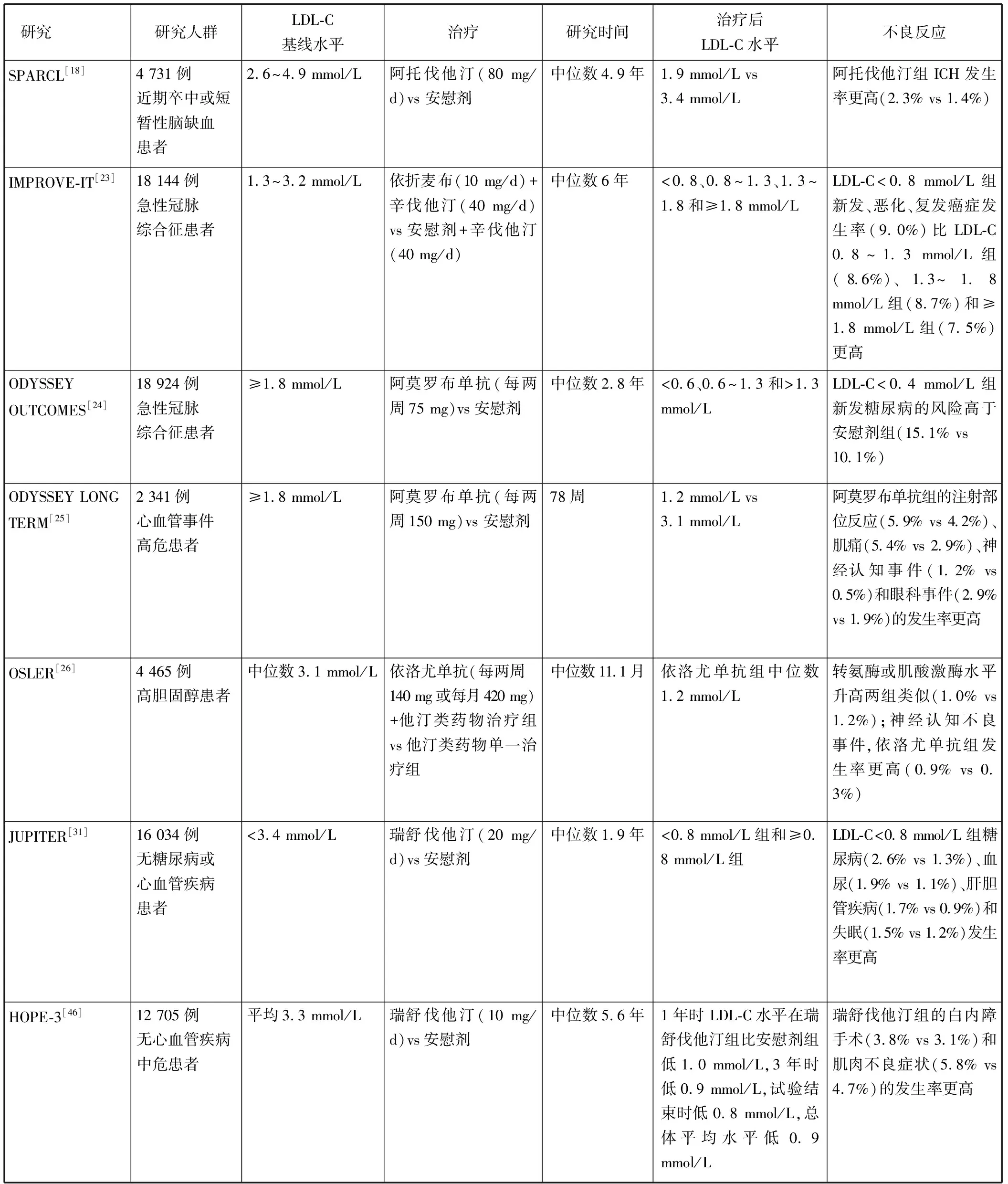
表1 降低LDL-C水平相关重要研究汇总
3 可能的U型曲线
丹麦研究[49]发现LDL-C水平与全因死亡风险之间的关系呈U型曲线,低水平和高水平LDL-C与全因死亡风险增加都相关。LDL-C<1.8 mmol/L和>4.9 mmol/L与LDL-C水平在3.4~4.0 mmol/L相比,全因死亡率HR分别为1.25(95%CI1.15~1.36)和1.15(95%CI1.05~1.27)。同样,在对美国人群随访超过20年的研究[50]中也发现相同结果,LDL-C<1.8 mmol/L的个体与LDL-C 2.6~3.4 mmol/L的个体相比,全因死亡率的HR为1.45(95%CI1.10~1.93),心血管疾病死亡率的HR为1.60(95%CI1.01~2.54),脑卒中死亡率的HR为4.04(95%CI1.83~8.89)。韩国相关队列研究[51]也发现LDL-C与心血管疾病及其亚型的死亡率呈U型曲线。心血管疾病LDL-C的最佳范围为2.3~3.9 mmol/L;缺血性心脏病LDL-C最佳范围为1.8~3.0 mmol/L;缺血性脑卒中LDL-C最佳范围为2.2~3.3 mmol/L;蛛网膜下腔出血LDL-C最佳范围为≥2.2 mmol/L;脑出血LDL-C最佳范围为≥3.3 mmol/L;高血压和心力衰竭LDL-C最佳范围为3.0~4.1 mmol/L;心脏性猝死LDL-C最佳范围为2.6~3.7 mmol/L 。
目前相关机制还尚不明确,有解释认为低水平LDL-C会增加对致命性疾病的易感性,一些研究发现LDL-C结合并灭活范围广泛的微生物和有毒产物,而这些微生物和有毒产物可能是心血管疾病或癌症的致病因素[52-53]。还有解释认为LDL-C水平降低可作为相关死亡率增加的预测因素,LDL-C水平降低是由于相关疾病和虚弱导致的[49],而稳态失调和胆汁酸代谢改变可能为其提供连接[54-57]。
4 总结
降低LDL-C水平已经是心血管疾病预防和治疗的重要基石,但现在越来越多的研究发现过低的LDL-C水平可能存在一定风险。临床工作中,不仅需要关注降低LDL-C水平带来的获益,也需关注可能存在的各种风险。而LDL-C水平究竟应该降低到多少是合适的,还亟待更多、更长时间的研究。