血管紧张素Ⅱ通过抑制人心房成纤维细胞BKCa通道诱导心房纤维化
贾春森 李磊 李劲平 谭宏伟 周伟 聂永梅 于风旭
(西南医科大学附属医院心脏大血管外科,四川 泸州 646000)
心房颤动(房颤)是临床上最为常见的心律失常,有较高的发病率与死亡率,其发病机制复杂,其中以心房纤维化为代表的结构重构是重要始动因素[1]。既往研究证实,血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)可能是促进心房纤维化的重要因子,其作为心脏局部肾素-血管紧张素-醛固酮系统[2]中最具生物活性的因子之一[3],可刺激人心房成纤维细胞分泌转化生长因子-β(transforming growth factor-β,TGF-β),引起胶原蛋白Ⅰ(collagen Ⅰ)和胶原蛋白Ⅲ (collagen Ⅲ)等胶原合成增加,并降低胶原酶活性,促进胶原沉积[4-5],从而导致胶原聚集而引起心房纤维化。
此外,研究表明AngⅡ能在肠系膜动脉平滑肌细胞中调节大电导钙激活钾通道(large conductance calcium-activated potassium channel,BKCa通道)的活性[6],该通道是广泛存在于多种细胞的细胞器中的一种离子通道,受到胞内 Ca2+与电压的共同调节,在去极化时电导可达到200 pS左右[7-9]。该通道由α亚基与β亚基结合后形成,其中α亚基是功能性单位,对β亚基起调节作用。大量研究表明,BKCa通道与高血压[6]、糖尿病肾病[10]、急性心肌梗死[11]、房颤[12]等疾病的发生发展相关。然而,在心房纤维化中,Ang Ⅱ是否通过调控BKCa通道的表达参与其进程尚不清楚。因此,本研究将Ang Ⅱ、BKCa通道以及心房纤维化三者结合起来,探讨BKCa通道在Ang Ⅱ诱导的心房纤维化中的作用,为理解心房纤维化的机制提供新方向。
1 材料与方法
1.1 主要实验试剂
主要实验试剂包括:AngⅡ(Sigma,美国)、蛋白裂解缓冲液(碧云天,中国)、主要抗体(Abcam公司,美国)、蛋白裂解缓冲液(碧云天,中国)、高敏型化学发光检测试剂盒(雅酶,中国)、超纯RNA提取试剂盒(康为世纪,中国)、逆转录试剂盒(东洋坊,日本)、实时荧光定量PCR(qRT-PCR)试剂盒(Qiagen,德国)、脂质体fectamine3000(Invitrogen,美国)、BKCa通道α亚基过表达重组质粒(CMV/KCNMA1/IRES/acGFP1)。
1.2 实验取材
选取于2015年6月—2016年12月在西南医科大学附属医院心脏大血管外科行体外循环手术的27例风湿性心脏病患者,手术期间对右心房组织进行取材。患者纳入标准:(1)确诊为风湿性心脏病;(2)心电图提示为窦性心律;(3)具有外科手术指征;(4)患者与家属同意手术治疗。排除标准:(1)排除心肌梗死引起的瓣膜病变;(2)老年退化性心脏瓣膜病;(3)糖尿病;(4)高血压;(5)动脉粥样硬化;(6)肺动脉高压;(7)房颤;(8)其他:感染性心内膜炎、大血管病变、结缔组织病、恶性肿瘤等。
1.3 原代人心房成纤维细胞的分离培养与鉴定
在无菌操作台取出新鲜的人右心房组织,标准流程处理后加0.1%Ⅱ型胶原酶将其消化至膨松絮状为止,收集细胞,以优化组织块贴壁法[13]培养成纤维细胞,即使用0.01%Ⅱ型胶原酶消化结缔组织中的胶原蛋白,将消化下来的胶原蛋白及结缔组织去除,更利于组织块贴壁,同时提高培养基中血清比例(20%),以增强细胞增殖能力。将分离的成纤维细胞进行细胞接种、传代,培养至70%以上后分别对波形蛋白(成纤维细胞标志物)与肌钙蛋白(心肌细胞标志物)进行免疫荧光染色。
1.4 人心房成纤维细胞模型的建立
使用Ang Ⅱ对人心房成纤维细胞进行建模,将Ang Ⅱ加入细胞培养液,终浓度为500 nmol/L,处理时间为24 h,每隔12 h换液一次。
1.5 实时荧光定量PCR
引物序列见表1。根据超纯RNA提取试剂盒说明书提取细胞总RNA,用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水稀释至50 μL。经核酸电泳检测RNA完整性,ND-1000软件测纯度及浓度,随后按照说明书进行逆转录。按照qRT-PCR试剂盒说明书对cDNA进行扩增,反应条件为:95 ℃,2 min;95 ℃,15 s;57 ℃,30 s,循环40次。采用2-△△CT值的方法分析目的基因的表达水平。

表1 主要引物序列
1.6 蛋白质印迹法
细胞沉淀加入放射免疫沉淀实验裂解液裂解,冰上孵育30 min,每隔5 min进行15 s振荡或用1 mL无菌注射器反复吹打数次。孵育结束后,离心(12 000 g,4 ℃,15 min)得到上清。通过二喹啉甲酸法对蛋白浓度进行测定。制备5%浓缩胶及10%分离胶,先以70 V电泳,待样品电泳至分离胶,转120 V继续电泳40 min,以恒压100 V转膜1 h,转至聚偏氟乙烯膜上,转膜结束对膜洗涤1次,时间3 min,之后以5%脱脂牛奶室温下封闭1.5 h,稀释BKCa通道抗体(1:1 000)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(1:1 000)、collagenⅠ抗体(1:1 000)、collagenⅢ抗体(1:1 000),4 ℃孵育过夜。洗膜,加二抗(1:2 000),室温下孵育1.5 h。洗膜3次,每次10 min,洗膜后将膜浸入现配的高敏型化学发光显影液,成像系统曝光显影,用Image J软件分析灰度值并记录。
1.7 BKCa通道α亚基过表达重组质粒的转染
人心房成纤维细胞培养至90%汇合度进行转染,分别使用OPTI-MEM培养基稀释质粒DNA(CMV/ KCNMA1/IRES/acGFP1)与Lipofectamine 3000 (脂质体3000),室温下静置孵育5 min,随后将二者混合,室温孵育20 min。将细胞分为对照组(不做转染)、过表达BKCa组(wt-BKCa组)和空载组(Vector组)分别进行处理。转染后培养12 h更换新的培养液,继续培养24~40 h后在荧光显微镜下检测转染效果,并筛选稳转细胞用于后续实验。
1.8 全细胞膜片钳技术
使用浓度为200 nmol/L 的BKCa通道特异性阻断剂Iberiotoxin(IBTX)明确成纤维细胞上是否存在功能正常的BKCa通道,AngⅡ预处理用于探究其对BKCa通道的作用。全细胞膜片钳技术用于检测BKCa通道的电流变化,操纵微推进器,控制微管电极与人心房成纤维细胞表面贴附,可见示波器上应答电流减小,此时稍微增加负压(10~20 cm H2O),缓慢增加负压过程中可见示波器上应答电流逐渐下降至0,表明已经形成高阻封接(阻抗10 GΩ以上),即已形成全细胞膜片。全细胞膜片钳记录:钳制电压为-60 mV,测试电压从-60 mV去极化到+60 mV,脉冲阶跃为+10 mV,脉冲时程为300 ms,采样频率为10 kHz。
1.9 统计学分析方法
采用SPSS 22.0软件进行统计分析,计量资料中服从正态分布的变量以平均值±标准差描述,两组之间采用t检验,多组间比较采用单因素方差分析,P<0.05代表差异有统计学意义。
2 结果
2.1 原代人心房成纤维细胞的分离培养与鉴定
心房组织在培养皿中呈黑色团块,4~5 d后,可见细胞从组织块边缘爬出(图1A),并逐渐生长为星状或放射状,不规则排列(图1B),细胞核呈椭圆形传代培养后的人心房成纤维细胞稳定生长,形态良好,免疫荧光染色显示对照组仅能见到蓝色细胞核(图1C)。实验组细胞质呈红色丝状,表示波形蛋白表达阳性(图1D),表明本研究中所分离培养细胞为人心房成纤维细胞;肌钙蛋白染色组仅能见到蓝色的细胞核(图1E),故可排除心肌细胞的干扰,表明提取的人心房成纤维细胞纯度较高。
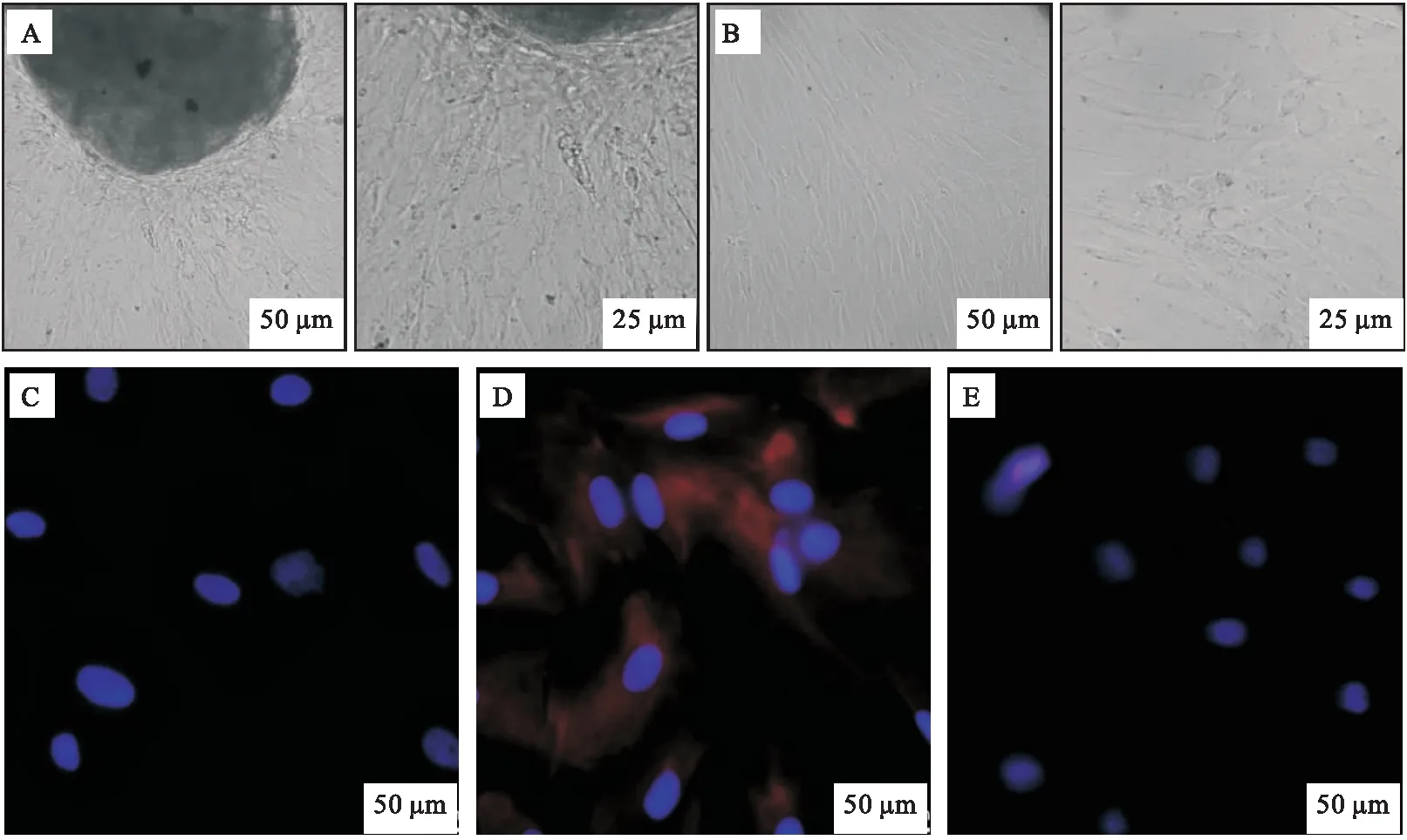
注: A和B,原代成纤维细胞(20倍和40倍);C,对照组波形蛋白阴性;D,实验组波形蛋白阳性;E,肌钙蛋白染色阴性(20 倍)。
2.2 AngⅡ促进人心房成纤维细胞的纤维化
使用AngⅡ处理人心房成纤维细胞进行肌成纤维细胞模型的建立,qRT-PCR结果显示,在mRNA水平,AngⅡ组的α-SMA、collagenⅠ和collagen Ⅲ较对照组明显升高(图2A、2B、2C,P<0.05);蛋白质印迹法结果显示,在蛋白表达水平,AngⅡ组的α-SMA、collagenⅠ和collagenⅢ也较对照组明显升高(图2D、2E、2F,P<0.05)。α-SMA、collagenⅠ和collagenⅢ作为公认的纤维化标志物,在AngⅡ组中明显上调提示了AngⅡ在人心房成纤维细胞中具有致纤维化作用,纤维化模型建立成功。

注:A~C,AngⅡ上调人心房成纤维细胞上α-SMA、collagenⅠ、collagenⅢ的mRNA表达水平,内参为β-肌动蛋白;D~F,AngⅡ上调人心房成纤维细胞上α-SMA、collagenⅠ、collagenⅢ蛋白表达,内参为GAPDH;与对照组比较,∗表示P<0.05,∗∗表示P<0.01。con,对照组;GAPDH,甘油醛-3-磷酸脱氢酶。

A和B,AngⅡ抑制人心房成纤维细胞上BKCa通道 α亚基和 β亚基mRNA表达,内参为β-肌动蛋白;C和D,AngⅡ下调人心房成纤维细胞BKCa通道 α亚基和 β亚基蛋白表达,内参为GAPDH;与对照组比较,∗表示P<0.05,∗∗表示P<0.01。con,对照组;GAPDH,甘油醛-3-磷酸脱氢酶。
2.3 Ang Ⅱ抑制人心房成纤维细胞上BKCa通道的表达
为明确AngⅡ的处理是否可调控BKCa通道的表达,本研究在mRNA与蛋白质水平对BKCa通道的表达情况进行了验证,结果显示,在mRNA水平,AngⅡ处理后人心房成纤维细胞中的BKCa通道α亚基及β亚基较对照组明显降低(P<0.05);在蛋白表达水平,AngⅡ组的BKCa通道α亚基及β亚基也明显降低(P<0.05)。结果表明,AngⅡ在促进人心房成纤维细胞纤维化的同时,抑制了BKCa通道的表达。
2.4 AngⅡ抑制人心房成纤维细胞上BKCa通道的电流密度
全细胞膜片钳结果显示,抑制剂IBTX处理后BKCa通道混合电流较对照组明显减小(图4A、4B),而随着去极化电压的升高,BKCa通道电流幅值也随之升高(图4C),表明人心房成纤维细胞存在功能正常的BKCa通道,具有电压依赖性。
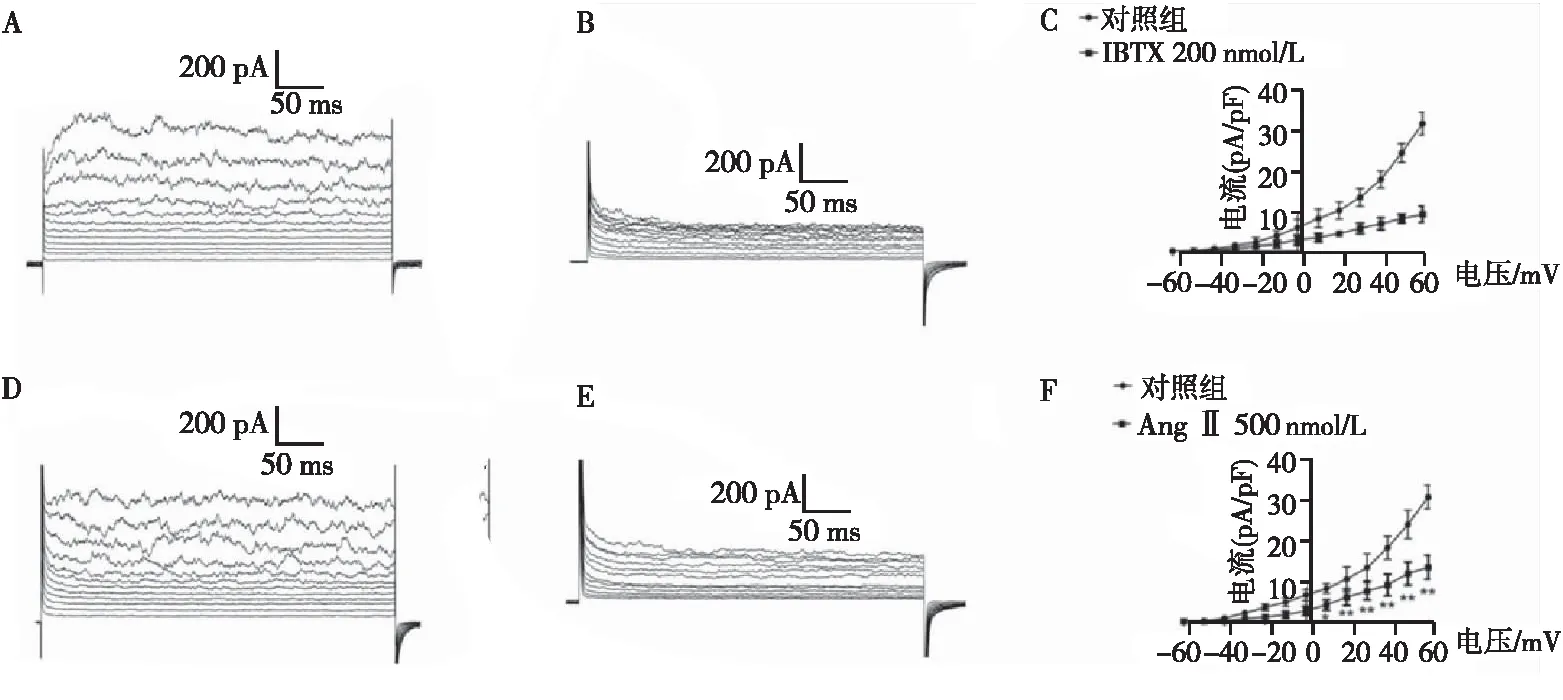
注:A,无IBTX处理对照组(n=5);B,IBTX 200 nmol/L(n=6);C,IBTX 作用后电流-电压关系曲线;D,无AngⅡ处理对照组(n=5);E,AngⅡ1 μmol/L(n=4);F,AngⅡ作用后的电流-电压关系曲线;与对照组比较,∗P<0.05,∗∗P<0.01。
此外,AngⅡ预处理24 h后可明显抑制成纤维细胞上BKCa通道的宏观电流幅度,在+60 mV电压时,BKCa通道电流密度从31.054±2.900下降到13.508±3.000(图4D~4F),表明AngⅡ对人心房成纤维细胞上的BKCa通道电流密度具有抑制作用。综上,AngⅡ不仅抑制了BKCa通道的表达,还对其功能起到了明显的抑制作用。
2.5 BKCa通道α亚基的过表达抑制了人心房成纤维细胞的纤维化
为明确BKCa通道的表达和功能变化是否对人心房成纤维细胞的纤维化有影响,本研究对BKCa通道的功能性亚基(α亚基)进行过表达。结果显示,在mRNA水平,wt-BKCa组的α-SMA、collagenⅠ和collagen Ⅲ较对照组和Vector组均明显降低(图5A~5C,P<0.05);在蛋白表达水平,wt-BKCa组的α-SMA、collagenⅠ和collagen Ⅲ较对照组和Vector组也明显降低(图5D~5F,P<0.05);提示在人心房成纤维细胞中,BKCa通道α亚基的高表达可以有效抑制其纤维化。
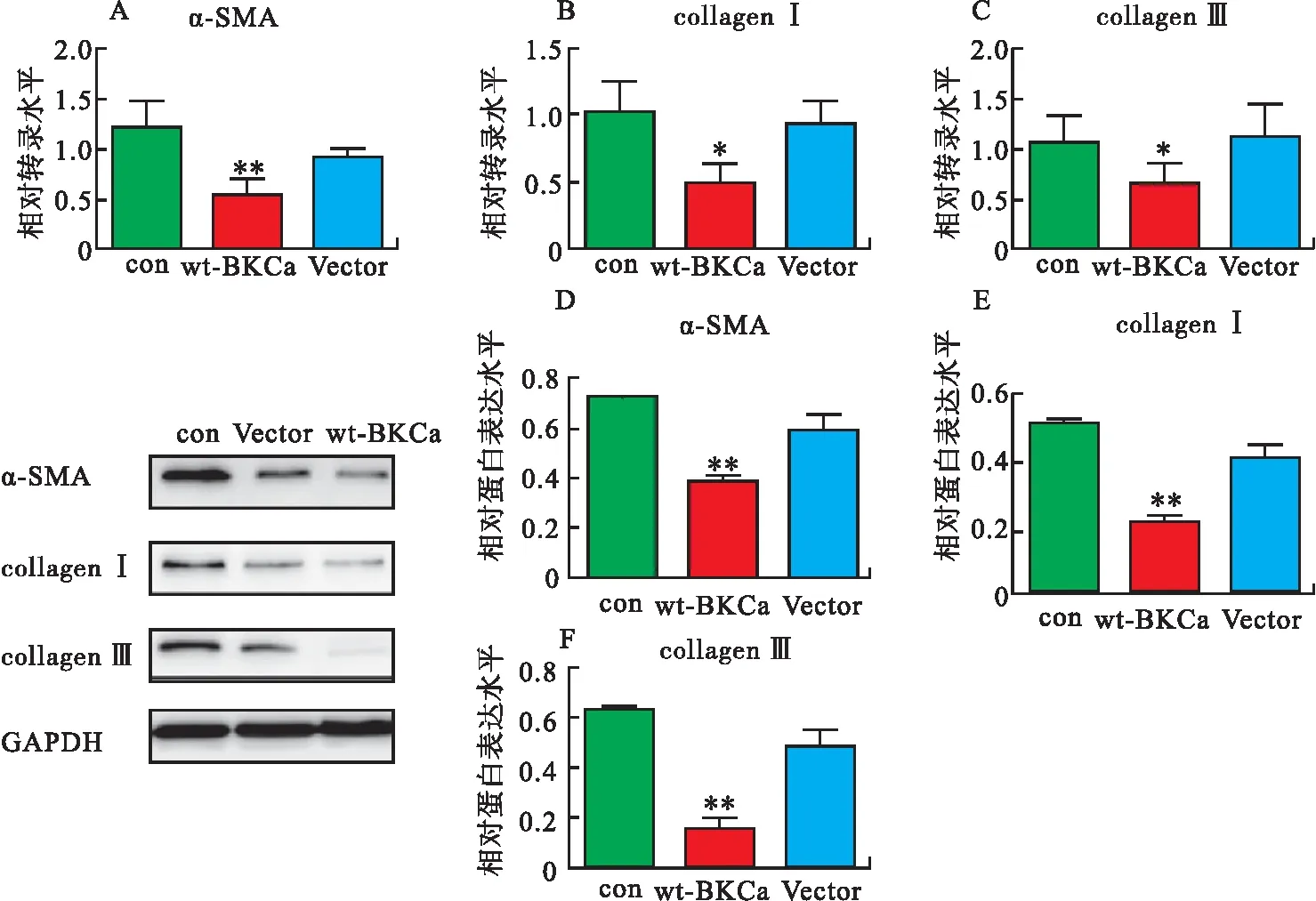
注:A~C,BKCa通道 α亚基过表达下调人心房成纤维细胞α-SMA、collagenⅠ、collagenⅢ的mRNA表达水平,内参为β-肌动蛋白;D~F,BKCa通道 α亚基过表达下调人心房成纤维细胞上α-SMA、collagenⅠ、collagenⅢ的蛋白表达水平,内参为GAPDH;与对照组比较,∗表示P<0.05,∗∗表示P<0.01。con,对照组;GAPDH,甘油醛-3-磷酸脱氢酶。
3 讨论
本研究以人类原代心房成纤维细胞为研究对象,使用AngⅡ处理成功构建了纤维化模型,检测到细胞中纤维化指标α-SMA、collagenⅠ和collagenⅢ的mRNA和蛋白质的表达明显上调,同时,AngⅡ的处理抑制了人心房成纤维细胞中BKCa通道的表达和功能。随后通过过表达人心房成纤维细胞的BKCa通道证实了该通道在人心房成纤维细胞中的高表达能有效抑制其纤维化标志物的表达,证明其对纤维化具有保护作用。因此,本研究认为,AngⅡ可能通过抑制BKCa通道的表达和功能来促进人心房成纤维细胞的纤维化。
既往的研究已证实BKCa通道在血管平滑肌细胞[14]、心肌成纤维细胞[15]和内皮细胞[16-17]的质膜中普遍表达并发挥其功能,但目前关于BKCa通道的研究尚不完整,BKCa通道在不同的细胞系、不同的疾病模型中起到的作用可能会不同。例如,Wen等[6]的研究认为,Ang Ⅱ可以增加血管平滑肌细胞的BKCa通道活化,这与本研究结果相反,可能是由于使用的细胞类型不同导致,而BKCa通道在不同的疾病中也可能表现出完全不同的功能。此外,有研究[18-19]表明一氧化氮通过激活BKCa通道从而诱导血管平滑肌细胞的凋亡,而Ang Ⅱ通过抑制BKCa通道的表达促进血管平滑肌细胞的增殖。而在乳腺癌细胞上,有报道[20]称BKCa通道的激活促进了乳腺癌细胞的增殖[21]、迁移及侵袭。而另一些研究[22]表明,使用BKCa通道特异性阻断剂IBTX对乳腺癌细胞的增殖无明显作用。
类似的,在心血管领域,Sheng等[23]的研究表明,BKCa通道活性可被硫化氢抑制,进而减弱人心房成纤维细胞增殖和分化。Li等[15]的研究报道,使用干扰小RNA在人心室肌成纤维细胞上抑制BKCa通道表达后,人心室成纤维细胞的增殖和分化会被抑制,这与本研究结果相反,这可能是由于不同实验室所使用的细胞来源不同导致的。但Jakob等[12]研究指出,房颤患者右心房成纤维细胞与窦性心律患者右心房成纤维细胞相比,BKCa通道活性较低,提示该通道在房颤的右心房成纤维细胞中受到了抑制,这与笔者团队的结论相符。
本研究证实了BKCa通道表达和功能的增强可抑制AngⅡ诱导的成纤维细胞纤维化,但BKCa通道与纤维化之间是否存在其他下游通路、BKCa通道电流的变化如何影响纤维化尚不得而知,存在一定局限性,需在后续的研究中进一步探索。综上所述,BKCa通道影响成纤维细胞的增殖过程是较为明确的,本研究结果进一步表明AngⅡ处理可通过抑制BKCa通道α亚基和β亚基的表达和功能来促进成纤维细胞的纤维化,并可能借此参与房颤的发生。

