CYP2C19基因多态性指导抗血小板治疗的研究现状
崔鸿杰 吴英锋
(1.首都医科大学宣武医院血管外科,北京100053;2.首都医科大学附属北京潞河医院血管外科,北京101199)
CYP2C19酶是细胞色素P450(cytochrome P450,CYP450)氧化酶超家族中的一部分。许多临床使用的药物包括氯吡格雷(clopidogrel,CPG)、伏立康唑、奥美拉唑、西酞普兰、卡立普多和地西泮等的代谢都是由它来完成的[1],CYP2C19还可以对褪黑素和孕酮等物质进行代谢[2]。使用P2Y12受体拮抗剂(如CPG)和环氧化酶-1抑制剂(如阿司匹林)进行双重抗血小板治疗(dual antiplatelet therapy,DAPT)早已成为国内外维持支架通畅性和预防术后冠状动脉不良事件的“金标准”[3-4]。尽管有新药物如替格瑞洛(ticagrelor,TGL)和普拉格雷(prasugrel,PSG)问世,但临床中的抗血小板药仍以CPG最为常见。CYP2C19基因分型的检测广泛应用于脑卒中、经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)和各类血管外科手术的围手术期和持续治疗之中,来决定是否应用其他抗血小板药替代CPG;尽管有研究表明,其他一些变异基因组(例如ABCB1、B4GALT2、CES1、CYP2B6、CYP2C9、P2RY12和PON1)也参与决定CPG等药物的代谢,但CYP2C19基因组是起主要作用的因素[5-6]。携带缺失等位基因的患者被定义为基因功能缺失。这些患者体内CPG的活性下降,血小板更容易聚集,最终导致心血管疾病(cardiovascular disease,CVD)术后血栓形成及治疗失败的风险增加。
1 CYP2C19基因概述
CYP2C19基因位于第10号染色体长臂23.33处,是4个CYP2C基因亚家族(8、9、18、19)中的一员[7],其编码的CYP2C19酶则由490个氨基酸组成,研究[8]发现CYP2C19基因主要在肝脏和十二指肠中表达。在一般的星号命名法中,正常的等位基因表示为*1,而缺失的等位基因则表示为*2或者*3,超快代谢基因表示为*17。而在最新的临床药物基因组学实施联盟指南[9]中还加入了*9、*12、*14的命名方法,这几种等位基因的作用尚不清楚,见表1。
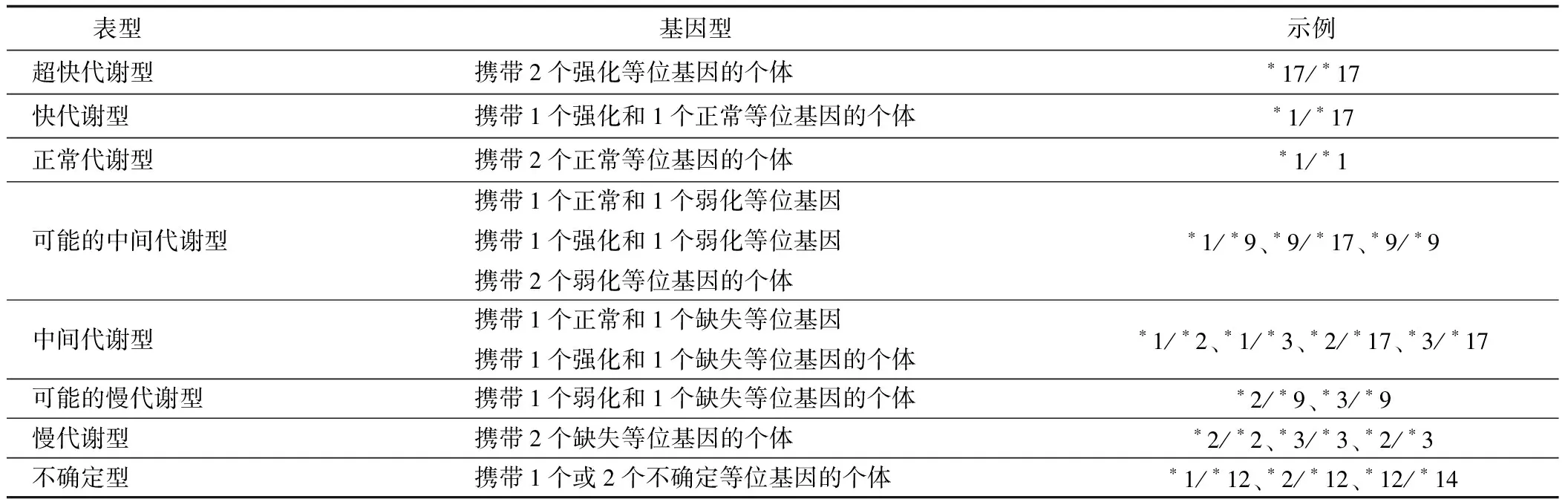
表1 CYP2C19基因分型
研究表明CYP2C19基因在接近60%的亚洲人群中存在至少1种缺失等位基因[10],而在中国,CYP2C19*2是主要缺失等位基因,占中国人中间代谢型和慢代谢型的75%~85%[11]。
2 药物
2.1 CPG
CPG是临床常见的一种在CVD围手术期用于二级预防的抗血小板药。CPG实际上是一种在体外不具有生物活性的噻吩并吡啶类前体物质。CPG进入体内后由CYP450氧化酶经过两步转化为具有活性的硫醇代谢产物(见图1),不可逆地结合血小板P2Y12受体,从而阻断由腺苷二磷酸(adenosine diphosphate,ADP)诱导的血小板聚集[12],在CPG药理作用前体物质2-氧-CPG活化过程中CYP2C19基因的贡献最大[13]。
CPG与阿司匹林相似,都具有累积效应,故长期每日口服75 mg CPG的患者停药后都需要等待至少7~10 d生成新的血小板来恢复功能,二者都没有短半衰期,这是进行DAPT的基础。CPG可能与质子泵抑制剂以及他汀类药物存在竞争作用,从而影响活性,因此专家共识[14]指出,若联用CPG抗血小板治疗者,应选用对CPG影响较小的泮托拉唑或雷贝拉唑。氯吡格雷抵抗(clopidogrel resistance,CR)是评估患者对药物反应性的重要指标,有研究[15]表明,CR的患病率为6%~63%,甚至CR在外周动脉疾病(peripheral arterial disease,PAD)中比其他CVD发病率更高[16]。目前用于评估CPG有效性的方法有:光学比浊法、流式细胞仪血管扩张刺激磷酸蛋白法、床旁快速检测和血栓弹力图等[17-18]。光学比浊法曾是实验室最常用的方法,但由于床旁快速检测和血管扩张刺激磷酸蛋白法具有用时短和规范化等优点,已成为应用最为广泛和专家共识中推荐的方法[19-21]。
2.2 TGL
TGL,曾名替卡格雷,是一种新型P2Y12-ADP受体抑制剂。TGL属于非前体药物,无需转化即可生效。TGL与CPG作用机制相似,都通过结合P2Y12-ADP受体来抑制血小板的活化和聚集。但不同的是,TGL与血小板P2Y12-ADP受体之间的相互作用具有可逆性,没有构象改变和信号传递,并且在停药后血液中的血小板功能也随之快速恢复,这个过程可能需要3~5 d,且TGL不受CYP2C19基因多态性的影响[22]。在PCI后的患者中,TGL似乎可与阿司匹林短暂联合后独立用于抗血小板治疗[23]。而在PAD中,TGL似乎没有比CPG表现出更多的优势[24]。
2.3 PSG
PSG与CPG相似,也需要CYP450氧化酶转化才能变成活性物质。目前PSG主要应用于脑卒中和PCI后,而在PAD治疗中的研究还停留在动物模型阶段[25]。其作用机制是与P2Y12-ADP受体进行不可逆地结合,主要优点是起效较快,不受CYP2C19基因多态性的影响[26],并且在PCI后使用阿司匹林单药的基础上加用PSG可以降低不良事件的风险[27],在PCI后PSG降级治疗已表现出一定优势[28]。
3 CYP2C19指导抗血小板治疗的相关证据
目前有大量的临床试验已经证实慢代谢型(*2/*3等)和中间代谢型(*1/*2等)人群相较正常代谢型人群在相同的药物剂量下有更低的CPG活性和更高的CR[9];但在超快代谢型及快代谢型人群中,其基因型(*17)是否可以指导药物使用尚无定论[5,29]。即使是基因型相同的不同个体,对CPG的反应似乎也存在差异,这可能是因为CPG对ADP介导的血小板聚集的抑制作用存在多样性[30]。对于慢代谢型和中间代谢型患者,有必要进行个体化指导治疗,因为和新型药物相比,CPG过高的出血风险和过多的服药次数所引发的药物耐受值得注意[31-32]。
3.1 PCI
多个研究都推荐可能的中间代谢型、中间代谢型、可能的慢代谢型和慢代谢型等4类患者群体在必要时使用TGL或PSG[33-34]。就目前情况来看,欧美和中国使用最广泛的抗血小板药仍是CPG,而TGL和PSG使用的比例相对偏少,有网状荟萃分析表明PCI后的患者确实可以从个体化治疗中获益[35-36]。Claassens等[37]于2011—2018年在欧洲进行了一项包括2 485例患者的随机对照试验,这个试验是为了评估PCI后指导性抗血小板治疗和标准方案治疗的差别。所有患者按照1:1的比例分配到试验组和对照组,最终试验组完成1年随访的患者有1 240例,这些患者都进行了CYP2C19基因多态性检测,而对照组完成1年随访的1 245例患者没有进行基因多态性检测。获得基因多态性结果后,试验组中携带缺失基因的患者接受TGL或PSG的治疗,而非携带者使用CPG;对照组一律使用TGL或PSG。结果显示:在有效性评估中,试验组有5.1%的患者发生了临床不良事件(死亡、心肌梗死、支架内血栓形成等),而对照组为5.9%;在安全性评估中,试验组有9.8%的患者发生了出血事件(大出血或小出血),而对照组为12.5%。两项指标的差异都具有统计学意义。但Tuteja等[38]进行了一项包括504例患者的随机对照试验,在249例试验组患者中,约30%的患者使用了PSG或TGL,28%的患者携带了缺失基因,携带缺失基因的患者约53%使用PSG或TGL,其余患者使用CPG,结果发现13.7%的试验组患者出现了临床不良事件,而在对照组(255例患者中有21%使用了PSG或TGL)中这个比例是10.2%,指导性抗血小板治疗和标准治疗并没有明显差异。从以上结果可知,并不是所有试验结果都支持指导性抗血小板治疗的优越性,原因可能有二:其一,随机试验的设计与完成程度参差不齐,纳入样本量的多少及随访成功率等都对结果有影响;其二,从以上两个试验来说,后者的试验组中有30%的患者接受了指导性治疗(用TGL或PSG代替CPG),而其余患者由于入组前一直服用CPG并未进行更改,这种情况在对照组中也存在(指导性治疗占21%),所以对照的效果并不显著。另一项纳入1 849例患者的随机对照试验中,Pereira等[39]也发现试验组患者的出血风险和临床不良事件发生率与对照组无明显差异(出血风险:1.9% vs 1.6%;临床不良事件:4.0% vs 5.9%),值得注意的是,该试验组中指导性治疗比例为85%,对照组单纯CPG治疗比例为99%。这提示为了得到质量更高的证据,还需依赖更大规模的荟萃分析。在未来的指导性治疗中,不应该拘泥于CYP2C19等基因的多态性,Zheng等[40]发现,测定血小板的最大聚集率也能用于指导PCI后的抗血小板治疗,由此产生的临床获益显著。因此,多种测定方法并存也许是未来的发展方向。
3.2 脑血管疾病
在短暂性脑缺血发作、缺血性脑卒中以及各种神经介入手术中,75 mg/d的CPG是非常推荐的。不仅如此,单纯的一种药物已经不能满足临床需要,阿司匹林联合CPG的双重方案是目前首选方案[41],甚至是再联合双嘧达莫的三重方案也有使用(尽管出血风险的问题依然没有解决)[42]。但在CYP2C19基因多态性的影响下,对于中间、慢代谢型群体采取个体化指导治疗是有益的,尽管出血风险可能更大[43]。Wang等[43]的试验结果证明了CYP2C19基因指导性治疗在脑血管疾病中的益处,但这项试验只涉及了轻度脑卒中的患者,而实际上中、重度脑卒中患者的比例更大,且如前文所述,中国人(亚洲人种)的缺失等位基因携带率更高,人种因素干扰了试验结果[44]。在此基础上,Pan等[45]发现指导性治疗的效果在短期内(1周)令人满意,随着时间推移,指导性治疗和标准治疗(阿司匹林)之间的差异会减弱。另一项后续研究[46]则表明,指导性治疗在低风险的轻度脑卒中患者中的益处要优于高风险患者。最近一项荟萃分析[47]表明,携带缺失等位基因的缺血性脑卒中或短暂性脑缺血发作患者服用CPG发生脑卒中和各种复合心血管事件的概率要显著高于非携带者。显然,还需要进一步的试验来证明,中、重度脑卒中患者也能从指导性治疗中获益。
3.3 PAD
在各种PAD中,阿司匹林是抗血小板治疗的基石,且在预防症状性PAD相关血栓事件中得到高等级推荐[48]。阿司匹林、CPG单独使用或者联合用药后的降级治疗是目前常用的治疗策略,多个研究表明阿司匹林能或不能减少患者术后的相关风险[49-51]。对于CPG的基因指导个体化治疗而言,目前的研究数据较少,EUCLID试验有近14 000例患者参与,最终表明TGL和CPG给予PAD患者的获益与风险相似[24]。另一项试验在调整EUCLID试验相关基线特征的基础上也得出了和原试验几乎相同的结论[52]。最近的一项回顾性研究中,Lee等[53]纳入了278例因严重下肢缺血而接受腔内干预的患者(其中正常代谢型患者153例、中间代谢型患者79例、慢代谢型患者46例),1年随访后发现患者的无截肢生存率依次为正常代谢型82.1%、中间代谢型66.1%、慢代谢型56.6%;全因死亡率依次为正常代谢型83.7%、中间代谢型72.2%、慢代谢型71.3%;三组均有统计学差异。但由于缺乏随机性,证据等级并不高。令人兴奋的是,一项有关CYP2C19多态性在PAD抗血小板治疗中的指导作用的随机对照试验(GENPAD试验)[54]已经注册,有可能为指导性治疗提供进一步证据。而一项相关的荟萃分析显示,携带缺失基因的PAD患者与CR和CPG有效性下降有关。但由于仅纳入了非随机对照试验,证据等级有待考究。实际上,本研究团队在临床实践中,即使已经明确患者是缺失基因的携带者,绝大部分患者会接受阿司匹林联合CPG的长期治疗,很少有患者能够接受TGL或PSG的治疗,这与中国的现实国情有关。
4 总结和展望
抗血小板治疗一直是心内科、神经外科及血管外科等诸多科室所必备的治疗方法之一,经典的抗血小板药,如阿司匹林和CPG等,在临床中仍处于优势地位,由于CYP2C19基因多态性与阿司匹林的药物代谢及作用机制关系不大,因此没有过多介绍。作为抗血小板治疗的重要组成部分,CR以及其与CYP450氧化酶的关系已经逐渐得到临床医生的认识,由此所引发的个体化指导治疗需求促使TGL与PSG等药物的出现与相关研究。而且大量的临床随机对照试验也表明对于已明确为中间、慢代谢型的患者,使用TGL等药物替代CPG能为患者带来比安慰剂对照具有统计学差异的获益。但目前个体化指导治疗并未大规模开展,一方面是因为美国食品药品监督管理局及欧美相关指南并不建议对所有患者进行常规基因型检测,除非患者具有会导致不良结局的高危因素[33-34,55-56];另一方面,即使掌握了患者的基因型,临床医生也会从费用、依从性、获益与风险等方面进行综合考虑,从而放弃个体化指导治疗。总之,在临床工作中应该具有相关CR的概念和意识,对于确定中间、慢代谢型的患者,有必要向其推荐个体化治疗方案,以减小患者术后发生不良事件的概率,提高医疗效率,避免多次就诊造成浪费。随着相关基因型研究的深入,不确定基因型(*9、*12、*14)的作用可能会进一步被阐明,有助于制定更有效的治疗方案。

