胰高血糖素样肽-1受体激动剂对糖尿病心肌病的影响
林佳音 王莉莉 于小晴
(大连医科大学附属第二医院心内科,辽宁 大连 116000)
全球糖尿病的发病率和患病率正逐年升高,糖尿病患者患心血管疾病和心力衰竭的风险增加[1]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是指在无其他心脏相关危险因素(如冠状动脉相关疾病、高血压和严重的瓣膜疾病等)的情况下,存在异常的心肌结构和表现[2]。DCM可导致心脏收缩或舒张功能障碍,进一步引起射血分数降低的心力衰竭和射血分数正常的心力衰竭,严重影响患者的生活质量[3]。DCM的发病机制尤为复杂,目前研究发现的多种作用机制,主要包括代谢紊乱、胰岛素抵抗、晚期糖基化终末产物的形成、线粒体损伤、氧化应激、内质网应激(endoplasmic reticulum stress,ERS)、炎症反应和细胞凋亡等[4]。
胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂是一种由肠道L细胞分泌的肠促胰岛素,通过增加葡萄糖依赖性胰岛素分泌和抑制胰高血糖素分泌来降低糖尿病患者的血糖[5],并兼具调节多种心血管危险因素,从而抑制动脉粥样硬化进程,减少冠状动脉事件和心血管死亡的发生[6]。GLP-1受体激动剂具有较长的半衰期,在临床试验中的疗效优于许多口服降血糖药,低血糖风险低[7]。目前中国已上市的GLP-1受体激动剂主要有艾塞那肽、利拉鲁肽、度拉糖肽和司美格鲁肽等。现对GLP-1受体激动剂对DCM的影响进行综述,为GLP-1受体激动剂的进一步研究提供参考价值。
1 GLP-1受体激动剂通过调节代谢紊乱影响DCM
高血糖及胰岛素抵抗是DCM最显著的特征,除此之外还伴有钙失调、脂代谢异常、脂质沉积以及多种激素变化的共同作用引起的心肌结构功能的改变。心肌细胞的代谢紊乱主要由胰岛素抵抗引起血糖水平升高导致,发生糖尿病时,机体内的葡萄糖无氧酵解和有氧氧化均存在转化障碍,机体葡萄糖的利用减少,脂肪分解增加,过量的游离脂肪酸被心肌细胞吸收,使心脏利用葡萄糖能力降低[8]。此时,心脏主要依赖脂肪酸氧化提供能量,但高耗氧的同时能量代谢效率低,以甘油三酯形式积累的游离脂肪酸促进了心肌的脂肪变性。因此,长期的高血糖环境、脂代谢异常以及脂质沉积导致了糖尿病患者DCM的发生发展。多项研究显示,GLP-1受体激动剂可通过控制以上多种代谢因素及相关信号通路直接或间接改善心肌细胞的功能。Dungan等[9]的研究显示,GLP-1受体激动剂对空腹血糖、餐后血糖和糖化血红蛋白均有不同程度的作用,26周时度拉糖肽组空腹血糖降低1.93 mmol/L,餐后血糖降低2.56 mmol/L;利拉鲁肽组空腹血糖降低1.90 mmol/L,餐后血糖降低2.43 mmol/L;两组均有68%的患者糖化血红蛋白<7.0% (<53 mmol/mol)。GLP-1受体激动剂通过降低糖尿病患者的血糖水平,进而改善代谢紊乱,间接达到减轻心肌损伤的作用。在Patel等[10]的研究中,GLP-1受体激动剂调节脂代谢的作用也同样得到验证。该研究建立了高血脂、高胆固醇模型小鼠,在治疗8周后与对照组比较,GLP-1组甘油三酯水平降低了(39.5±3.8)%,胆固醇水平降低了(38.5±7.0)%,低密度脂蛋白水平降低了(49.8±5.2)%。在一项研究GLP-1受体激动剂对2型糖尿病患者体重影响的试验[11]中,用药6个月时,不同剂量的利拉鲁肽和艾塞那肽均降低了糖尿病患者1 kg以上的体重,长期应用可能有更为显著的疗效。因此,GLP-1受体激动剂可调节糖代谢、脂代谢和脂质沉积等代谢紊乱,达到减重效果,进而影响DCM的预后,改善患者的远期生存质量。
2 GLP-1受体激动剂通过改善ERS影响DCM
在糖尿病患者机体高糖状态时心脏氧化应激、脂代谢异常以及炎症反应所引起的内质网功能紊乱称为ERS[12]。缺血、缺氧、氧化应激或钙稳态紊乱等病理生理因素会破坏内质网稳态,引起内质网功能障碍,导致未折叠或错误折叠蛋白的积累,从而诱发ERS并触发未折叠蛋白反应,进而激活相应的内质网及钙调节机制等信号转导通路,以恢复内质网稳态。当ERS强度过高或持续时间较长时,内质网无法恢复稳态,此时多种途径诱导细胞凋亡,与多种因素共同作用导致心肌病和心力衰竭[13-14]。越来越多的证据表明,ERS与糖尿病、内皮功能障碍和动脉粥样硬化有关。GLP-1受体激动剂可通过间接作用抑制ERS和降低细胞内钙浓度,从而减轻心肌损伤,其作用可能与ERS信号通路的失活有关[15]。C/EBP同源蛋白(C/EBP homologous protein,CHOP)是ERS发生凋亡的标志性基因,Guan等[16]研究发现,GLP-1受体激动剂通过抑制葡萄糖调节蛋白78、CHOP以及胱天蛋白酶-12(caspase-12)表达,减弱ERS诱导的细胞凋亡,最终实现对心脏的保护作用,且其作用是通过PI3K-Akt信号通路来实现的。
3 GLP-1受体激动剂通过干预炎症反应影响DCM
氧化应激为炎症反应驱动的重要因素,糖尿病患者高糖状态和胰岛素抵抗促使细胞代谢紊乱,释放大量活性氧,进而激活核因子κB,诱导炎症因子表达,损伤血管内皮细胞且使平滑肌细胞异常增殖,长期会影响心脏结构及功能,导致DCM的发生发展[17-18]。而GLP-1受体激动剂可通过直接或间接作用抑制炎症通路、激活AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)途径、降低核因子κB活性、减少炎症介质生成和释放、抑制炎症单核巨噬细胞分化、减少心脏及血管炎症等[15]。Tang等[19]的研究显示,caspase-1可触发白细胞介素-1β和白细胞介素-18的释放,诱导炎症反应。而在Zobel等[20]的研究中,受试者在使用利拉鲁肽治疗26周后,其白细胞介素-1β水平下降34%,肿瘤坏死因子-α水平下降26%。艾塞那肽作为GLP-1受体激动剂,既能直接抑制caspase-1的激活,还能通过下调硫氧还蛋白间接抑制caspase-1的激活,从而改善炎症反应,发挥对心肌细胞的保护作用[19]。有研究[21]显示,利拉鲁肽将C反应蛋白水平降低了35%,也降低了一些额外的炎症标志物水平,包括CD163、E选择素和纤溶酶原激活物抑制物-1等。此外,Chen等[22]在研究中提到NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体参与诱导了心室重塑、心脏疾病(如急性心肌梗死、DCM)和心力衰竭的功能障碍,其通过抑制促分裂原活化的蛋白激酶信号转导途径和环磷酸腺苷的产生,对心肌纤维化和胶原沉积的进展起到了重要作用。因此,NLRP3炎症小体或可成为治疗DCM的新靶点。对于这种联系,相关研究也表明了GLP-1受体激动剂与NLRP3炎症小体的潜在关联。Zhang等[23]的研究在糖尿病神经性疼痛大鼠的脑室内给予GLP-1受体激动剂,减弱了脑小胶质细胞的激活,通过RNA测序发现脑小胶质细胞的NLRP3表达降低;GLP-1受体激动剂还减弱了NLRP3炎症小体活化。Song等[24]的研究也显示,利拉鲁肽减轻中枢神经炎症和脱髓鞘的作用也与NLRP3途径的调控有关。因此推测,GLP-1受体激动剂对NLRP3炎症小体的干预可能直接或间接地影响DCM的转归,但尚缺乏相关研究验证二者间的直接联系。综上,GLP-1受体激动剂可通过干预多种炎症因子的作用影响炎症反应,进而延缓DCM的发展。
4 GLP-1受体激动剂通过保护线粒体及改善氧化应激影响DCM
DCM的组织损伤主要有以下5个机制:(1)葡萄糖及其他糖类通过多元醇途径代谢增加;(2)细胞内晚期糖基化终末产物形成;(3)晚期糖基化终末产物受体及配体表达增加;(4)激活蛋白激酶C亚型;(5)己糖胺途径的活性过度表达。线粒体是心肌细胞中产生活性氧的主要来源之一,活性氧是以上5种途径的上游产物。在机体高糖状态下,由于代谢底物的改变,通过游离脂肪酸氧化增加还原性等价物的传递,可损害电子传递链的能力,使活性氧生成增加,过量的活性氧沉积或抗氧化机制的减弱使氧化还原失衡,导致氧化应激;此过程与高糖状态可同时促进氧化应激和机体炎症反应,损伤心肌细胞,进而导致心肌纤维化、心室肥大、冠状动脉微血管损伤、心脏收缩及舒张功能障碍,最终发展为DCM(图1)[25-28]。在整个DCM的发病机制中,GLP-1受体激动剂对代谢紊乱、活性氧的积聚、ERS、炎症反应的作用均需经过氧化应激环节,氧化应激环节可称作是DCM发病机制的中心环节。因此,干预氧化应激过程是改善DCM预后的重要环节。有研究[29]显示,艾塞那肽通过激活自噬减弱心肌细胞的氧化应激并改善线粒体功能;也可清除功能障碍的线粒体来抑制心肌细胞凋亡,实现抗凋亡和抗氧化作用,保护心脏功能。艾塞那肽还能抑制caspase-1的激活,间接减弱线粒体损伤,减少活性氧沉积,从而减弱氧化应激[19]。Inoue等[30]的研究显示,利拉鲁肽激活AMPK-SIRT1通路,抑制糖尿病大鼠的心脏脂肪变性、氧化应激和细胞凋亡。心肌脂质过载可导致DAG-PKC-NAD(P)H途径的激活,产生氧化应激,引起心脏结构及功能的变化,进展为DCM;而利拉鲁肽可预防这种PKC-NAD(P)H活性的增加,从而干预氧化应激过程,延缓DCM进程。因此,GLP-1受体激动剂可改善缺血心肌的线粒体功能,减弱氧化应激,从而调节心肌代谢和能量利用等,最终改善心脏功能[15]。多项研究[31-34]均显示,GLP-1受体激动剂通过调节代谢紊乱、减轻炎症反应、改善ERS和氧化应激等机制,从而发挥对DCM的治疗作用。
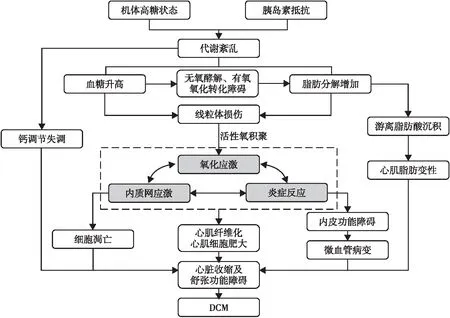
图1 DCM的主要发病机制[4,25-26]
5 GLP-1受体激动剂治疗DCM的探索
对于GLP-1受体激动剂对DCM的潜在治疗靶点,最近的研究也有新发现,Fang等[35]的研究显示,在DCM小鼠的心肌细胞中肌膜相关蛋白(sarcolemma associated protein,SLMAP)显著上调,经艾塞那肽治疗后SLMAP显著下降,进一步研究发现GLP-1受体激动剂通过miR-29b-3p调节SLMAP的表达,这种机制的发现或可能成为GLP-1受体激动剂治疗DCM的作用靶点。同时,也有相关研究通过GLP-1亚型调节机制提供了临床早期筛查及后续治疗的新思路,Zhou等[36]的研究通过人诱导多能干细胞衍生的心肌细胞的DCM模型,评估GLP-1的两种亚型GLP-17-36和GLP-19-36对DCM模型的影响。GLP-17-36的作用靶点可能与核分裂及细胞外基质-受体相互作用有关,GLP-17-36对心肌有丝分裂的调节提示其在抑制心肌细胞肥大和改善心脏收缩功能障碍中的关键作用,这可能显著影响DCM的临床治疗。而细胞外基质对维持心脏结构及功能具有重要作用,细胞外基质的异常可能导致心脏形态变化和心脏重构的发生。GLP-19-36则主要影响动粒微管结合、补体和凝血级联反应,通过血栓调节蛋白基因水平上升,从而抑制补体激活,发挥对心肌细胞的保护作用;GLP-19-36也可调控铁凋亡途径以延缓细胞凋亡。由此,对于GLP-1受体激动剂治疗DCM的相关作用靶点的研究仍在进行,相信此类新探索能为DCM的临床治疗提供新思路。
6 小结
DCM是糖尿病患者主要的心血管相关并发症,目前临床上尚无明确的诊断及治疗指南,因此早期筛查糖尿病、尽早控制血糖、避免严重并发症的发生十分重要。传统的糖尿病治疗药物已不能满足避免并发症及改善预后的治疗要求,GLP-1受体激动剂以其高效、特殊、安全的特征,通过多环节、多机制干预糖尿病在代谢、血管、线粒体功能方面的病理生理层次改变,发挥其心脏保护作用。目前,对GLP-1受体激动剂相关药物的研究仍在继续,随着多种潜在治疗靶点的不断发现,新型降血糖药的研究与开发有望成为糖尿病尤其是DCM等心血管并发症极为重要的治疗措施。

