下丘脑腹内侧核影响心脏自主神经系统的研究进展
刘子韩 余锂镭
(武汉大学人民医院心内科 自主神经调控湖北省重点实验室 武汉大学心脏自主神经研究中心 武汉大学心血管病研究所 心血管病湖北省重点实验室,湖北 武汉 430060)
中国古代“心为思”的哲学理论和中医“心主神明”的观点,都说明心脏除了自身功能外,还能与周围自然环境及大脑功能之间产生相互作用。现代科学研究表明,自主神经系统是介导脑心交互作用的重要桥梁[1]。大脑中主要负责调控心血管功能的神经元密集区,称为心血管中枢[2-3],主要分布于大脑皮层、下丘脑和脑干等区域[4]。下丘脑室旁核(paraventricular hypothalamic nucleus,PVN)是重要的大脑心血管交感信号整合中枢之一[5],在感知外周传入神经和循环神经激素水平变化后,通过心脏自主神经系统(cardiac autonomic nervous system,CANS)调控心血管生理功能[6]。研究表明,一部分下丘脑核团会通过神经投射至PVN,由传出神经进一步发出信号调控心脏自主神经功能。此外,神经体液或免疫途径是另一种下丘脑核团间接影响CANS的途径。下丘脑腹内侧核(ventromedial hypothalamic nucleus,VMH)是和摄食、代谢、情绪以及性行为等相关的区域,与外周多器官的自主神经系统之间都存在联系。现重点讨论VMH与CANS的相关研究进展。
1 VMH结构和功能
VMH是位于间脑基底部附近的双侧下丘脑内侧椭圆形细胞群,从头侧延伸至尾侧,并向外侧进一步伸展[7]。该区域内的细胞水平结构主要包括周围乏细胞区和泛纤维区。乏细胞区含有丰富的树突状突起,是接受终纹床核纤维信号传入的重要位点[8]。根据VMH内部的神经纤维投射以及细胞类型,可将其划分不同的核团亚区,主要包括背内侧区、中央区、腹外侧区和前区。有大量研究发现,VMH可影响自主神经系统功能和活性。Hetherington等[9]发现通过电击靶向损伤VMH脑区可诱导大鼠肥胖,同时摄食增加、机体交感神经活性下降。当用特定参数的电刺激腹外侧区后,可发现大鼠交感神经活性明显升高,并观察到大鼠之间的攻击行为增加[10]。在居住者-入侵者模型测试中发现,产生攻击行为大鼠的腹外侧区脑区有明显表达的即刻早期基因调控的神经活性蛋白,将雄性入侵者放入到居住者鼠笼中,居住者腹外侧区脑区电活动显著增加[11]。在放入雌性入侵者后,居住者腹外侧区电活动会随着性行为的发生而逐渐降低。综上所述,VMH激活通过激活交感神经让机体处于应激状态,该状态下会减少食物摄入、升高血糖水平,同时也会产生焦虑、攻击以及交配行为。
2 VMH与CANS的联系
上述研究表明,VMH与机体自主神经活性调控之间存在直接或间接联系。心脏作为外周最重要的器官,其生理功能也受到自主神经系统的调控,即CANS。现对VMH与CANS之间联系的研究进展作进一步综述。
2.1 VMH投射心血管交感中枢
PVN是下丘脑中交感神经传入和传出及心血管功能调节的重要核团及整合中枢,PVN内相关的神经元核团激活可通过调节心脏自主神经活性从而影响心脏功能,例如通过增强PVN交感神经活性可加重大鼠慢性心力衰竭[12]。研究[13]表明,腹外侧区中含有丰富的表达雌激素受体1的神经元,这些类型的神经元主要是谷氨酸能神经元,可与下丘脑其他区域产生双向神经投射,其中就包括心血管交感整合中枢PVN。Zhou等[14]用化学遗传学工具选择性激活VMH神经元后发现,PVN也同时被激活,并且可进一步增强心脏交感神经活性以提高两肾一夹高血压大鼠模型的血压,从而恶化高血压大鼠的心肌重构。
2.2 心血管交感中枢投射CANS
在PVN的下游脑干区域,同样存在类似的心血管功能调控的重要中枢交感神经相关核团,也就是延髓头端腹外侧区(rostral ventrolateral medulla,RVLM)。动物研究[15]表明,RVLM的电刺激通过增加交感神经活性进一步提高心率和血压。有嗜神经病毒示踪实验[16]表明,PVN与RVLM之间也存在广泛的表达谷氨酸能受体的神经元投射,而RVLM向下可投射至脊髓中间外侧柱(intermediolateral column,IML)处的神经元细胞,向脊髓不同节段负责调控不同器官自主神经系统的神经节进一步发出神经支配。其中,颈1~颈3的颈上神经节、颈7~胸2的星状神经节以及胸7的胸神经节均可在IML处有各自的节前交感神经元胞体,可通过位于椎旁神经节的节后神经元,向下游心脏神经纤维传递重要神经信号,最终影响窦房结、房室结、心房以及心室的生理功能[17]。Wang等[18]向大鼠心脏注射跨多突触伪狂犬病毒逆行示踪,转染心脏自主神经纤维5 d后,发现有增强绿色荧光蛋白标记的示踪病毒不仅存在于心肌交感神经中,还能够转染至颈上神经节、PVN等上游关键交感神经节或核团。电刺激左侧星状神经节后,心脏电活动不稳定性增加,更容易诱发心律失常[19],抑制其活性可降低室性心律失常的发生率,减少心肌重构[20-21]。
3 VMH影响CANS的途径
上述研究已明确了VMH与CANS之间的解剖和功能联系,现对VMH影响CANS可能的神经或体液途径进行综述(见图1)。
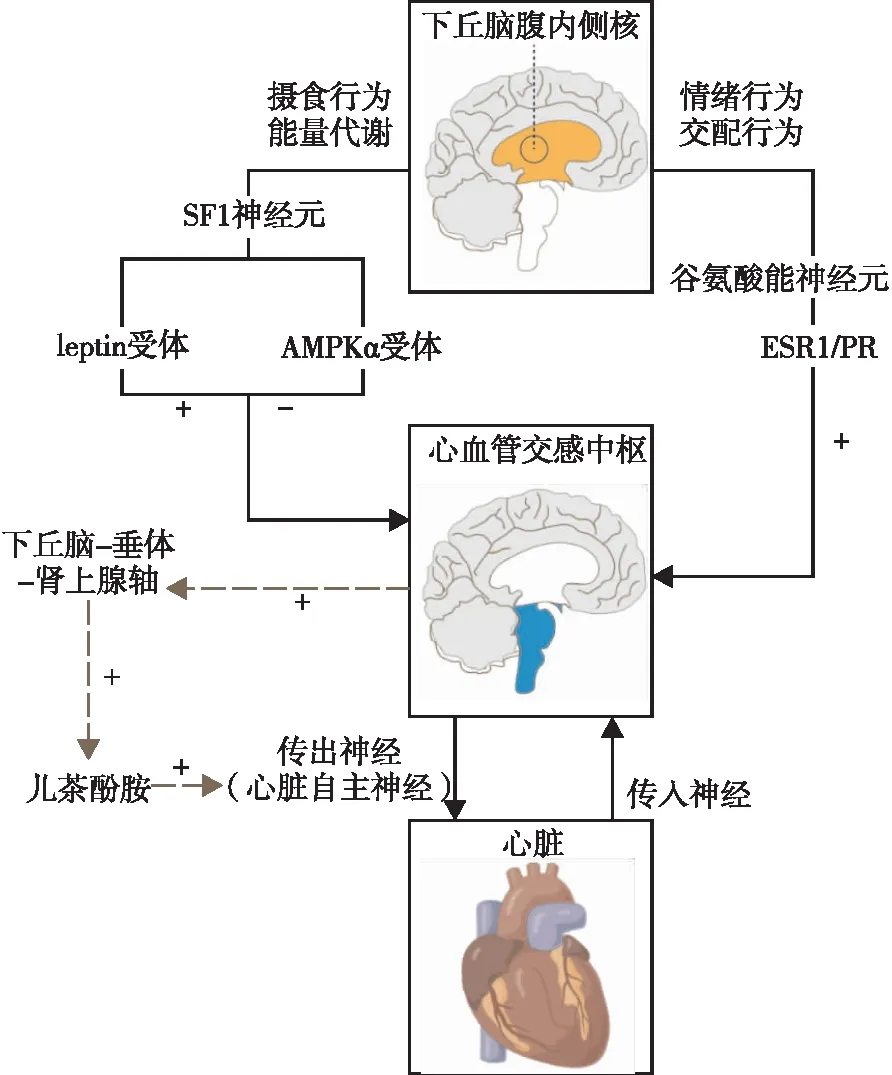
注:SF1,类固醇生成因子1;leptin,瘦素;ESR1,雌激素受体1;PR,孕激素受体。虚线箭头代表神经体液调节途径,实线箭头代表神经调节途径,“+”表示激活效应,“-”表示抑制效应。
3.1 AMP活化蛋白激酶信号通路
AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)是在机体处于低能量情况下会被激发的细胞信号通路。近期研究[22]表明,下丘脑中AMPK调控是调节机体能量平衡的典型机制。一系列实验[23-25]发现,通过药物、激素干预或是基因敲除等方法抑制AMPK活性均会导致交感神经活性增加,进一步刺激棕色脂肪组织产热,提高能量消耗,进而促进体重降低。在细胞水平上,这一作用主要由VMH中的类固醇生成因子1神经元介导,当特异性敲除小鼠类固醇生成因子1神经元上的AMPKα受体后,可增强小鼠对饮食诱导肥胖的抵抗以及代谢改善[26]。决定棕色脂肪组织产热的棕色脂肪组织交感神经传入纤维是由棕色脂肪组织交感前运动神经元驱动的,且该类型神经元起源于脊髓胸段或腰段,向上接受来自RVLM-IML的交感神经网络的投射。该神经网络同时也能向下进一步通过调控心脏自主神经节并对心脏功能产生影响。
3.2 瘦素信号通路
瘦素是一种脂肪细胞来源的血源性饱腹感因子,可直接作用于下丘脑,从而调节食物摄入和能量消耗。研究证实,VMH中的类固醇生成因子1神经元中也有大量的瘦素受体表达,主要调控机体的摄食和体重。Satoh等[27]研究发现,将瘦素直接注射至大鼠VMH后,大鼠的血浆去甲肾上腺素和肾上腺素含量显著增加,但同样方法注入弓状核、室旁核以及下丘脑背内侧核后都无明显的血浆儿茶酚胺类激素的变化,提示瘦素诱导的儿茶酚胺分泌增加主要是通过VMH中的瘦素受体介导的。儿茶酚胺类激素可直接或间接作用于心脏交感神经的肾上腺素能受体,即通过体液途径释放相关神经递质进一步影响CANS。
3.3 雌激素/孕激素信号通路
雄性小鼠腹外侧区表达雌激素/孕激素对于其产生攻击和性行为至关重要[28],其中雌激素的表达与孕激素几乎重叠。Karigo等[29]发现,光遗传学或化学遗传特异性激活腹外侧区中的表达雌激素/孕激素的谷氨酸能神经元,可诱发小鼠的攻击行为,而特异性抑制或特异性敲除其表达可消除这种攻击行为。该种类型神经元约占VMH总体神经元类型的70%。通过大量的嗜病毒标记示踪实验[13]发现,雌激素受体1阳性的VMH神经元与下丘脑背内侧核、中部视前核、室旁核、下丘脑前核、下丘脑乳头体前核腹侧部、终纹床核等有比较强烈的双向投射关系。这提示,雌激素激活的攻击行为可通过心脏交感中枢核团PVN进一步影响CANS。
3.4 下丘脑-垂体-肾上腺轴
下丘脑-垂体-肾上腺轴神经体液途径同样也发挥重要作用。PVN是下丘脑中与下丘脑-垂体-肾上腺轴密切相关的核团,含有丰富的能产生精氨酸加压素的神经元。该类型神经元通过投射至垂体后叶储存和释放精氨酸加压素,以调节血容量和血压。此外,PVN的促肾上腺皮质激素释放激素神经元也可合成精氨酸加压素,其与促肾上腺皮质激素释放激素的协同作用可促进促肾上腺皮质激素的释放[30]。这两种神经元对下丘脑-垂体-肾上腺轴的激活至关重要,在急性应激期间增加来自肾上腺皮质的糖皮质激素以及来自肾上腺髓质嗜铬细胞的大量的儿茶酚胺类神经递质[31]。这些递质大量进入血液循环并聚集于心肌处,过度激活心肌肾上腺素能受体,引起心肌钙离子信号通路紊乱,进而诱发心脏收缩与舒张功能障碍。此外,肾上腺素能神经元激活还会引起心外膜冠状动脉微血管收缩,使心脏供血不足,加重心肌损伤[32]。临床上,较为典型的就是急性情绪或压力应激源诱导大脑相关核团激活时,下丘脑-垂体-肾上腺轴介导心脏表现为严重的左心室功能障碍,即Takotsubo综合征,常威胁患者生命[33]。
4 VMH调控CANS的方式策略
从20世纪40年代开始,电损伤是最早的改变VMH神经元活性的方法之一。随着现代科学发展,VMH中的神经元及其受体类型被进一步鉴别和分类,人们开始尝试脑定位注射受体激动剂或拮抗剂来特异性激活VMH,观察其活性改变引起的机体相关功能性变化。光遗传学工具通过给予光敏通道蛋白能识别不同波长的可见光,改变蛋白受体活性并改变钠/钾离子的内外流及膜电位,实现对神经元活性的调控。化学遗传学通过向神经元转染改造的人类毒蕈碱受体,并用特殊的小分子药物选择性激活这些受体实现神经元的激活或抑制效果[34]。但不论是电损伤、药物注射或者是光/化学遗传学工具的表达,均需通过脑立体定位对VMH脑区进行有创干预,因此仅局限科学研究,进一步临床应用受到限制。若进一步探究VMH调控对于防治脑心相关心血管疾病的可能性,需要寻找精准及无创的调控方式。经颅磁刺激是一种通过电磁感应对大脑进行电刺激的安全且无创的治疗方法,通过使短暂的电流通过磁线圈产生短暂的高强度磁场,从而激活或抑制线圈下方脑区。随着技术的发展,可调控重复经颅磁刺激技术出现,并在临床精神病、神经疾病及康复领域获得越来越多的认可。它主要通过不同的频率来达到治疗目的,高频(>1 Hz)可产生兴奋性突触后电位总和,导致刺激部位神经异常兴奋,低频(≤1 Hz)则是抑制的作用。重复经颅磁刺激已被证实能对多种神经疾病具有较好的治疗效果。例如在一项纳入29例双相情感障碍患者的随机双盲试验[35]中发现,有55.7%的患者在4周的重复经颅磁刺激治疗后有较明显的缓解效果。尽管经颅磁刺激是一种无创的干预技术,但是由于磁场范围和强度的限制,仅能调控颅骨下皮层部分,并不能影响更深层的VMH[36],未来要实现VMH的无创调控可能需要进一步增强经颅磁刺激刺激的范围和精准度。
5 总结及未来展望
自主神经系统是影响心血管疾病发生和发展的重要因素,其中交感神经是心血管疾病的重要调控靶点。VMH不仅在生物的代谢功能和行为改变上发挥重要的调控作用,同时还是大脑-心脏自主神经交互神经网络中的重要一环,VMH可通过CANS影响其生理功能。但VMH调控自主神经和心血管功能的上下游神经环路以及进一步的分子机制尚未得到完全验证。当前随着科学技术的进步发展,出现许多与脑核团精准调控相关的新技术,例如经颅磁刺激技术等。未来在明确VMH在CANS调控中作用的基础上,再将VMH作为调控靶点,可开拓更加精准无创化的核团调控方法,进一步探究能诊治脑-心相关的心血管疾病的新思路和新策略。

