猪呼吸道病原菌多重PCR检测方法的建立及应用
吴 艳,黎娜铭,2,张宇鑫,张 伟,陈穗莲,黄 云,田永宽,曾智勇,吴学祥*,王 彬*
(1.贵州大学动物科学学院,贵州贵阳 550025;2.贵州省独山县麻尾镇人民政府,贵州独山 558200)
猪呼吸道疾病是世界范围内猪生产中最常见的健康问题之一。尽管在诊断、控制和预防领域取得了重大进展,呼吸系统疾病仍然是商品猪生产中面临挑战的问题。引起猪呼吸道疾病的病原种类较多,包括细菌、病毒及支原体等病原体[1]。其中与猪呼吸道感染有关的病原菌包括猪链球菌(Streptococcussuis,SS)、猪胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,App)、猪多杀性巴氏杆菌(Pasteurellamultocida,Pm)、副猪嗜血杆菌(Haemophilusparasuis,Hps)、猪支气管败血波氏杆菌(Bordetellabronchiseptica,Bb)等以及猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)。以上病原菌常呈现混合感染,不仅使猪群发病更严重,也增加了诊断的困难程度[2]。因此,临床上迫切需要建立一种能同时检测猪呼吸道疾病病原菌单独或混合感染的方法。PCR检测方法具有高度特异性和敏感性,是临床检测病原菌常用的方法,而多重PCR(mPCR)可以在一次反应中检测多种目标病原菌,极大的节约了时间和成本,为相关疫病大规模流行病学调查提供了技术支持[3]。本研究针对SS、App、Pm、Hps、Bb和Mhp对应的gdh、apxⅣA、KMT1、16SrRNA、fla和p36ldh基因分别设计特异性引物,经过系列条件的优化,建立一种能同时检测SS、App、Pm、Hps、Bb和Mhp的多重PCR,并将其应用于贵州省各猪场猪呼吸道病原菌的临床检测,为相应病原的快速诊断及流行病学调查提供了技术手段。
1 材料与方法
1.1 材料
1.1.1 菌株及临床样品 支气管败血波氏杆菌和多杀性巴氏杆菌A型,由华中农业大学吴斌教授惠赠;猪胸膜肺炎放线杆菌血清1型2株,分别由湖南农业大学余兴龙教授和吉林大学雷连成教授馈赠;猪肺炎支原体168株灭活菌液,由江苏省农业科学院冯志新研究员馈赠;链球菌菌株和副猪嗜血杆菌菌株血清6型,由华中农业大学金卉教授馈赠;大肠埃希氏菌、奇异变形杆菌、停乳链球菌、金黄色葡萄球菌,由本实验室分离保存。临床样品取自2020年10月至2021年3月贵州省9个市(州)部分猪场的发病猪鼻拭子(25份)、发病猪肺脏组织病料(14份)和表观健康猪鼻拭子(430份)样品共469份。
1.1.2 主要试剂 Goldview核酸染料,百泰克公司产品;琼脂糖,Biowest公司产品;PremixTaqTM(TaKaRaTaqTMVersion 2.0 plus dye),宝生物工程(大连)有限公司产品;2×TaqMaster Mix (Dye Plus)、2×TaqPlus Master Mix Ⅱ(Dye Plus)、GreenTaqMix (with ddH2O)、2×AceTaqMaster Mix (Dye Plus)、DL 2 000 PLUS DNA Marker,南京诺唯赞生物科技股份有限公司产品;2×SanTaqPCR Master Mix (with Blue Dye),生工生物工程(上海)股份有限公司产品;金牌Mix(green),北京擎科新业生物技术有限公司产品;细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司。
1.1.3 主要仪器设备 PCR扩增仪(T100TMThermal Cycler)、Ge1 DOC XR凝胶成像系统,美国Bio-Rad有限公司产品;电泳仪(JY600C)和电泳槽(JY-SPCT),北京君意东方电泳仪设备有限公司产品;超净工作台(SW-CJ-ID(D),苏州苏泰净化设备工程有限公司产品;Thermo高速冷冻离心机(17R),美国Thermo Fisher有限公司产品。
1.2 方法
1.2.1 引物设计 参考文献报道和NCBI中AppapxⅣA(FJ807045.1)、PmKMT1(AF016259.1)、SSgdh(AB246887.1)、Bbfla(Hozbor D等[4])、Hps 16SrRNA(AB004041.1)和Mhpp36ldh(MG813444.1)序列,利用NCBI Primer Blast、Primer 5.0软件和PrimerSelect软件,按照引物设计原则,设计6对特异性引物(表1),引物均由生工生物工程(上海)股份有限公司合成。

表1 引物序列及大小
1.2.2 细菌核酸的提取 采用细菌基因组DNA提取试剂盒根据说明书分别提取纯化后SS、App、Pm、Hps、Bb、Mhp、大肠埃希氏菌、奇异变形杆菌、停乳链球菌、金黄色葡萄球菌、肺炎克雷伯菌的基因组DNA,置-20 ℃冰箱中保存备用。
1.2.3 单项PCR扩增及反应条件的优化 确定单项PCR反应体系为25 μL,对单项PCR的引物添加量和退火温度进行优化,引物浓度为10 μmol/L,引物添加量优化范围为0.5~2.5 μL,退火温度优化范围为50~62 ℃。优化结束后,选取最优反应条件进行单项PCR扩增,取5 μL PCR扩增产物在10 g/L琼脂糖凝胶上进行电泳检测,其余PCR产物送生工生物工程(上海)股份有限公司测序鉴定。
1.2.4 多重PCR扩增及反应条件的优化 在单项PCR各反应条件优化的基础上,多重PCR反应体系选择为50 μL,对多重PCR的引物添加量和退火温度进行优化。引物浓度为10 μmol/L,App引物添加量优化范围为0.25~2.5 μL,Pm、SS、Hps、Bb和Mhp的引物添加量优化范围为0.25~1.0 μL,退火温度优化范围为50~62 ℃。
1.2.5 多重PCR特异性试验 采用优化后的反应条件,分别以SS、App、Pm、Hps、Bb、Mhp、大肠埃希氏菌、奇异变形杆菌、停乳链球菌、金黄色葡萄球菌和肺炎克雷伯菌的DNA为模板进行多重PCR扩增,设ddH2O为阴性对照,评估建立的多重PCR方法的特异性。
1.2.6 多重PCR敏感性试验 将1.2.2提取的各目的病原菌基因组DNA利用微量分光光度计测定浓度,根据Genome中登录的参考菌株基因组碱基总长度中位数(SS:2.106 23 Mb、App:2.275 54 Mb、Pm:2.320 25 Mb、Hps:2.248 12 Mb、Bb:5.199 88 Mb、Mhp:0.725 85 Mb),采用公式:基因组DNA拷贝数(copies/μL)=(6.02 × 1023) × (核酸浓度(ng/μL)× 10-9) / (DNA 长度(bp) × 660),计算各细菌基因组DNA拷贝数。将各菌基因组DNA按1.2.4优化后的比例混合,用灭菌的ddH2O 10倍倍比稀释(10-1~10-8),按照1.2.4建立的多重PCR方法扩增,以检测多重PCR方法的敏感性。
1.2.7 多重PCR对临床样品的检测 取发病猪肺脏组织20~30 mg等比加入灭菌ddH2O,匀浆,11 500 r/min离心1 min,弃上清,取沉淀利用细菌基因组DNA提取试剂盒提取14份发病猪肺脏组织样本中细菌的DNA;分别取25份病猪鼻拭子置于2 mL生理盐水中充分混匀,于11 500 r/min离心1 min,弃上清,利用细菌基因组DNA提取试剂盒提取沉淀中细菌的DNA;取表观健康猪鼻拭子置于TSB培养基中摇床振荡过夜培养,培养菌液于11 500 r/min离心1 min,弃上清,取沉淀利用细菌基因组DNA提取试剂盒提取430份表观健康猪鼻拭子经过夜培养后细菌的DNA。并用所建立的多重PCR和1.2.3所述的单项PCR方法对469份临床样品进行检测,比较多重PCR和单项PCR的检测结果,计算两者的符合率。
2 结果
2.1 单项PCR扩增及反应条件优化结果
利用表1中的6对引物分别对SS、App、Pm、Hps、Bb和Mhp的基因组DNA模板进行单项PCR扩增。结果显示,单项PCR最佳反应体系为:2×AceTaqMaster Mix (Dye Plus) 12.5 μL,DNA(SS/App/Pm/Hps/Bb/Mhp)模板均为2.0 μL,App、Bb上、下游引物量(10 μmol/L)各为1.5 μL ,Pm、SS、Hps和Mhp上、下游引物量(10 μmol/L)各为1.0 μL,ddH2O补足25μL。单项PCR最佳反应程序为:95 ℃5 min;94 ℃30 s,62 ℃45 s,72 ℃45 s,共35个循环;72 ℃10 min。在以上优化条件下,单项PCR扩增效果最佳(图1)。
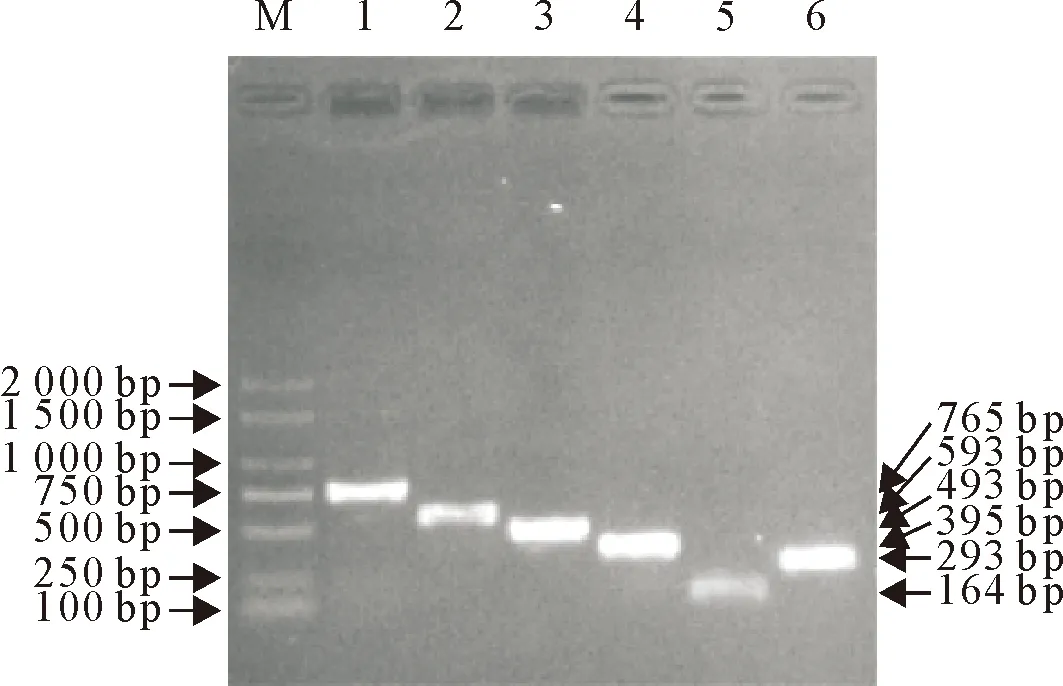
M.DNA标准DL 2 000; 1.App; 2.Pm; 3.SS; 4.Hps; 5.Bb; 6.Mhp
2.2 多重PCR扩增及反应条件优化结果
以6种病原菌DNA混合进行多重PCR扩增,对引物添加量和退火温度进行优化。结果显示,多重PCR最佳反应体系为:2×TaqPlus Master Mix Ⅱ 25 μL,加入引物(10 μmol/L)量为App 2.5 μL,Bb 1.0 μL ,Pm 、SS、Hps、Mhp 各0.5 μL,DNA模板量为App 5.0 μL,Pm、SS、Hps和Mhp各1.0 μL,Bb 2.0 μL,灭菌ddH2O补足50 μL。多重PCR最佳反应程序:95 ℃ 5 min;94 ℃ 30 s、62 ℃ 45 s、72 ℃ 1 min,共30个循环;72 ℃ 10 min。多重PCR反应退火温度优化,在50~62 ℃温度范围内均能扩增出6条PCR产物条带,且无非特异性扩增,为了避免实际应用中非特异性条带的干扰,因此选择62 ℃作为退火温度(图2)。

M.DNA标准DL 2 000;1~8.退火温度分别为50.0、50.8、52.3、54.6、57.3、59.6、61.1、62.0℃
2.3 多重PCR特异性试验结果
分别以这6种病原菌的混合和单独基因组DNA为模板,用1.2.2建立的多重PCR方法进行扩增。结果显示,该方法仅对SS、App、Pm、Hps、Bb和Mhp混合或单独基因组DNA有特异性扩增,对大肠埃希氏菌、奇异变形杆菌、停乳链球菌和金黄色葡萄球菌DNA及阴性对照均无扩增条带(图3),表明所建立的多重PCR方法特异性强。

M.DNA标准DL 2 000;1.阴性对照;2.App、Pm、SS、Hps、Mhp和Bb混合基因组DNA;3.APP;4.Pm;5.SS;6.HPS;7.Bb;8.Mhp;9.大肠埃希氏菌;10.奇异变形杆菌;11.停乳链球菌;12.金黄色葡萄球菌
2.4 多重PCR敏感性试验结果
紫外分光光度计测定提取的病原菌DNA浓度分别为SS 20 ng/μL、App 262.5 ng/μL、Pm 21.9 ng/μL、Hps 22.2 ng/μL、Bb 43 ng/μL、Mhp 30.7 ng/μL,计算得到各病原菌DNA的拷贝数分别为SS 8.66 ×106拷贝/μL、App 1.05×108拷贝/μL、Pm 8.61 ×106拷贝/μL、Hps 9.01×107拷贝/μL、Bb 7.54×107拷贝/μL、Mhp 3.86×108拷贝/μL,将其按照1.2.2的体系混合后10倍倍比稀释(10-1~10-8),采用建立的多重PCR进行扩增。经测定,6种病原菌DNA的最低检限分别为SS 8.66 ×102拷贝/μL、App 1.05×104拷贝/μL、Pm 8.61 ×102拷贝/μL、Hps 9.01×102拷贝/μL、Bb 7.54×102拷贝/μL、Mhp 3.86×103拷贝/μL(图4),表明该方法的敏感性较高。
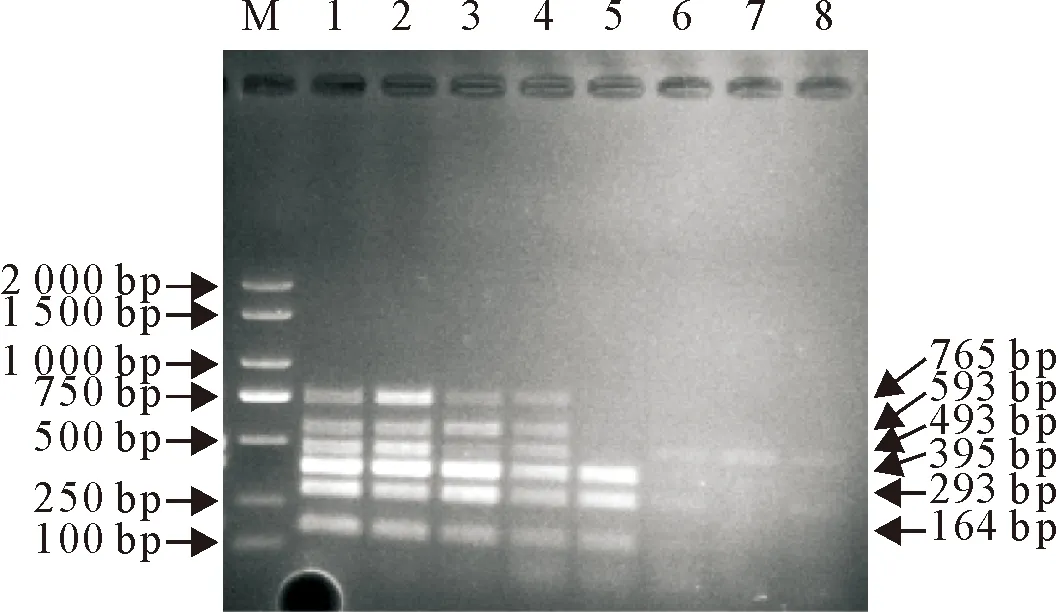
M.DNA标准DL 2 000;1~8依次为101~ 108稀释的各菌混合物
2.5 多重PCR对临床样品的检测结果
利用本研究建立的多重PCR和单项PCR对贵州省不同地区的469份临床样品进行检测。结果显示,多重PCR中6种病原菌的阳性检出率分别为:App 0.85%(4/469)、Pm 15.35%(72/469)、SS 59.49%(279/469)、Hps 52.67%(247/469)、Mhp 6.40%(30/469)、Bb 5.12%(24/469);各病原菌单项PCR的阳性检出率为App 1.07%(5/469)、Pm 18.12%(85/469)、SS 60.13%(282/469)、Hps 53.09%(249/469)、Mhp 6.61%(31/469)、Bb 5.54%(26/469)(表2)。混合感染主要以SS和Hps为主,阳性检出率为30.92%(145/469),其次是Pm、SS和Hps混合感染,阳性检出率为7.04%(33/469)(表3),其他混合感染情况占比较低。多重PCR和单项PCR方法的总阳性符合率为96.76%,表明本研究建立的多重PCR方法可用于临床样品的检测。

表2 样品中病原菌检测结果

表3 样品中病原菌感染情况
3 讨论
猪呼吸道疾病在临床上多发,是养猪业最常见的疾病之一。猪肺炎支原体(Mhp)和胸膜肺炎放线菌(App)常与猪链球菌(SS)、副猪嗜血杆菌(Hps)、猪支气管败血波氏杆菌(Bb)和多杀性巴氏杆菌(Pm)等病原菌混合感染或继发感染,引起的发病症状相似且能增加猪呼吸道疾病的严重程度[5-7],给临床诊疗造成极大的困扰和经济损失。因此,建立一种能准确快速诊断Mhp、App、SS、Hps、Bb和Pm的检测方法是临床诊疗的迫切需求。多重PCR作为PCR最重要的衍生技术之一,可以同时检测多种病原菌,具有高效性和灵活性,在世界范围内得到广泛的应用[8-9]。本研究针对SS、App、Pm、Hps、Bb和Mhp这6种常见猪呼吸道病原菌的相关基因设计特异性引物,经过反应条件和反应程序的优化,建立了同时检测上述6种猪呼吸道病原菌的多重PCR,该多重PCR能对临床样品进行快速、特异和敏感的检测,使临床病例的诊断和流行病学的调查更加快捷。
根据多重PCR引物设计原则,本研究针对AppapxⅣA、PmKMT1、SSgdh、Hps 16SrRNA、Mhpp36ldh和Bbfla的部分基因片段,设计了6对特异性引物。在该多重PCR目的基因的选择上,其中App的4种apx毒素基因中,仅有apxⅣA存在于App所有的血清型中,而apxⅣ由apxⅣA基因编码,因此选取的apxⅣA基因具有种特异性[10]。细胞壁蛋白基因KMT1对Pm高度保守和特异[11]。猪链球菌gdh基因在猪链球菌荚膜类型中十分保守,与地理来源无关,因此针对该基因设计的引物具有特异性[12]。p36基因编码乳酸脱氢酶,此酶是Mhp的一种特异性免疫蛋白[13]。fla为Bb鞭毛蛋白基因[14],该基因具有种属特异性。Hps 16SrRNA基因序列设计的引物可以与其他细菌区分[15]。将上述引物扩增出的条带进行比对测序,并使用DNA Star软件分析核苷酸相似性,结果发现所选取的目的基因片段与NCBI中相关基因片段同源性均在98.6%以上,表明所选取的目的基因片段均高度保守和特异。
本研究采用建立的多重PCR对贵州省469份临床样品进行检测,结果显示,SS和Hps的感染率最高,Pm、Mhp和Bb次之,App感染率最低。多重PCR和单项PCR检出病原菌的总阳性符合率较高,为96.76%,证明本研究建立的六重PCR检测方法可靠。同时,这些样品普遍存在混合感染情况,其中SS和Hps的混合感染情况最严重,占总样本数的30.92%,其次是Pm 、SS和Hps的混合感染,占总样本数的7.04%,未检测出同时感染这6种病原菌的临床样品。薛云等[2]对华中地区猪群的研究结果显示,Mhp和Hps的混合感染率最高,占19.2%,其次是Mhp和Bb混合感染,占12.0%。丁文文等[16]对河南及周边省份2 445个临床样本的研究结果显示,Hps的感染率最高,占21.7%。以上结果表明,全国各地区的猪群呼吸道感染情况具有地方特点,提示在防控猪呼吸道疾病时,应做到因地制宜。与传统的细菌分离方法相比,本研究建立的方法更加快速、便捷、高效,具有较好的实用性,为猪呼吸道疾病临床病例快速鉴别诊断及流行病学调查提供了技术支撑。

